Глава 3. ХИМИЧЕСКАЯ СВЯЗЬ
Способность атома химического элемента присоединять или замещать определенное число атомов другого элемента с образованием химической связи называется валентностью элемента .
Валентность выражается целым положительным числом, лежащим в интервале от I до VIII. Валентности, равно 0 или больше VIII нет. Постоянную валентность проявляют водород (I), кислород (II), щелочные металлы – элементы первой группы главной подгруппы (I), щелочноземельные элементы – элементы второй группы главной подгруппы (II). Атомы других химических элементов проявляют переменную валентность. Так, переходные металлы – элементы всех побочных подгрупп – проявляют от I до III. Например, железо в соединениях может быть двух- или трехвалентным, медь – одно- и двухвалентна. Атому остальных элементов могут проявлять в соединениях валентность, равную номеру группы и промежуточные валентности. Например, высшая валентность серы равна IV, низшая – II, а промежуточные – I, III и IV.
Валентность равна числу химических связей, которыми атом химического элемента связан с атомами других элементов в химическом соединении. Химическая связь обозначается черточкой (–). Формулы, которые показывают порядок соединения атомов в молекуле и валентность каждого элемента называются графическими.
Степень окисления – это условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер. Это означает, что более электроотрицательный атом, смещая к себе полностью одну электронную пару, приобретает заряд 1–. Неполярная ковалентная связь между одинаковыми атомами не дает вклада в степень окисления.
Для вычисления степени окисления элемента в соединении следует исходить из следующих положений:
1) степени окисления элементов в простых веществах принимается равными нулю (Na 0 ; О 2 0);
2) алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, равна нулю, а в сложном ионе эта сумма равна заряду иона;
3) постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов, цинка, кадмия (+2);
4) степень окисления водорода в соединениях +1, кроме гидридов металлов (NaH и т.п.), где степень окисления водорода –1;
5) степень окисления кислорода в соединениях –2, кроме пероксидов (–1) и фторида кислорода OF 2 (+2).
Максимальная положительная степень окисления элемента обычно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь.
Исключение составляют фтор, кислород, железо: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе.
Атомы химических элементов (кроме благородных газов) могут взаимодействовать между собой или с атомами других элементов образуя б.м. сложные частицы – молекулы, молекулярные ионы и свободные радикалы. Химическая связь обусловлена электростатическими силами между атомами, т.е. силами взаимодействия электронов и ядер атомов. В образовании химической связи между атомами главную роль играют валентные электроны , т.е. электроны, расположенные на внешней оболочке.
Валентность и степень окисления
Валентностью называют число одинарных связей, которые атом образует с другими атомами в молекуле. Под числом химических связей понимают число совместных электронных пар. Общие электронные пары образуются только в случае ковалентной связи, поэтому валентность атомов можно определить только в ковалентных соединениях.
В ионных соединениях нет общих пар электронов, поэтому для этих веществ понятие о валентности нельзя использовать. Для всех соединений, независимо от вида химических связей, применяется более универсальное понятие — степень окисления.
Степень окисления элемента — это условный заряд атома в веществе, исчисленный с предположением, что она состоит из ионов. Степень окисления характеризует число условно принятых условно отданных электронов. Степень окисления может быть положительным (если атом отдал электроны), отрицательным (если атом принял электроны) или равны нулю. Он обозначается арабской цифрой со знаком «плюс» или «минус» над символом элемента. Для определения степени окисления элементов необходимо запомнить определенные правила:
1. При определении степеней окисления выходят из электроотрицательности вещества: сумма степеней окисления всех атомов в соединении равна нулю.
2. Степень окисления атомов в простых веществах равна нулю.
3. Атомам некоторых химических элементов обычно приписывают стали степени окисления. Например, степень окисления фтора в соединениях всегда равна -1; лития, натрия, калия, рубидия и цезия +1; магния, кальция, стронция, бария и цинка +2, алюминия +3.
4. Степень окисления водорода в большинстве соединений +1, и только в соединениях с некоторыми металлами он равен -1 ( ,![]() ).
).
5. Степень окисления кислорода в большинстве соединений -2, и лишь в некоторых соединениях ему приписывают степень окисления -1 ( ,) или +2 ().
6. Атомы многих химических элементов проявляют переменные степени окисления.
7. Степень окисления атома металла в соединениях положительный и численно равна его валентности.
8. Максимальный положительный степень окисления элемента, как правило, равна номеру группы в периодической системе, в которой находится элемент.
9. Минимальная степень окисления для металлов равна нулю. Для неметаллов в большинстве случаев ниже негативное степень окисления равна разнице между номером группы и цифрой восемь.
10. Степень окисления атома образует простой Ион (состоит из одного атома), равна заряду этого иона.
Пользуясь приведенными правилами, определим степени окисления химических элементов в соединении . Это сложное вещество, состоящее из трех химических элементов — водорода Н, серы S и кислорода О. Отметим степени окисления тех элементов, для которых они являются постоянными. В нашем случае это водород Н и кислород О:
Определим неизвестный степень окисления серы. Пусть степень окисления серы в этой соединении равна х:
Составим уравнение, умножив индекс каждого элемента на степень окисления и полученную сумму приравняем к нулю: ; ; .
Следовательно, степень окисления серы равна плюс шесть:
ОПРЕДЕЛЕНИЕ
Способность атома к образованию химических связей называют валентностью . Количественной мерой валентности принято считать число разных атомов в молекуле, с которыми данный элемент образует связи.
Согласно обменному механизму метода валентных связей, валентность химических элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов - это электроны внешнего уровня, для d-элементов - внешнего и предвнешнего уровней.
Значения высшей и низшей валентностей химического элемента можно определить при помощи Периодической таблицы Д.И. Менделеева. Высшая валентность элемента совпадает с номером группы, в которой он расположен, а низшая представляет собой разность между числом 8 и номером группы. Например, бром расположен в VIIA группе, значит его высшая валентность равна VII, а низшая - I.
Спаренные (расположенные по два на атомных орбиталях) электроны при возбуждении могут разъединяться при наличии свободных ячеек того же уровня (разъединение электронов в какой-либо уровень невозможно). Рассмотрим на примере элементов Iи II групп. Например, валентность элементов главной подгруппы I группы равна единице, так ка на внешнем уровне атомы этих элементов имеют один электрон:
3 Li 1s 2 2s 1
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем энергетическом уровне нет неспаренных электронов:
4 Be 1s 2 2 s 2
При возбуждении этих атомов спаренные s-электроны разъединяются в свободные ячейки p-подуровня этого же уровня и валентность становится равной двум (II):

Степень окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
ОПРЕДЕЛЕНИЕ
Число электронов, смещенных от атома данного элемента или к атому данного элемента в соединении называют степенью окисления .
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная - число электронов, которые смещаются к данному атому.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N 2 , H 2 , Cl 2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na +1 I -1 , Mg +2 Cl -1 2 , Al +3 F -1 3 , Zr +4 Br -1 4 .
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Понятие степени окисления для большинства соединений имеет условных характер, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральныхмолекуах равна нулю, а в сложных ионах - заряду этих ионов. В качестве примера рассчитаем степень окисления азота в соединениях состава KNO 2 и HNO 3 . Степень окисления водорода и щелочных металлов в соединениях равна (+), а степень окисления кислорода - (-2). Соответственно степень окисления азота равна:
KNO 2 1+ x + 2 × (-2) = 0, x=+3.
HNO 3 1+x+ x + 3 × (-2) = 0, x=+5.
Примеры решения задач
ПРИМЕР 1
| Задание | Валентность IV характерна для: а)Ca; б) P; в) O; г)Si? |
| Решение | Для того, чтобы дать верный ответ на поставленный вопрос будем рассматривать каждый из предложенных вариантов в отдельности.
а) Кальций - металл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность кальция равна II. Ответ неверный. б) Фосфор - неметалл. Относится к группе химических элементов с переменной валентностью: высшая определяется номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. равна V, а низшая -разностью между числом 8 и номером группы, т.е. равна III. Ответ неверный. в) Кислород — неметалл. Характеризуется единственно возможным значением валентности равным II. Ответ неверный. г) Кремний — неметалл. Характеризуется единственно возможным значением валентности, совпадающим с номером группы в Периодической таблице Д.И. Менделеева, в которой он расположен, т.е. валентность кремния равна IV. Это верный ответ. |
| Ответ | Вариант (г) |
ПРИМЕР 2
| Задание | Какую валентность имеет железо в соединении, которое образуется при его взаимодействии с соляной кислотой: а)I; б) II; в) III; г) VIII? |
| Решение | Запишем уравнение взаимодействия железа с соляной кислотой:
Fe + HCl = FeCl 2 + H 2 . В результате взаимодействия образуется хлорид железа и выделяется водород. Чтобы определить валентность железа по химической формуле, сначала считаем количество атомов хлора: Вычисляем общее число единиц валентности хлора: Определяем число атомов железа: оно равно 1. Тогда валентность железа в его хлориде будет равна: |
| Ответ | Валентность железа в соединении, образовавшемся при его взаимодействии с соляной кислотой равна II. |
Валентностью элемента называется свойство (или способность) его атомов присоединять к себе (или замещать в молекулах сложных веществ) определенное число атомов другого элемента.
В соединениях с ионной связью валентность равна числу электронов, отданных или присоединенных атомом при превращении его в ион.
Валентность в ковалентных соединениях равна числу электронных пар, участвующих в образовании связи. Следовательно, валентность элемента определяется числом электронов, участвующих в образовании химических связей. Часто валентность элементов сравнивают с валентностью водорода, принятой за единицу. Например, в бромоводороде бром одновалентен; в аммиаке азот трехвалентен; в метане углерод четырехвалентен. Нередко валентность элементов определяют и из их кислородных соединений. Например, в диоксиде кремния кремний четырехвалентен, в триоксиде хрома хром шестивалентен, в тетраоксиде рутения рутений восьмивалентен.
Валентность по водороду меняется от 1 до 4 , а по кислороду от 1 до 8 . Между валентностью В, атомным весом А и эквивалентом Э существует зависимость, выражаемая соотношением:
![]()
Валентность некоторых элементов - величина постоянная. Так, например, натрий во всех соединениях одновалентен, цинк - двухвалентен, лантан - трехвалентен и т. д. Для целого ряда элементов валентность изменяется в зависимости от условий протекания процесса. Например, олово может быть двух- и четырехвалентным, медь одно-, двух- и трехвалентной, сера двух-, четырех- и шестивалентной.
Нередко валентность для наглядности обозначают соответствующим числом черточек между символами элементов и пользуются структурными формулами. Число черточек равно числу единиц валентности. Атомы в молекуле связываются между собой так, что на определенное число единиц валентности одного элемента приходится такое же число единиц валентности другого элемента.
Приведем примеры структурных формул;

Эти формулы с точки зрения ковалентной связи можно представить и так:

Валентная черточка, принятая в обыкновенных структурных формулах, соответствует одной электронной паре ковалентной связи. Химическая связь между двумя атомами в молекуле, осуществляемая одной парой электронов, называется одинарной (или простой).
Структурные формулы окиси бария, двуокиси серы и этилена имеют вид:

Здесь связь , и является двойной (бинарной).
В цианистоводородной кислоте имеется одна тройная связь и одна одинарная, а в ацетилене - одна тройная и две одинарные:
Структурную формулу азотной кислоты изображают так:

Вследствие перехода электрона от атома азота к атому кислорода у атома азота появляются четыре неспаренных электрона, способных образовать четыре химических связи.
В молекуле азотной кислоты атомы кислорода, связанные только с азотом, равноценны, поэтому и возможность перехода электронов к каждому из них одинакова. Отсюда более точно строение выражает следующая структурная формула:

Из этой формулы видно, что четвертая связь разделена поровну между атомами кислорода.
Детальное изучение структуры молекулы показывает, что она имеет следующее строение:

Электронное строение аналогично :

В соединениях, содержащих водород и кислород, атомы водорода, способные в реакциях замещаться на металл, как правило, связаны с центральным атомом не непосредственно, а. через кислород. Вокруг центрального атома, обладающего высшей валентностью, пишут столько черточек, каково число, выражающее валентность, после чего через кислород присоединяют атомы водорода, а затем к свободным черточкам, если таковые окажутся, присоединяют атомы кислорода.
Приведем структурные формулы следующих кислот
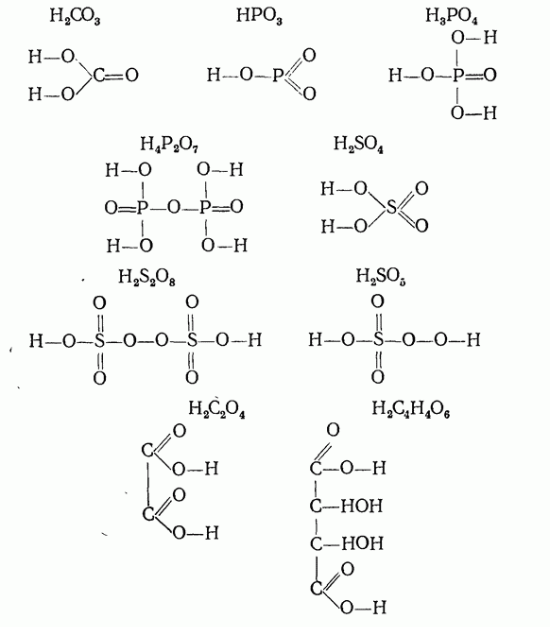
Электронное строение некоторых из этих кислот выразится формулами:

В таких кислотах, как, например, в фосфористой , фосфорноватистой и некоторых других, часть атомов водорода связана непосредственно с центральным атомом:

Эти атомы водорода в химических реакциях не замещаются атомами металлов. Этот пример показывает, какое большое значение имеют структурные формулы.
Приведем примеры структурных формул нормальных и кислых солей:

Структурные формулы двойных солей:

Структурные формулы щелочей и оснований имеют вид:

Структурные формулы основных солей, если они образованы при неполной нейтрализации гидроксидов (с валентностью от 2 и выше), можно составить, исходя из структурных формул исходных веществ

Структурные формулы основных солей:
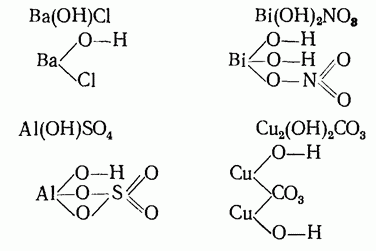
Структурные формулы соединений дают более полное представление о рассматриваемых веществах, чем обычные, так как они показывают не только, из каких атомов состоит та или иная молекула, но и как эти атомы связаны между собой.
Структуру веществ стало возможным изучить на основе теории химического строения веществ А. М. Бутлерова (1861).
Основываясь на этой теории и периодическом законе Д. И. Менделеева, можно сказать, что химические свойства молекул, проявляющиеся при химических реакциях, определяются природой элементарных составных частей (атомов), количеством их и химическим строением, а также свойствами среды (природа растворителя, агрегатное состояние и др.) и внешними условиями.
Разумеется, молекулы разного состава и строения обладают различными химическими свойствами. Например, водород энергично взаимодействует с газообразным кислородом, тбгда как хлороводород окисляется газообразным кислородом лишь при нагревании. Следует учитывать также и то, что на химические свойства молекул оказывает влияние порядок и последовательность соединения атомов между собой. Известны, например, два соединения, молекулы которых имеют химическую формулу , но различную последовательность связей атомов: и .
Первое вещество (этиловый спирт) легко реагирует с натрием
в то время как второе (диметиловый эфир) совсем не взаимодействует с ним. Объясняется это различным влиянием атомов, непосредственно соединенных с водородом: свойства атома водорода в этиловом спирте (в связи О - Н) иные, чем в диметиловом эфире (в связи С - Н).
Примером взаимного влияния несоединенных друг с другом атомов могут служить молекулы фосгена и дихлорметана. В молекуле фосгена под влиянием кислорода (О) атомы хлора замещаются значительно легче, чем в дихлорметане .
Объясняется это также тем, что связи в молекуле фосгена имеют иную прочность и характер, чем в молекуле дихлорметана.
Периодический закон Д. И. Менделеева и теория химического строения А. М. Бутлерова дали возможность систематизировать существующие химические соединения и предвидеть многие свойства молекул, исходя из свойств образующих их атомов.
Способность атома химического элемента присоединять или замещать определенное число атомов другого элемента с образованием химической связи называется валентностью элемента .
Валентность выражается целым положительным числом, лежащим в интервале от I до VIII. Валентности, равно 0 или больше VIII нет. Постоянную валентность проявляют водород (I), кислород (II), щелочные металлы – элементы первой группы главной подгруппы (I), щелочноземельные элементы – элементы второй группы главной подгруппы (II). Атомы других химических элементов проявляют переменную валентность. Так, переходные металлы – элементы всех побочных подгрупп – проявляют от I до III. Например, железо в соединениях может быть двух- или трехвалентным, медь – одно- и двухвалентна. Атому остальных элементов могут проявлять в соединениях валентность, равную номеру группы и промежуточные валентности. Например, высшая валентность серы равна IV, низшая – II, а промежуточные – I, III и IV.
Валентность равна числу химических связей, которыми атом химического элемента связан с атомами других элементов в химическом соединении. Химическая связь обозначается черточкой (–). Формулы, которые показывают порядок соединения атомов в молекуле и валентность каждого элемента называются графическими.
Степень окисления – это условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер. Это означает, что более электроотрицательный атом, смещая к себе полностью одну электронную пару, приобретает заряд 1–. Неполярная ковалентная связь между одинаковыми атомами не дает вклада в степень окисления.
Для вычисления степени окисления элемента в соединении следует исходить из следующих положений:
1) степени окисления элементов в простых веществах принимается равными нулю (Na 0 ; О 2 0);
2) алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, равна нулю, а в сложном ионе эта сумма равна заряду иона;
3) постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов, цинка, кадмия (+2);
4) степень окисления водорода в соединениях +1, кроме гидридов металлов (NaH и т.п.), где степень окисления водорода –1;
5) степень окисления кислорода в соединениях –2, кроме пероксидов (–1) и фторида кислорода OF 2 (+2).
Максимальная положительная степень окисления элемента обычно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь.
Исключение составляют фтор, кислород, железо: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе.
Атомы химических элементов (кроме благородных газов) могут взаимодействовать между собой или с атомами других элементов образуя б.м. сложные частицы – молекулы, молекулярные ионы и свободные радикалы. Химическая связь обусловлена электростатическими силами между атомами, т.е. силами взаимодействия электронов и ядер атомов. В образовании химической связи между атомами главную роль играют валентные электроны , т.е. электроны, расположенные на внешней оболочке.
Конец работы -
Эта тема принадлежит разделу:
ХИМИЯ
кафедра Современное естествознание... В М Васюков О В Савенко А В Иванова...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Часть I. ТЕОРЕТИЧЕСКАЯ ХИМИЯ
Глава 1. Основные понятия и законы химии................................................................................... 3
Глава 2. Строение атома и периодический закон.................
Часть II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Глава 11. Важнейшие классы неорганических соединений...................................................... 55
Глава 12. Элементы I группы (водород, литий, натрий, подгруппа
Часть III. ОРГАНИЧЕСКАЯ ХИМИЯ
Глава 20. Общая характеристика органических соединений..................................................... 124
Глава 21. Алканы............................................
Основные положения атомно-молекулярной теории
1. Все вещества состоят из молекул. Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов. Атом – наименьшая частица
Закон эквивалентов – для молекулярных соединений количество составляющих элементов пропорционально их химическим эквивалентам.
Эквивалент (Э)– частица вещества, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одно
Газовые законы
Изучение свойств газообразных веществ и химических реакций с участием газов сыграло настолько важную роль в становлении атомно-молекулярной теории, что газовые законы заслуживают сп
Закон Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
Р1 / Т1 = Р2 / Т2, или Р/Т = const.
Эти три закона можно объединить в один универсальный газовый зако
Модели строения атома
Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью (А. Беккерель, 1896 г.). Последовавшее за этим
Квантовые числа электронов
Главное квантовое число п определяет общую энергию электрона на данной орбитали (п = 1, 2, 3, ...). Главное квантовое число для атомов изве
Электронные конфигурации атомов
Так как при химических реакциях ядра реагирующих атомов остаются без изменения (за исключением радиоактивных превращений), то химические свойства атомов зависят от строения их эле
Принцип Паули или запрет Паули (1925 г.): в атоме не может быть двух электронов, обладающих одинаковыми свойствами.
Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы один
Ядро атома и радиоактивные превращения
Наряду с химическими реакциями, в которых принимают участие только электроны, существуют различные превращения, в которых изменению подвергаются ядра атомов (ядерные реакции).
Периодический закон
Открытый в 1869 г. Д.И. Менделеевым Периодический закон представляет собой один из фундаментальных законов в современном естествознании. Расположив все элементы в порядке возрастания атомных масс Д
Ковалентная связь – связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам.
Н·+ ·Н® Н: Н или Н – Н
Связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Но в молекуле ацетилена в каждом из атомов углерода содержится еще по два р-электрона, которые не принимают участия в образовании σ-связей. Молекула ацетилена имеет плоский лине
Связью можно назвать ковалентную связь, образованную при перекрывании атомных орбиталей вне линии, соединяющей атомы.
σ-связи являются более прочными, чем π-связи, чем объясняется большая реакционная способность непредельных углеводородов по сравнению с предельными.
Еще один вид г
Ионная связь
Ионная связь – электростатическое притяжение между ионами, образованными путем полного смещения электронной пары к одному из атомов.
Na+
Металлическая связь
Металлы объединяют свойства, имеющие общий характер и отличающиеся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к
Межмолекулярные взаимодействия
Электрически нейтральные атомы и молекулы способны к дополнительному взаимодействию друг с другом.
Водородная связь – связь между положительно з
Единицы измерения температуры Т, давления р и объема V.
При измерении температуры чаще всего используются две шкалы. Абсолютная шкала температур использует в качестве единицы измерения кельвин (К). В абсолютной шкале нулевая точка (0 К) н
Химическая термодинамика
Химическая термодинамика отвечает на вопросы о принципиальной возможности протекания данной химической реакции в определенных условиях и о конечном равновесном состоянии системы
Реакции, в результате которых энтальпия возрастает (ΔН > 0) и система поглощает теплоту извне (Qp < 0) называются эндотермическими.
Так, окисление глюкозы кислородом происходит с выделением большого количества теплоты (Qp = 2800 кДж/моль), т.е. этот процесс – экзотермический. Соответствующее термохимическое у
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
v = ∆С / ∆τ моль/(л·с)
Скорость реакции зависит от природы реагирующих веществ и от условий, в которых реакция протекает. Важнейшими из них являются
Обратимые и необратимые реакции. Состояние химического равновесия
Химическая реакция не всегда «доходит до конца», т.е. исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов
Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия.
Так для обратимой химической реакции: aА + bВ
Идеальные и реальные растворы. Растворение как физико-химический процесс
Известны две основные теории растворов: физическая и химическая.
Физическая теория растворов предложена Вант-Гоффом и Аррениусом. Согласно этой теории, растворител
Зависимость растворимости различных веществ от природы растворителя, температуры и давления
Растворимость веществ в различных растворителях, например в воде, колеблется в широких пределах. Если в 100 г воды при комнатной температуре растворяется более 10 г веще
Законы разбавленных растворов
При растворении в растворителе нелетучего вещества давление пара растворителя над раствором уменьшается, что вызывает повышение температуры кипения раствора и понижение температуры
Способы выражения концентрации (состава) растворов
Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», т.е. содержание растворенного вещества в единице массы или объема. 1.
1.
Электролиты и электролитическая диссоциация
Растворы, проводящие электрический ток, называются растворами электролитов.Существуют две основные причины прохождения электрического тока через проводники: либо за счет перен
Оптические и молекулярно-кинетические свойства дисперсных систем
Оптическое свойство коллоидных систем – опалесценция, т.е. рассеивание света малыми частицами, приводящее, в частности, к возникновению эффекта Фарадея-Тиндал
Поверхностные и адсорбционные явления
Различия состава и строения соприкасающихся фаз, а также характера молекулярных взаимодействий в их объеме обуславливают возникновение своеобразного молекулярного силового поля на поверхности разде
Коллоидные (коллоидно-дисперсные) системы
Коллоидные системы (золи) – это гетерогенные системы, состоящие из частиц размером порядка 10–7–10–9 м. По размеру частиц коллоидные системы занимают п
Окислительно-восстановительные реакции –реакции, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ.
Степень окисления – условный заряд атома в молекуле, вычисленный из предположения, что молекула состоит из ионов и в целом электронейтральна.
Вещество, в состав
Электрохимическую реакцию окисления-восстановления можно провести так, что электроны будут переходить от восстановителя к окислителю в виде электрического тока, т.е. будет происходить превращение х
Коррозия металлов
Коррозия – разрушение металлов в результате химического или электрохимического воздействия окружающей среды. Коррозия – самопроизвольный процесс, протекающий с уменьшением с
Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через раствор или расплав электроли
Электролиз расплавов электролитов
Схема записи электролиза расплава электролита:
KtAn ↔ Ktn+ + Anm–
Катод– | Ktn+
Электролиз водных растворов электролитов
Электролиз растворов отличается от электролиза расплавов электролитов наличием молекул воды, которые также могут участвовать в окислительно-восстановительных реакциях электролиза. Вследствие своей
Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
Анодный процесс:
1. На нерастворимых анодах при конкуренции аниона бескислородных кислот (Cl–, Br–, I–, S2–
Качественный анализ
Задача качественного анализа –определение химического состава исследуемого соединения.
Качественный анализ проводят химическими, физическими и физико-химическим
Количественный анализ
Задача количественного анализа– определение количественного содержания химических элементов (или их групп) в соединениях.
Методы количественного ана
Кислоты
Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода Н+(по теории электролитич
Водород
Водород – первый элемент и один из двух представителей I периода Периодической системы. Атом водорода состоит из двух частиц – протона и электрона, между которыми существуют лишь силы притяжения. В
Бериллий
Во всех устойчивых соединениях степень окисления бериллия +2.
Содержание бериллия в земной коре невелико. Важнейшие минералы: берилл Be3Al2(SiO
Алюминий
Алюминий – типичный амфотерный элемент, для него наиболее типична степень окисления +3. В отличие от бора для него характерны не только анионные, но и катионные комплексы.
Лантаноиды
В семейство лантаноидов входят церий Се 4f25s25p65d06s2, празеодим Pr 4f3, неодим Nd 4f4, прометий
Актиноиды
В семейство актиноидов входят торий Th 5f06s26p66d27s2, протактиний Pr 5f2 6d17s2
Углерод
В большинстве неорганических соединений углерод проявляет степени окисления –4, +4, +2.
В природе содержание углерода составляет 0,15% (мол. доли) и находится в основном в
Кремний
Кремний в соединениях имеет степени окисления +4 и –4. Для него наиболее характерны связи Si–F и Si–О.
По распространенности на Земле 20% (мол. долей) кремний уступает то
Кислород
Подобно фтору, кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Степень окисления кислорода в подавляющем большинстве соединений равна –2. Кром
Формулы органических соединений
Молекулярная формула отражает качественный и количественный элементный состав вещества. В молекулярной формуле сначала пишут атомы углерода, затем - атомы водорода, затем -
Номенклатура органических соединений
В настоящее время признана систематическая номенклатура ИЮПАК (IUРАС – Международный союз теоретической и прикладной химии). Среди вариантов
Изомерия органических соединений
Изомерия – существование разных веществ с одинаковой молекулярной формулой. Данное явление обусловлено тем, что одни и те же атомы могут по-разному соединят
И реакционная способность органических соединений
Химические свойства атомов, входящих в молекулы, меняются в зависимости от того, с какими другими атомами они связаны. Наиболее сильно влияют друг на друга непосредственно связанные атомы, однако
Общая характеристика органических реакций
В основу классификации органических реакций могут быть положены различные принципы.
I. Классификация химических реакций по результату химического превращения:
1.
Промышленное производство органических соединений
Возрастающая роль органических соединений в современном мире вызывает потребность в создании промышленного производства, способного производить их в достаточном количестве. Для такого производства
Номенклатура и изомерия
Алканы являются насыщенными, или предельными, углеводородами, поскольку все свободные валентности атомов углерода заняты (полностью «насыщены») атомами водорода. Простейшим пр
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов (C1 – С4) – газы. Нормальные алканы от пентана до гептадекана (C5 – С17) – жидкости
Способы получения
Основные природные источники алканов – нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метан
Химические свойства
В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными ще
Номенклатура и изомерия
Циклоалканы – это предельные циклические углеводороды. Простейшие представители этого ряда:
Обща
Химические свойства
Похимическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. сходны в этом отношении с алкенами. Циклопентан и
Номенклатура и изомерия
Алкенами называют непредельные углеводороды, молекулы которых содержат одну двойную связь. Первый представитель этого класса – этилен СН2=СН2,
Получение
В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
1. Основным промышленным исто
Химические свойства
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность π-связи достаточно подвижна и легко вступает в реакции с электрофильными
Применение
Низшие алкены – важные исходные вещества для промышленного органического синтеза. Из этилена получают этиловый спирт, полиэтилен, полистирол. Пропен используют для синтеза полипропилена, фенола,
Номенклатура и изомерия
Алкадиены – непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2.
Если двойные связи разделены в углеродной цеп
Получение
Основной промышленный способ получения диенов – дегидрирование алканов. Бутадиен-1,3 (дивинил) получают из бутана:
Химические свойства
Для алкадиенов характерны обычные реакции электрофилъного присоединения АЕ, свойственные алкенам. Особенность сопряженных диенов состоит в том, что две двойные связи в их
Номенклатура и изомерия
Алкинами называют непредельные углеводороды, молекулы которых содержат одну тройную связь. Общая формула гомологического ряда алкинов СnН2
Физические свойства
Физические свойства алкинов похожи на свойства алканов и алкенов. При обычных условиях (С2 – С4) – газы, (C5 – C16) – жидкости, начиная с С17
Получение
1. Общий способ получения алкинов – отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под
Химические свойства
Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE
Применение
На основе ацетилена развились многие отрасли промышленности органического синтеза. Выше уже отмечена возможность получения уксусного альдегида из ацетилена и различных кетонов из гомологов ацетиле
Номенклатура и изомерия
Ароматическими углеводородами (аренами) называют вещества, в молекулах которых содержится одно или несколько бензольных колец – циклических групп атомов углерода с ос
Физические свойства
Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и в ней не растворимы. Хорошо растворяются в органических растворителях и сами являются хор
Способы получения
1. Получение из алифатических углеводородов. Для получения бензола и его гомологов в промышленности используют ароматизацию предельных углеводородов, входящих в состав нефти. При про
Химические свойства
Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение π-
Правила ориентации (замещения) в бензольном кольце
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах
Применение
Ароматические углеводороды – важнейшее сырье для синтеза ценных веществ. Из бензола получают фенол, анилин, стирол, из которых, в свою очередь, получают фенолформальдегидные смолы, красители, полис
Номенклатура и изомерия
Общая формула гомологического ряда предельных одноатомных спиртов – CnH2n+1OH. В зависимости от того, при каком углеродном атоме находится гидроксильная гру
Получение
1. Общий способ получения спиртов, имеющий промышленное значение, – гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором (H3PO
Химические свойства
Химические свойства спиртов определяются присутствием в их молекулах группы -ОН.
Связи С–О и О–Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участие
Реакции с разрывом связи О–Н.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами:
Реакции с разрывом связи С–О.
1) Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов:
Применение
Спирты главным образом используют в промышленности органического синтеза.
Метиловый спиртСН3ОН – ядовитая жидкость температурой кипения 65°С, легко смешивается
Химические свойства
Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В реакциях могут участвовать одна или две гидроксильные группы. Взаимное влияние гидроксильных групп проявляется в
Применение
Этиленгликоль применяют для синтеза полимерных материалов и в качестве антифриза. В больших количествах его используют также для получения диоксана, важного (хотя и токсичного) лабораторно
Физические свойства
Фенолы в большинстве своем – кристаллические вещества (мета-крезол – жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в холодной воде,
Способы получения
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
Химические свойства
В фенолах p-орбиталь атома кислорода образует с ароматическим кольцом единую π-систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кол
Номенклатура и изомерия
Органические соединения, в молекуле которых имеется карбонильная группа, называют карбонильным
Получение
1. Гидратация алкинов. Из ацетилена получают альдегид, из его гомологов – кетоны:
Из-за
Химические свойства
Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью.
Альдегиды и кетоны – химически активные соединения
Применение
Формальдегид – газ с резким раздражающим запахом. 40% водный раствор формальдегида называется формалином. Формальдегид получают в промышленности в крупных масштабах окислением метана или метанола
Номенклатура и изомерия
Карбоновыми кислотами называют соединения, содержащиекарбоксильную группу
Физические свойства
Насыщенные алифатические монокарбоновые кислоты образуют гомологический ряд, который характеризуется общей формулой CnH2n+1COOH. Низшие члены этого ряда при обычны
Получение
1. Окисление первичных спиртов – общий способ получения карбоновых кислот. В качестве окислителей применяют КМnО4 и К2Сr2O7.
Химические свойства
Карбоновые кислоты – более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы –СО. В водном растворе карбоновые ки
Применение
Насыщенные кислоты. Муравьиная кислота НСООН. Название связано с тем, что кислота содержится в выделениях муравьев. Широко применяется в фармацевтической и пищевой промышле
Номенклатура и изомерия
Среди функциональных производных карбоновых кислот особое место занимают сложные эфиры – соединения, представляющие карбоновые кислоты, у которых атом водорода в карбоксильной группе заменен
Физические свойства
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, малорастворимые или практически нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, наприме
Химические свойства
1. Реакция гидролиза или омыления.
Реакция этерификации является обратимой, поэтому в присутствии кислот будет протекать обратная реакция, называемая гидролизом, в результат
Жиры и масла
Среди сложных эфиров особое место занимают природные эфиры – жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами с неразветвленной углеродно
Номенклатура и изомерия
Простейший моносахарид – глицериновый альдегид, С3Н6О3:
Осталь
Физические и химические свойства глюкозы
Глюкоза С6Н12О6 представляет собой белые кристаллы, сладкие на вкус, хорошо растворимые в воде. В линейной форме молекулы глюкозы содержат одну аль
Дисахариды
Важнейшие дисахариды – сахароза, мальтоза и лактоза. Все они являются изомерами и имеют формулу С12Н22О11, однако их строение различно.
Молек
Полисахариды
Молекулы полисахаридов можно рассматривать как продукт поликонденсации моносахаридов. Общая формула полисахаридов (С6Н10О5)n. Мы рассмотрим важнейшие пр
Номенклатура и изомерия
Общая формула предельных алифатических аминов CnH2n+3N.
Названия аминов обычно производят, перечисляя углеводородные радикалы (в алфавитном порядке) и доба
Физические свойства
Метиламин, диметиламин и триметиламин – газы, средние члены алифатического ряда – жидкости, высшие – твердые вещества. Между молекулами аминов в жидкой фазе образуются слабые водородные связи, поэ
Получение
1. Основной способ получения аминов – алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком:
Химические свойства
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак. Водные растворы аминов име
Ароматические амины
Анилин (фениламин) C6H5NH2 – родоначальник класса ароматических аминов, в которых аминогруппа непосредственно связана с бензольным кольцом. Эта св
Физические свойства
Анилин – бесцветная маслянистая жидкость, немного тяжелее воды, мало растворима в воде, растворима в этиловом спирте и в бензоле.
Основной способ получения анилина – восстановление нитроб
Химические свойства
1. Анилин – гораздо более слабое основание, чем алифатические амины (Кb = 5,2-10-10). Это объясняется тем, что электронная пара атома азота, которая обусловливает осн
Номенклатура и изомерия
Аминокислоты – это органические бифункциональные соединения, в состав которых входят карбоксильная группа –СООН и аминогруппа –NH2. В зависимости от взаимного расположения обеих функци
Химические свойства
Аминокислоты – это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную гру
Пептиды
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продук
Химические свойства
1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называется денатурацией. Она происходит при нагревании, изменении кислотности с
Биологическое значение белков
Биологическое значение белков чрезвычайно велико.
1.Абсолютно все химические реакции в организме протекают в присутствии катализаторов – ферментов. Даже такая простая реакци
Шестичленные гетероциклы
Пиридин C5H5N – простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН за
Пятичленные гетероциклы
Пиррол C4H4NH – пятичленный гетероцикл с одним атомом азота.
Строение нуклеиновых кислот
Нуклеиновые кислоты – это природные высокомолекулярные соединения (полинуклеотиды), которые играют огромную роль в хранении и передаче наследственной информации в живых организмах. Молекуля
Биологическая роль нуклеиновых кислот
ДНК – главная молекула в живом организме. Она хранит генетическую информацию, которую передает от одного поколения к другому. В молекулах ДНК в закодированном виде записан состав всех белков орган
Цитозин гуанин
Таким образом, информация, содержащаяся в ДНК, как бы перепечатывается в мРНК, а последняя доставляет ее в рибосомы.
2. Транспортная РНК (тРНК) переносит аминокислоты к рибосомам,
Общая характеристика полимеров
Довольно часто общую формулу полимеров можно записать в виде (-Х-)n, где фрагмент -Х- называется элементарное звено, а число n – степень полимериза
Пластмассы
Пластмассами называют материалы на основе полимеров, способные изменять свою форму при нагревании и сохранять новую форму после охлаждения. Благодаря этому свойству пластмассы легко поддаются меха
Волокна
Одна из важных областей применения полимеров – изготовление волокон и тканей.
Рассмотрим два ва
Каучуки
Каучуки – продукты полимеризации диенов и их производных.
Натуральный каучук получают из латекса – сока некоторых тропических растений. Его строение можно установит


