СТРОЕНИЕ ВЕЩЕСТВА
Все вещества состоят из отдельных мельчайших частиц: молекул и атомов.
Основоположником идеи дискретного строения вещества (т.е. состоящего из отдельных частиц) считается древнегреческий философ Демокрит, живший около 470 года до новой эры. Демокрит считал, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазу, неделимых частиц. "Они бесконечно разнообразны, имеют впадины и выпуклости, которыми сцепляются, образуя все материальные тела, а в природе существуют только атомы и пустота.
Догадка Демокрита была надолго забыта. Однако, его взгляды на строение вещества дошли до нас благодаря римскому поэту Лукрецию Кару: "... все вещи, как мы замечаем, становятся меньше, И как бы тают они в течение долгого века..."
Атомы.
Атомы очень малы. Их невозможно разглядеть не только простым глазом, но и с помощью даже самого мощного оптического микроскопа.
Глаз человека не способен разглядеть атомы и промежутки между ними, поэтому любое вещество кажется нам сплошным.
В 1951 году Эрвин Мюллер изобрёл ионный микроскоп, позволивший в деталях разглядеть атомную структуру металла.
Атомы различных химических элементов отличаются друг от друга. Различия атомов элементов можно определить по периодической таблице Менделеева.
Молекулы.
Молекула - это мельчайшая частица вещества, обладающая свойствами этого вещества. Так, молекула сахара - сладкая, а соли - соленая.
Молекулы состоят из атомов.
Размеры молекул ничтожно малы.
Как увидеть молекулу? - с помощью электронного микроскопа.


Как добыть молекулу из вещества? - механическим дроблением вещества. Каждому веществу соответствует определеенный вид молекул. У разных веществ молекулы могут состоять из одного атома (инертные газы) или из нескольких одинаковых или различных атомов, или даже из сотен тысяч атомов (полимеры). Молекулы различных веществ могут иметь форму треугольника, пирамиды и других геометрических фигур, а также быть линейными.

Молекулы одного и того же вещества во всех агрегатных состояниях одинаковы.

Между молекулами в веществе существуют промежутки. Доказательствами существования промежутков служат изменение объема вещества, т.е. расширение и сжатие вещества при изменении температуры
Домашняя работа.
Задание. Ответить на вопросы:
№ 1.
1. Из чего состоят вещества?
2. Какие опыты подтверждают, что ве¬щества состоят из мельчайших частиц?
3. Как меняется объём тела при изменении расстояния между частицами?
4. Какой опыт пока¬зывает, что частицы вещества очень малы?
5. Что такое молекула?
6. Что вы знаете о размерах молекул?
7. Из каких частиц состоит молекула воды?
8. Как изображается схемати¬чески молекула воды?
№ 2.
1. Одинаков ли состав молекул воды в горячем чае и в охлаждённом напитке «Кола»?
2. Почему изнашиваются подмётки у ботинок и стираются до дыр локти пиджаков?
3. Как объяснить высыхание лака на ногтях?
4. Вы проходите мимо пекарни. Из нее доносится аппетитный запах свежего хлеба…. Как это могло произойти?
Опыт Роберта Рэлея.
Размеры молекул были определены во многих опытах. Один из них провел английский ученый Роберт Рэлей.
В чистый широкий сосуд налили воду и на ее поверхность поместили каплю оливкового масла. Капля растеклась по поверхности воды и образовала круглую пленку. Постепенно площадь пленки увеличивалась, но затем растекание прекратилось и площадь перестала изменяться. Релей предположил, что молекулы расположились в один ряд, т.е. толщина пленки стала равна как раз размеру одной молекулы, и решил определить ее толщину. При этом, конечно, нужно учесть, что объем пленки равен объему капли.
По тем данным, которые были получены в опыте Рэлея, рассчитаем толщину пленки и узнаем, чему равен линейный размер молекулы масла. Капля имела объем 0,0009 см3, а площадь пленки, образовавшейся из капли, была равна 5500 см2. Отсюда толщина пленки:

Экспериментальное задание:
Проделать в домашних условиях опыт по определению размеров молекул масла.
Для опыта удобно воспользоваться чистым машинным маслом. Сначала определите объем одной капли масла. Придумайте сами, как это сделать при помощи пипетки и мензурки (можно воспользоваться мензуркой, которой отмеривают лекарства).
Налейте в тарелку воды и на ее поверхность поместите каплю масла. Когда капля растечется, измерьте диаметр пленки линейкой, положив ее на края тарелки. Если поверхность пленки не будет иметь форму круга, то или подождите, когда она примет такую форму, или сделайте несколько измерений и определите ее средний диаметр. Затем вычислите площадь пленки и ее толщину.
Какое число вы получили? Во сколько раз оно отличается от действительных размеров молекулы масла?

Если все тела состоят из частиц, почему же твердые тела и жидкости не распадаются на отдельные молекулы? Почему карандаш трудно разломать пополам? Почему два куска пластилина легко склеить друг с другом, а два кусочка мела склеить невозможно? Между молекулами существует взаимодействие (притяжение и отталкивание)

Когда мы разрываем нить, ломаем палку или отрываем кусочек бумаги, то преодолеваем силы притяжения между молекулами. Заметить притяжение между двумя молекулами совершенно невозможно. Когда же притягиваются многие миллионы таких частиц, взаимное притяжение становится значительным. Поэтому трудно разорвать руками веревку или стальную проволоку. Притяжение между молекулами в разных веществах неодинаково. Этим объясняется различная прочность тел. Например, стальная проволока прочнее медной. Это значит, что частицы стали притягиваются сильнее друг к другу, чем частицы меди.




Опыт со свинцовыми цилиндрами. Притяжение между молекулами становится заметным только тогда, когда они находятся очень близко друг к другу. На расстоянии, превышающем размеры самих молекул, притяжение ослабевает. Две капли воды сливаются в одну, если они соприкасаются. Два свинцовых цилиндра сцепляются вместе, если их вплотную прижать друг к другу ровными, только что срезанными поверхностями. При этом сцепление может быть настолько прочным, что цилиндры не удается оторвать друг от друга даже при большой нагрузке.

Осколки стекла нельзя срастить, даже плотно прижимая их. Из-за неровностей не удается их сблизить на то расстояние, на котором частицы могут притянуться друг к другу. Но если размягчить стекло путем нагрева, то различные части можно сблизить и стекло в этом случае спаивается. Это значит, что частицы стекла оказались на таком расстоянии, когда действует притяжение между ними. Соединение кусков металла при сварке или пайке, а также склеивание основано на притяжении молекул друг к другу.


Если жидкость смачивает твердое тело, то это значит, что жидкости притягиваются друг к другу слабее, чем к молекул Когда наблюдается несмачиваемость, то это означает молекулы жидкости притягиваются сильнее друг к другу, чел лам твердого тела. Явление смачивания и несмачивания


Вода смачивает не только стекло, но и кожу, дерево и другие вещества. Во многих случаях вода может и не смачивать тела, если опустить в воду кусочек воска или парафина, а затем он окажется сухим. Всем хорошо известно, что вода не с: жирные поверхности тел. В быту мы часто сталкиваемся с явлениями смачивания и несмачивания. Так, например, благодаря явлению смачивания мы можем писать, вытирать мокрые предметы и т. д



Основные положения МКТ 1. Все т ела с остоят и з ч астиц, м ежду которыми е сть п ромежутки (д елимость в ещества). 2. Ч астицы д вигаются б еспорядочно и хаотично (непрерывно), (диффузия). 3. Ч астицы в заимодействуют д руг с другом (п ритягиваются и ли отталкиваются), (растяжение и с жатие п ружины).
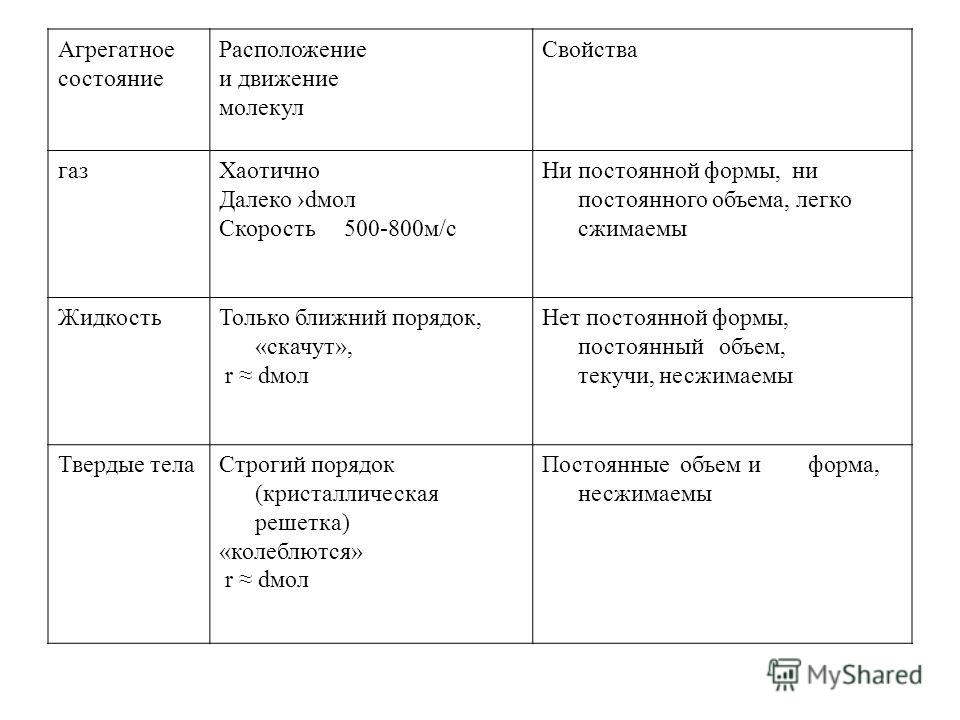
Агрегатное состояние Расположение и движение молекул Свойства газХаотично Далеко dмол Скорость м/с Ни постоянной формы, ни постоянного объема, легко сжимаемы ЖидкостьТолько ближний порядок, «скачут», r dмол Нет постоянной формы, постоянный объем, текучи, несжимаемы Твердые телаСтрогий порядок (кристаллическая решетка) «колеблются» r dмол Постоянные объем и форма, несжимаемы

Домашнее задание 1. § Выучить основные положения МКТ. 3. Упр. 2.

Тема: Основы молекулярно-кинетической теории
Урок: Основные положения МКТ. Строение вещества. Молекула
Для начала давайте вспомним все предыдущие разделы физики, которые мы изучали, и поймём, что всё это время мы рассматривали процессы, происходящие с макроскопическими телами (или объектами макромира). Теперь же мы будем изучать их строение и процессы, протекающие внутри них.
Определение. Макроскопическое тело - тело, состоящее из большого числа частиц. Например: машина, человек, планета, бильярдный шар…
Микроскопическое тело - тело, состоящее из одной или нескольких частиц. Например: атом, молекула, электрон… (рис. 1)

Рис. 1. Примеры микро- и макрообъектов соответственно
Определив таким образом предмет изучения курса МКТ, следует теперь поговорить об основных целях, которые ставит перед собой курс МКТ, а именно:
- Изучение процессов, происходящих внутри макроскопического тела (движение и взаимодействие частиц)
- Свойства тел (плотность, масса, давление (для газов)…)
- Изучение тепловых явлений (нагревание-охлаждение, изменения агрегатных состояний тела)
Изучение этих вопросов, которое будет проходить на протяжении всей темы, начнётся сейчас с того, что мы сформулируем так называемые основные положения МКТ, то есть некоторые утверждения, истинность которых уже давно не подвергается сомнениям, и, отталкиваясь от которых, будет строиться весь дальнейший курс.
Разберём их по очереди:
Все вещества состоят из большого количества частиц - молекул и атомов.
Определение. Атом - мельчайшая частица химического элемента. Размеры атомов (их диаметр) имеет порядок см. Стоит отметить, что различных типов атомов, в отличие от молекул, относительно немного. Все их разновидности, которые на сегодняшний день известны человеку, собраны в так называемой таблице Менделеева (см. рис. 2)

Рис. 2. Периодическая таблица химических элементов (по сути разновидностей атомов) Д. И. Менделеева
Молекула - структурная единица вещества, состоящая из атомов. В отличие от атомов, они больше и тяжелее последних, а главное, они обладают огромным разнообразием.
Вещество, молекулы которого состоят из одного атома, называются атомарными , из большего количества - молекулярными . Например: кислород, вода, поваренная соль () - молекулярные; гелий серебро (He, Ag) - атомарные.
Причём следует понимать, что свойства макроскопических тел будут зависеть не только от количественной характеристики их микроскопического состава, но и от качественной.
 |
Если в строении атомов вещество имеет какую-то определённую геометрию (кристаллическую решётку ), или же, наоборот, не имеет, то этим телам будут присущи различные свойства. Например, аморфные тела не имеют строгой температуры плавления. Самый известный пример - это аморфный графит и кристаллический алмаз. Оба вещества состоят из атомов углерода.


Рис. 3. Графит и алмаз соответственно
Таким образом «из скольких, в каком взаимном расположении и каких атомов и молекул состоит вещество?» - первый вопрос, ответ на который приблизит нас к пониманию свойств тел.
Все упомянутые выше частицы находятся в непрерывном тепловом хаотическом движении.
Так же, как и в рассматриваемых выше примерах, важно понимание не только количественных аспектов этого движения, но и качественных для различных веществ.
Молекулы и атомы твёрдых тел совершают лишь небольшие колебания относительно своего постоянного положения; жидких - также совершают колебания, но из-за больших размеров межмолекулярного пространства иногда меняются местами друг с другом; частички газа, в свою очередь, практически не сталкиваясь, свободно перемещаются в пространстве.
Частицы взаимодействуют друг с другом.
Взаимодействие это носит электромагнитный характер (взаимодействия ядер и электронов атома) и действует в обе стороны (как притягивание, так и отталкивание).

Здесь: d - расстояние между частицами; a - размеры частиц (диаметр).
Впервые понятие «атом» было введено древнегреческим философом и естествоведом Демокритом (рис. 4). В более поздний период активно задался вопросом о структуре микромира русский учёный Ломоносов (рис. 5).

Рис. 4. Демокрит

Рис. 5. Ломоносов
На следующем занятии мы введём методы качественного обоснования основным положениям МКТ.
Список литературы
- Мякишев Г.Я., Синяков А.З. Молекулярная физика. Термодинамика. - М.: Дрофа, 2010.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. - М.: Илекса, 2005.
- Касьянов В.А. Физика 10 класс. - М.: Дрофа, 2010.
- Elementy.ru ().
- Samlib.ru ().
- Youtube ().
Домашнее задание
- *Благодаря какой силе возможно сделать эксперимент по измерению размеров молекулы масла, показанный в видеоуроке?
- Почему молекулярно-кинетическая теория не рассматривает органические соединения?
- Почему даже очень маленькая песчинка песка является объектом макромира?
- Силы преимущественно какой природы действуют на частицы со стороны других частиц?
- Как определить, является ли некая химическая структура химическим элементом?
Атомно-молекулярное учение – совокупность положений, аксиом и законов, которые описывают все вещества как набор молекул, состоящих из атомов.
Древнегреческие философы задолго до начала нашей эры в своих трудах уже выдвигали теорию существования атомов. Отвергая существование богов и потусторонних сил, они пытались объяснить все непонятные и загадочные явления природы естественными причинами – соединением и разъединением, взаимодействием и смешиванием невидимых человеческому глазу частичек – атомов. Но служители церкви на протяжении многих веков преследовали приверженцев и последователей учения об атомах, подвергали их гонениям. Но из-за отсутствия необходимых технических приспособлений философы древности не могли скрупулезно изучить природные явления, и под понятием «атом» у них скрывалось современное понятие «молекула».
Лишь в середине ХVIII века великий русский учёный М.В. Ломоносов обосновал атомно-молекулярные представления в химии. Основные положения его учения изложены в работе «Элементы математической химии» (1741 г.) и ряде других. Ломоносов назвал теорию корпускулярно-кинетической теорией.
М.В. Ломоносов четко разграничивал две ступени в строении вещества: элементы (в современном понимании – атомы) и корпускулы (молекулы). В основе его корпускулярно-кинетической теории (современного атомно-молекулярного учения) лежит принцип прерывности строения (дискретности) вещества: любое вещество состоит из отдельных частиц.
 В 1745 году М.В. Ломоносов писал:
«Элемент есть часть тела, не состоящая из каких-либо меньших и отличных между собою тел… Корпускулы есть собрание элементов в одну небольшую массу. Они однородны, если состоят из одинакового числа одних и тех же элементов, соединённых одинаковым образом. Корпускулы разнородны, когда элементы их различны и соединены различным образом или в различном числе; от этого зависит бесконечное разнообразие тел.
В 1745 году М.В. Ломоносов писал:
«Элемент есть часть тела, не состоящая из каких-либо меньших и отличных между собою тел… Корпускулы есть собрание элементов в одну небольшую массу. Они однородны, если состоят из одинакового числа одних и тех же элементов, соединённых одинаковым образом. Корпускулы разнородны, когда элементы их различны и соединены различным образом или в различном числе; от этого зависит бесконечное разнообразие тел.
Молекула является наименьшей частицей вещества, обладающей всеми его химическими свойствами. Вещества, имеющие молекулярную структуру, состоят из молекул (большинство неметаллов, органические вещества). Значительная часть неорганических веществ состоит из атомов (атомная решётка кристалла) или ионов (ионная структура). К таким веществам относятся оксиды, сульфиды, различные соли, алмаз, металлы, графит и др. Носителем химических свойств в этих веществах является комбинация элементарных частиц (ионы или атомы), то есть кристалл представляет собой гигантскую молекулу.
Молекулы состоят из атомов. Атом – мельчайшая, далее химически неделимая составная часть молекулы.
Получается, молекулярная теория объясняет физические явления, которые происходят с веществами. Учение об атомах приходит на помощь молекулярной теории при объяснении химических явлений. Обе эти теории – молекулярная и атомная – объединяются в атомно-молекулярное учение. Сущность этого учения можно сформулировать в виде нескольких законов и положений:
- вещества состоят из атомов;
- при взаимодействии атомов образуются простые и сложные молекулы;
- при физических явлениях молекулы сохраняются, их состав не изменяется; при химических – разрушаются, их состав изменяется;
- молекулы веществ состоят из атомов; при химических реакциях атомы в отличие от молекул сохраняются;
- атомы одного элемента сходны друг с другом, но отличаются от атомов любого другого элемента;
- химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества.
Благодаря своей атомно-молекулярной теории М.В. Ломоносов по праву считается родоначальником научной химии.
www.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.


