Elektr bu element bilan aloqasi bo'lgan bir kimyoviy rishtalari hosil bo'lgan boshqa elementlar atomlarning uning atomi uchun elektronlar jalb etish kimyoviy elementning mol-mulkini deyiladi.
Turli xil elementlarning atomlari o'rtasida kimyoviy aloqasi turli xil elektron bulut yanada elektron tog 'jinsiga siljiydi, shuning uchun ulanish keng tarqalib, ionning katta farqiga aylanadi.
kimyoviy formulalar yozish paytida elektr hisobga olinadi: eng elektronegatif element ramzi ikkilik aloqasi qayd etiladi.
yo'nalishda elektr ortadi har bir davr elementlarini chapga va yuqoridan bir xil PS guruh elementlari uchun pastgacha yo'nalishda kamayadi.
Valentlik Element atomlarining bir qator atomlariga ulangan xususiyat deb ataladi.
Stoichiometrik, elektron valentlik va muvofiqlashtirish raqami mavjud. Biz faqat stoichiometrik valentligini ko'rib chiqamiz.
Stoichiometrik Valend boshqa elementning atomini ushbu elementning atomini biriktirishini ko'rsatadi. Vodorodning qabul qilingan valenti uchun qabul qilingan valentning birligi uchun Vodorod har doim yunonadi. Masalan, HCL, H 2 O, NH 3 aralashmasi (Ammiak-ning eng to'g'ri yozuvi), CH 4 Xlor, yunon, kislorodli va uglerodli tetravalenten.
kislorod, stoikiometrik valent deyarli barcha elementlar kislorod bilan birikmalar hosil yildan 2. odatda teng bo'lib, u yana bir elementning Valence aniqlash uchun mos yozuvlar sifatida foydalanish uchun qulay. Misol uchun, birikmalar Na 2 O, Coo, Fe 2 O 3, SO 3 natriy valentli, kobalt bivalent yilda, temir uchta qimmatbaho, oltingugurt qimmatbaho hisoblanadi.
Oksidiy va reaktsion reaktsiyalarda, biz uchun elektr tarmog'ining oksidlanishini aniqlash juda muhim bo'ladi.
Oksidlanish darajasi Moddaning elementi uning stoichiometrik valenti deb ataladi, ular ortiqcha belgi yoki minus bilan olingan.
Kimyoviy elementlar elementlarga bo'linadi doimiy valentsiya Valend o'zgaruvchisi elementlari.
1.3.3. Molekulyar va elastik bo'lmagan moddalar. Kristall panjaraning turi. Moddalarning xususiyatlari va tuzilishidan bog'liqlik.
Murakkabning qaysi holatiga qarab, ular molekulyar va exulyarlarga bo'lingan. Ichida molekulyar moddalar Eng kichik tarkibiy zarralar molekulalardir. Ushbu moddalar molekulyar kristalli panjaraga ega. Ko'chma bo'lmagan moddalarda atomlarda yoki ionlarda eng kichik tarkibiy zarralardir. Kristalli panjara atom, ion yoki metalldir.
Kristalli panjaraning turi asosan moddalarning xususiyatlarini aniqlaydi. Masalan, ega bo'lgan metallar kristall panjaraning metall turiboshqa barcha elementlardan farq qiladi yuqori plastik, elektr va issiqlik o'tkazuvchanligi. Ushbu xususiyatlar, shuningdek, boshqa ko'plab odamlar - metall porlash va boshqalar. Metall atomlari o'rtasidagi maxsus aloqa turi tufayli - metall ulanish. Ta'kidlash joizki, metallarga xos bo'lgan xususiyatlar faqat kondensatsiyalangan holatda namoyon bo'ladi. Masalan, gazsimon holatda kumush metallarning fizik xususiyatlariga ega emas.
Metallda maxsus aloqa turi metalldir - bu erning butun tamoyillari uchun umumiydir. Metall tarkibiy qismning eng oddiy modeli, metallarning kristalli panjarasi bepul elektronlar bilan o'ralgan musofir ionlardan iborat deb taxmin qilinadi, elektronlarning harakati, gazmol molekulalari kabi tartibsiz bo'lib qoladi. Biroq, bunday model, metallarning ko'plab xususiyatlarini sifatli izohlaydi, miqdoriy tekshiruv etarli emas. Metall ahvol nazariyasini yaratish Yaratilishga olib keldi metallning zona nazariyasibu kvant mexanikasi chiqishlariga asoslanadi.
Kristalli panjara tugunlarida kationlar va metall atomlar mavjud va elektronlar billur panjara bo'ylab erkin ko'chiriladi.
Metallarning xarakterli mexanik mulki hisoblanadi plastikularning kristallarining ichki tuzilishining o'ziga xos xususiyatlari tufayli. Plaplatilasi ostida jasadlarning tashqi kuchlar harakati ostida bo'lgan organlarning tashqi ta'sirini to'xtatib turish va tashqi ta'sirni to'xtatgandan keyin deformatsiyadan o'tish qobiliyati ostida. Ushbu metallarning bu xususiyati ularni kesish, metallga minish yoki simga olib tashlash paytida ularga boshqa shakl berishga imkon beradi.
Metalllarning pozitsiyasi kristalli panjarani tashkil etadigan ion qatlamlarining tashqi ta'siri bir-biriga nisbatan o'zgarmasdan o'zgargan holda siljiydi. Bu elektronni qayta taqsimlash tufayli boshqalarni qayta taqsimlashi sababli harakatlanish davom etayotgani natijasida ro'y beradi. Yadro panjarasi bilan mustahkam mustahkam mexanik ta'sirda uning alohida qatlamlari siljiydi va ular orasidagi yopishqoqlik yorilish tufayli buzilgan kovatli aloqa.
ionKeyin bu moddalar hosil bo'ladi kristall panjaraning ion turi.

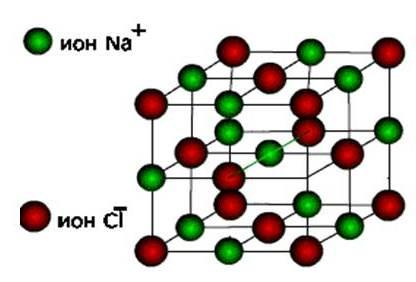
Bu tuzlar, shuningdek, omoidlar va tipik metallarning gidroksidlari. Bular mustahkam, mo'rt moddalar, ammo ularning asosiy sifati : Ushbu birikmalarning echimlari va eritilishi elektr tokalini olib boradi.
Agar billur panjaradagi tugunlarda joylashgan bo'lsa atomlarKeyin bu moddalar hosil bo'ladi kristall panjaraning atom turi(Olmos, burma, kremniy alyuminiy va kremniy oksidlari). Xususiyatlarga ko'ra, juda qattiq va refrakter, suvda erimaydi.
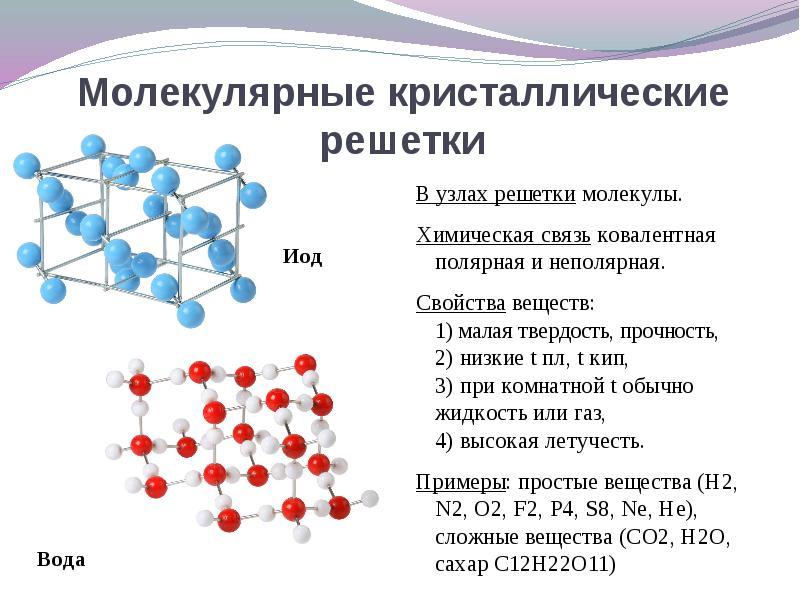
Agar billur panjaradagi tugunlarda joylashgan bo'lsa molekulalarUshbu moddalar shakli (gaz va suyuqliklarning normal holatida: o 2, HCl; i 2) organik moddalar).
Galliumning 30 ta haroratida eriydi, bu anomaliyaning erishicha, Ga 2 molekulalari va uning xususiyatlari moddalarga o'xshash kristall panjara yig'ilishlarida joylashganligi bilan izohlanadi. molekulyar kristalli panjara.
Misol.Nemolekulyar tuzilma Guruhning barcha metallariga ega:
1) uglerod, borki, silikon; 2) ftor, brom, yod;
3) kislorod, oltingugurt, azot; 4) xlor, fosfor, selen.
Ichida elastik bo'lmagan moddalar Eng kichik tarkibiy zarralar atomlar yoki ionlari. Kristalli panjara atom, ion yoki metalldir
Uchun eritma Bu savol aksiyasidan o'tish osonroq. Agar billur panjaradagi tugunlarda joylashgan bo'lsa molekulalarKeyin bu moddalar hosil bo'ladi kristall panjaraning molekulyar turi(Oddiy gazlar va suyuqliklarning normal holatida: o 2, HCl; shuningdek i 2, rombrik oltingugurt 8, oq fosformu p 4, organik moddalar). Xususiyatlar bo'yicha bu mo'rt past eritadigan birikmalar.
Ikkinchi javobda ftor gazi, uchinchi gazli gazlar, azot, to'rtinchi xlor gazida. Shunday qilib, bu moddalar molekulyar kristalli panjara va molekulyar tuzilishga ega.
Ichida avval Barcha moddalarga javob bering - normal sharoitda qattiq birikmalar va yadroviy panjara hosil qiladi, bu esa axloqsiz bo'lmagan.
To'g'ri javob:1) uglerod, Bor, kremniy
- Eng kam elektronegoriya kimyoviy elementdir.
- temir
- magniy
- kaltsiy
Diqqat "Kamida elektronegoriya" iborasiga to'lanishi kerak, ya'ni eng katta metall xususiyatlariga ega element. Ushbu dalil mumkin bo'lgan Azot javoblarini metall bo'lmagan holda yo'q qiladi va vazifada taklif qilingan metallarning eng faollari sifatida kaltsiyni to'xtatadi. Javob: 4.
- Molekulalardan birida polar kimyoviy aloqasi
- Cl 4.
- Sankt 4.
Elektronlashtirishdagi o'zgarishlar shakllarini bilish, davriylik tizimining davriy qismlari va CF 4-ning 4-sonli CF 4-da to'xtatish uchun. Uglerodning barcha kimyoviy elementlarning eng yuqori elektron elementlari - fluon. Javob: 2
- Xlorid molekulalari va xlor kimyoviy aloqalarida
- ion va kovalent qutblari
- ion va kovalent bo'lmagan polar
- kovalent qutblari va kovalent noto'qima
- vodorod va kovalent bo'lmagan polar
Ushbu vazifani tez va to'g'ri bajarish uchun kalit so'z "mos ravishda" so'zidir. Taklif etilayotgan versiyalarda faqat javoblardan biri "Kovali qutb" so'zlaridan boshlanadi, y.e. xlorodorga xos bo'lgan obligatsiyalar. Javob: 3.
- Muvilganlarning aralashmasida okganetsning oksidlanishi darajasi, ularning formulasi, uning 2 mno 4 ga teng
Formula tomonidan elementlarning oksidlanish darajasini hisoblash qoidalarini bilish sizga to'g'ri javobni tanlashga imkon beradi. Javob: 3.
- Oksidlanishning eng kichik darajasi oltingugurtga ega
- sulfat kaliy
- sulfit kaliy
- sulfid kaliylari
- kaliy gidroodfate
Shubhasiz, ushbu vazifaning tezkor bajarilishi tuzlarning ismlarini formulada tarjima qilishdir. Oltingugurt guruhning elementi bo'lganligi sababli, undan yuqori oksidlanishning eng kichik darajasi -2. Ushbu qiymat K 2 Sulafium sulfidi bilan aralashmaga mos keladi. Javob: 3.
- Oksidlanish darajasi +5 xlorli atom ionida
- C1O - 4.
- C1o -
- C1O - 3.
- C1O - 2.
Ushbu vazifani bajarishda siz biron bir holatda elektron birikmalar yo'qligiga e'tibor berishingiz kerak, ammo xlor ionlari bitta salbiy zaryad bilan ("-"). Iondagi atomlarning oksidlanish darajasi bo'yicha ion zaryadiga teng bo'lganligi sababli ionning zaryadlanishi, sning tiniqlashtirilgan ionidagi kislorod atomlarining salbiy zaryadi (+5 - 6 \u003d -1). Javob: 3.
- Ikkala ulanishning har bir ulanishining har birida oksidlanishning darajasi darajasi
- Nf 3 va nh 3
- Nh 4 Cl va n 2 O 3
- NH 4 CL va NH 3
- Hno 2 va nf 3
O'ngdagi javobni aniqlash uchun, variantlarni chapga va o'ng ovozli javoblar uchun ruhiy ravishda ajratish kerak. Keyin birikmalarning soddalashtirilgan kompozitsiyani tanlang - bizning holatda, bu o'ng sotilgan ikkilik birikma. tahlil oksidi kabi, javob 2 va 4 bartaraf va kam elektronegatif element kabi, azot oksidlanish ijobiy darajasini ftorid bo'ladi. Ushbu argumentni chiqarib tashlash va qabul qilish imkonini beradi, chunki bu birinchi modda - barcha azot ftoridi. Javob: 3.
- Molekulyar tuzilmaning moddalariga kirmaydi
- karbonat angidrid
- metan
- xloroyik
- kaltsiy karbonat
Topshiriq holatiga qo'yilgan salbiy hukmga e'tibor berishingiz kerak. normal sharoitda gazsimon moddalar mustahkam davlat molekulyar kristal panjarani surib ekan, belgilash holati 1-3 Condition mos emas. Kaltsiyni tuzlar uchun yana to'g'ri javobni tasdiqlaydi. Javob: 4.
- Moddalar va ularning tuzilishi haqidagi quyidagi hukmlar bormi?
A. His ichki kiyimi sovuqda quriydi, chunki molekulyar tuzilish moddalari subtimulyatsiya (sublimatsiya) ga qodirdir.
B. Nam ichki kiyimlar sovuq bo'lib chiqadi, chunki suv molekulalari past molekulalar kam molekulyar og'irlikka ega.
- haqiqiy atigi A.
- faqat B.
- ikkala qaror ham to'g'ri
- ikkala hukm ham to'g'ri emas.
Bilim jismoniy xususiyatlar molekulyar tuzilishi moddalar sovuq quruq kir quritish sabab süblimleştirme uchun muz qobiliyati emas, balki suv molekulalari dipol tuzilishi, deb qaror qabul qilish imkonini beradi. Javob: 1.
- Molekulyar tarkibi har bir moddaning har bir moddasi, ular qatorda berilgan
- CO 2, HNO 3, SOO
- Na 2 s, br 2, 2
- H 2, 4, cu, o 3
- Shunday qilib, 2, i 2, nsl
Taklif etilayotgan parametrlar uchta moddani o'z ichiga olganligi sababli, bu versiyalarni aqliy ravishda ajratish mantiqiy. u metall kristal panjarani ega, metall mis o'z ichiga oddiy tuzilishiga (o'rtacha podstolbik) moddalar bilan boshlangan ularning har tahlili, javob 3 bartaraf qiladi. o'ng signal A o'xshash tahlil (ion panjara) u pitch-yer metall oksidi o'z ichiga olgan bo'lib, u iloji, javob 1 bartaraf etish qiladi. Qolgan ikkita variantdan 2-variantni chiqarib tashlash kerak, chunki u tarkibida alkali metal tuzi - natriy sulfid (ion panjarasi) mavjud. Javob: 4.
Mustaqil ish uchun vazifalar
- Oksidlanish darajasi +5 azotning aralashmasi, ularning formulasi
- N 2 O 5
- N 2 O 4
- N 2 O.
- Murakkablikda xromlarning oksidlanishi darajasi (NH 4) 2 kub 2 ER 7 formulasi tengdir
- Bir qator moddalar qatorida azotning oksidlanish darajasi kamayadi, ularning formulalari
- Nh 3, yo'q 2, kno 3
- N 2 O 4, kno 2, nh 4 Cl
- N 2, n 2 O, nH 3
- Hno 3, hno 2, 2
- Xlorni oksidlash darajasi bir qator moddalar, formulalar ko'payadi
- NSLO, NSLO 4, KSLO 3
- CL 2, C1 2 O 7, KSLO 3
- Ca (c1o) 2, Kslo 3, NSLO 4
- KSL, KSLO 3, KSLO
- Molekulada eng polar kimyoviy aloqa
- ammiak
- serovodorod.
- bromodorod
- fluorodorod
- Kova'siz notanish aloqasi bo'lgan modda
- oq fosfor
- alyuminiy fosfidi
- fosfor xlorid (v)
- kaltsiy fosfat
- Bir qatorda ion obligatsiyalari bilan formulalar
- natriy xlorid, fosfor xlorid (v), natriy fosfat
- natriy oksidi, natriy gidroksid, natriy peroksid
- seroulag', kaltsiy karbinasi, kaltsiy okksidi
- kaltsiy ftoridi, kaltsiy oksidi, kaltsiy xlorid
- Atomik kristalli panjaraga ega
- natriy oksidi
- kaltsiy oksimoni
- oltingugurt oksidi (IV)
- alyuminiy oksidi
- Ion bilan aloqa kristalli panjara xlor bilan aloqada bo'lganida hosil bo'ladi
- fosfor
- bariy
- vodorod
- kulrang
- Ammoniy xlorid haqida quyidagi hukmlar bormi?
Ammoniy xlorid - bu kovalent qutblari va ion aloqalari tomonidan hosil bo'lgan ion tarkibiy qismidir.
B. Ammoniy xlorid - ion tuzilishining mohiyati, shuning uchun qattiq, refrakter va aylansiz.
- haqiqiy atigi A.
- faqat B.
- ikkala qaror ham to'g'ri
- ikkala qaror ham noto'g'ri
08. Elektr, oksidlanish darajasi, oksidlanish va tiklanish
Keling, kimyo fanidan mavjud bo'lgan o'ta qiziqarli tushunchalarning ma'nosini muhokama qilaylik va ko'pincha fan sohasida, etarli darajada chalkashib, teskari shaklda ishlatilgan. Bu "Elektronlik", "oksidlanish darajasi" va "qizil reaktsiyalar" ga tegishli bo'ladi.
Bu nimani anglatadi - kontseptsiya teskari shaklda ishlatiladi?
Biz asta-sekin bu haqda aytib berishga harakat qilamiz.
Elektr energiyasi Bizga kimyoviy elementning qizil qismining qizil qismlarini namoyish etadi. Ya'ni, uning bepul fotonlarini olish yoki berish qobiliyati. Va bu ham manba yoki energiya ajrimi (efir). Yang yoki Yin.
Oksidlanish darajasi - "Elektronlik" kontseptsiyasiga o'xshash tushuncha. Shuningdek, u elementning qizil qismining qizil qismlarini tavsiflaydi. Ammo ular orasida navbatdagi farq bor.
Elektr energiyasi alohida elementning o'ziga xos xususiyatini beradi. O'zi tomonidan kimyoviy birikmada topishni istisno qiladi. Oksidlanish darajasi oksidlanish va tiklovchi qobiliyatni elementi har qanday molekulaning bir qismi bo'lganda aniq tavsiflaydi.
Keling, oksidlash qobiliyati nimada gaplashaylik va tiklanish qobiliyati nimada.
Oksidlash - Bu bepul fotonslarning (elektronlarning) boshqa elementiga o'tkazish jarayoni. Oksidlanish hech qanday elektronni chiqarib tashlamaydi, chunki hozirda hozirgi kunda fan bo'yicha hisoblanadi. . Element yana bir elementni oksidlashda, u kislota yoki kislorod kabi harakat qiladi (shu sababli "oksidlanish" nomi "). Oksidlash - bu halokat, parchalanish, yonish elementlarini targ'ib qilish demakdir . Oksidlanish qobiliyati - bu molekulalarni ular tomonidan uzatiladigan (bepul fotonlar) tomonidan yo'q qilish qobiliyatidir. Esingizda bo'lsa, energiya har doim moddani yo'q qiladi.
Ajablanarlisi shundaki, ilmda, fanlar mantiqiy jihatdan qarama-qarshiliklar mavjud, ular hech kim tomonidan sezilmaydi.
Bu erda, masalan: (Yosh kimyogar, bir maqolada "Oksitlenme va reaktsiya entsiklopediyasi)" "Endi biz oksidlovchi agent elektronlar oladi va kamaytirish agenti ularni beradi modda ekanligini bir modda, deb bilaman".
Shu zahotiyoq, quyidagi ikkita paragraf: "Eng kuchli oksidlovchi elektr toki (salbiy zaryadlangan elektron oqimi)" (Ibid.).
Ular. birinchi narxda oksidlash vositasi qaysi elektron bo'lib, qaysi elektronlar olib boriladi va ikkinchi oksmogatda nima beradi.
Bir-biriga zid bo'lgan xatolar maktablar va institutlarda yodlashga majbur bo'ladi!
Ma'lumki, eng yaxshi oksidlovchilar metall bo'lmagan. Bundan tashqari, davr raqami va undan ko'p guruh raqami, oksidlantning xususiyatlari kuchayadi. Bu ajablanarli emas. Buning sabablarini davriy tizimni tahlil qilishga bag'ishlangan maqolada, ikkinchi qismda nuklonlarning rangi haqida gapirgan. 1-guruhdan 8 gacha bo'lgan elementlar rangi asta-sekin binafsha rangdan qizil ranggacha o'zgarib turadi (agar siz yoki F-elementlarning ko'k rangini ko'rib chiqsangiz). Sariq va qizil zarralarning kombinatsiyasi to'plangan bepul fotonslarning qaytarilishini osonlashtiradi. Sariq to'planadi, lekin zaif ushlab turing. Va qizil qaytishga hissa qo'shadi. Fotonlarni qo'ying - bu oksidlanish jarayoni. Ammo ba'zilari qizil bo'lsa, unda fotoni to'plash uchun zarralar yo'q. Shuning uchun 8 guruhning elementlari, oksidlovchi moddalar emas, qo'shnilaridan farqli o'laroq, gagogen.
Qayta tiklash - Bu oksidlanishga qarama-qarshi bo'lgan jarayon. Endi, fan bo'yicha, kimyoviy element elektronni qabul qilganda, u tiklanadi. Bu nuqtai nazarni tushunish uchun juda mumkin (lekin qabul qilinmaydi). Kimyoviy elementlarning tuzilishini o'rganayotganda, ular elektronni chiqarganlari aniqlandi. Elektron elementlar elementlarning bir qismidir degan xulosaga keldi. Bu shuni anglatadiki, elektron elementning yo'qolishi, yo'qolgan tuzilishini tiklash va tiklanishi.
Ammo aslida, hamma narsa noto'g'ri.
Elektron fotonlar. Ular nuklon emas. Ular elementning tanasining bir qismi emas. Ular tashqi tomonga kirish va nuklonlarning yuzasiga to'planib, ular orasida to'planadi. Ammo ularning to'planishi umuman element yoki molekulaning tuzilishini tiklash uchun umuman emas. Bundan farqli o'laroq, ular tomonidan olib borilayotgan bu fotonlar elementlar o'rtasidagi aloqani zaiflashtiradi va yo'q qiladi. Va bu oksidlanish jarayoni, ammo tiklanmaydi.
Haqiqatdan, molekulasini tiklang, - undan (bu holatda, bepul fotonlar) va hisobot bermang. Fotonlarni tanlash, elementni tiklash vositasi moddani yig'adi - uni tiklaydi.
Eng yaxshi kamayuvchi vositalar metallardir. Ushbu mulk tabiiy ravishda ularning sifatli va miqdoriy tarkibidan kelib chiqadi - ularning diqqatga sazovor joylari eng katta va sirtda, albatta, juda ko'p yoki etarli zarralar mavjud. ko'k rang.
Siz hatto metallarni quyidagi aniqlashni amalga oshirishingiz mumkin.
Metall - Bu kimyoviy element, sirt qatlamlari tarkibida, ularda ko'k zarralar mavjud.
Lekin metall bo'lmagan - Bu element, uning sirli qatlamlari tarkibida, ular ko'k rangdagi fotonlar yo'q yoki deyarli qizil ranglar mavjud emas.
Ularning kuchli diqqatga sazovor joyi bo'lgan metallar elektronni mukammal qabul qiladi. Va shuning uchun ular mallalarni kamaytirishadi.
Biz kimyo bo'yicha darsliklarda topilishi mumkin bo'lgan "oksidlanish", "Redoks reaktsiyalari", "oksidlanish darajasi", "Oksident reaktsiyalari" tushunchasini belgilaymiz.
« Oksidlanish darajasi - Atomning sharafli aralashuvi, bu faqat ionlardan iborat deb hisoblanadi. Ushbu kontseptsiyani belgilashda, bog'lovchilar (valent) elektronlar ko'proq elektron atomlariga o'tishiga ishonishadi va shuning uchun aralashmalar ijobiy va manfiy zaryadlangan ionlardan iborat. Oksidlanish darajasi nol, salbiy va ijobiy qiymatlarga ega bo'lishi mumkin, ular odatda elementning ramzi yuqoridan yuqori bo'lgan.
Oksidlanish darajasi nol qiymati bepul davlatning atomlariga tegishli ... oksidlanish darajasi - bu bog'lovchi elektron bulut (elektron juftligi) o'zgaradi. Uning barcha ulanishlarida fluon u -1 ga teng. Ijobiy oksidlanish boshqa atomlarga valentlik elektronlarini beradigan atomlarga ega. Masalan, ishqorli va ishqorli er metallari, mos ravishda +1 va +2. Oddiy ionlarda u Ionning zaryadiga teng. eng aralashmalari, vodorod atomlari oksidlanish darajasi + 1, lekin metallar (vodorod bilan birikmalar) va boshqalar hidridleri yilda - u -1 tengdir. kislorod, oksidlanish darajasi -2 xususiyati, lekin, masalan, ftor bilan bir tarkibdan u +2 bo'ladi, va peroksidasyonu bilan aloqasi bo'lgan -1. ...
aralash ichida atomlarning oksidlanish algebraik yig'indisi nolga teng bo'ladi, va kompleks ion bilan - ion zaryad. ...
Eng yuqori darajadagi oksidlanish eng katta ijobiy ahamiyatga ega. Aksariyat elementlar uchun u davriy tizimdagi guruh raqamiga tengdir va ulanishdagi elementning muhim miqyosidagi xarakterli. Uning birikmalarida uchraydigan elementning oksidlanish darajasi eng kichik qiymati kamroq oksidlanish deb ataladigan odatiy hisoblanadi; Boshqalar - oraliq "(yosh kimyogarning entsiklopedik lug'ati, oksidlanish darajasi)).
Bu erda ushbu kontseptsiya bilan bog'liq asosiy ma'lumotlar. Bu boshqa atama bilan chambarchas bog'liq - "Elektr".
« Elektr energiyasi - Bu "(Elektr" Yoshlik kimyogar, maqola qomusiy lug'at ") bir kimyoviy bog'lanish shakllantirishda ishtirok elektronlar jalb etish molekulada bir atomning qobiliyatidir.
"Redok reaktsiyalari boshqa atomning atomidan (kamaytirish agentlik) atomidan (kamaytirish vositasi) atomidan (qisqartirish vositasi) atomining harakatlanishiga olib keladigan atomlarning oksidlanishi darajasi o'zgaradi. Oksidatif va kamaytirish reaktsiyalar, Oksidlanish (elektron Qaytish) va sog'lomlashtirish (elektron Kiritilgan) sodir (kimyoviy qomusiy lug'at) bilan (kimyoviy qomusiy lug'at Ed. I.L. Knunyantz, maqola "redoks reaksiya").
Bizning fikrimizcha, ushbu uchta tushunchaning bir nechta xatolari mavjud.
Birinchidan Xullamiz ikki element o'rtasidagi kimyoviy ulanishning shakllanishi barcha elektronlarni sotish jarayonida emas. Kimyoviy aloqasi - bu tortishishlar. Gazeta, yadro atrofida uchib ketayotgan elektron vositalar, elementning tanasida va ularning orasidagi nuklonlarning yuzasida to'plangan bepul fotonlar. Ikki element o'rtasida ulanish paydo bo'ldi, ularning bepul fotonlari elementlar orasida ishlashi shart emas. Bu sodir bo'lmaydi. Aslida, og'irlik elementi erkin fotonlarni engillashtiradi va ularni (aniqroq, o'zingda) qoldiradi. Va bu fotonlar olib tashlangan engil elementning zonasi, yoki boshqa yo'l bilan. Shundan ushbu zonadagi diqqatga sazovor joylar ko'proq namoyon bo'ladi. Va osonroq element og'irlashadi. Shunday qilib, kimyoviy obligatsiya paydo bo'ladi.
Ikkinchidan , Zamonaviy kimyo elementlarning buzilgan elektronlarni jalb qilish qobiliyatini ko'radi. Elementning qo'shilishi qanchalik katta bo'lsa, u o'z-o'zidan elektronni jalb qila oladi deb ishoniladi. Gislorodli ftorlar buni eng yaxshi qiladi - ular boshqa elektronlarni o'zlariga jalb qilishadi. Shuningdek, boshqa elementlar 6 va 7 guruh.
Aslida, bu fikr - bu ahmoqona emas. Bu noto'g'ri ko'rinishga asoslanadi, go'yo guruh raqami ko'proq, qiyin narsalar. Shuningdek, yadroning ijobiy zaryadi shunchalik katta bo'ladi. Bu bulbul. Olimlar o'z nuqtai nazaridan "ayb" ekanligini tushuntirish uchun o'zlarini bezovta qilmaydilar. Oddiy qilib aytganda, ular hisob-kitoblardagi barcha elementlarni qayta ko'rib chiqishdi va to'lov qiymatlari soniga muvofiq imzolangan. Ajoyib sayohat!
Bu aniq va bola zich metaldan engilroq. Qanday qilib kimyatda gazlar gazni yaxshiroq jalb qilish kerak deb hisoblanadi?
Zich metallar, albatta, ular elektronni yaxshiroq jalb qiladi.
Albatta, kimyogarlar, albatta, kursda "elektron arbob" tushunchasini tark etishlari mumkin, chunki u juda keng tarqalgan. Biroq, ular uning ma'nosini qarama-qarshi yo'nalishda o'zgartirishlari kerak.
Elektr energiyasi - Elektronlashtirish uchun molekulasdagi kimyoviy elementning qobiliyati. Va, albatta, metallarda bu qobiliyat metallarga qaraganda yaxshiroq ifodalanadi.
Molekuladagi elektr tirgaklariga, keyin, albatta, salbiy qutb - Bular kichikroq diqqatga sazovor joylar bilan elektronni beradigan metall bo'lmagan elementlar. Lekin ijobiy - Bu har doim ko'proq aniqlikdagi metall xususiyatlarga ega, katta diqqatga sazovor joylar bilan.
Birgalikda tabassum qiling.
Elektr energiyasi - Bu boshqa bir, kimyoviy element sifatini tasvirlash uchun yana bir urinish, ular allaqachon amaldagi tortish va zaryadlash. Ko'pincha bu holda, boshqa fan sohasidagi olimlar, bu holda kimyo, go'yo kimyo, go'yo kimyo, go'yo kimyo, go'yo kimyo, go'yo fiziklarga ishonish emas, balki kashfiyotlar qilgani kabi, yo'q boshqalarning tajribasini o'rganish.
Shunday qilib, bu safar sodir bo'ldi.
Oyat va ayblovlar bir-birlari bilan o'zaro munosabatda bo'lishiga yordam bermadi - va Elektr jihozlari joriy etildi va elementning kimyoviy obligatsiyalarini shakllantirishga jalb qilingan elektronlarni jalb qilish qobiliyati joriy etildi. Shuni tan olish kerakki, ushbu kontseptsiya g'oyasi juda to'g'ri. O'zaro haqiqatni teskari shaklda aks ettirgan yagona tuzatish bilan. Aytganimizdek, metall bo'lmaganlar emas, balki metall elektronni, sirt nuklonining ranglari xususiyatlari tufayli eng yaxshisidir. Metallar eng yaxshi kamayuvchi vositalardir. Nonvetlar - oksidlovchi moddalar. Metallar olinadi, metallar berilmaydi. Metallar - yin, nemmetralla - yang.
Ezoterik fanning sirlarini tushunish masalalarida ilm-fanga yordam berish.
Bor oksidtsiya darajasi Bu kimyoviy birikma - molekulalarda erkin elektronlarning tarqalishi qanday sodir bo'lganligini tushunish uchun yaxshi urinish.
Agar kimyoviy birikma bir xil bo'lsa - ya'ni bu oddiy, uning tuzilishi bir xil turdagi elementlardan iborat - keyin hamma narsa to'g'ri, haqiqatan ham aralashmadagi har qanday elementning oksidlanishi darajasi nolga teng. Shu munosabatda oksidlovchilar yo'q va qayta ishga tushiruvchilar yo'q. Va barcha elementlar sifat jihatidan tengdir. Hech kim elektronni olmaydi, hech kim bermaydi. Bu zich modda yoki suyuqlik yoki gaz bo'ladimi - muhim emas.
Oksidlanish darajasi, shuningdek, elektronegrativ darajasi kimyoviy element sifatini namoyish etadi - faqat kimyoviy element doirasida. Oksidlanish darajasi aralashmadagi kimyoviy elementlarning sifatini taqqoslash uchun mo'ljallangan. Bizning fikrimizcha, g'oya juda yaxshi, ammo uni amalga oshirish umuman qoniqmaydi.
Biz kimyoviy elementlar va ular orasidagi aloqalarning tuzilishi va kontseptsiyasiga qarshi qat'iyan zidiksiz. Xo'sh, agar bizning g'oyalarimizga ko'ra, guruhlar soni 8 dan oshmasligi kerak, shuning uchun butun tizim qulab tushadi. Ha, va nafaqat bu. Umuman olganda, "barmoqlar" atomlarida elektronlar sonini qayta hisoblash qandaydir tarzda jiddiy emas.
Joriy tushunchaga muvofiq eng kuchli oksidlovchilarga eng kichik sharqiy ayblovlar berilganligi ma'lum bo'lib, ftorinning barcha birikmalarida, kislorod deyarli hamma joyda kislorodning zaryadiga ega. Va juda faol metallarda - ishqorli va ishqorli erlar - bu to'lovlar mos ravishda, +1 va +2. Axir, bu mutlaqo mantiqiy emas. Garchi, biz takrorlaymiz, biz umumiy sxemani juda yaxshi tushunamiz, bunga muvofiq, jadvalda 8 guruh va tashqi energiya darajasida 8 ta elektron uchun 8 guruh uchun.
Biroq, minimal darajada, halogen va kisloroddagi ushbu ayblovlarning kattaligi eng katta bo'lishi kerak edi. Ishqorli va ishqorli er metallari ham katta, faqat ortiqcha belgi bilan.
Har qanday kimyoviy birikma Elektronlashtirish vositalarida, oksidlovchi moddalar, salbiy to'lovlar, salbiy xarajatlar va elementlarni qabul qiladigan elementlar - agentlar, metallarni kamaytirish, ijobiy zaryad keltiradigan elementlar mavjud. Bu elementlarni taqqoslashning aniq usuli, ularni bir-biriga bog'lang va ularning oksidlanishini belgilab, harakat qilib ko'ring.
Biroq, buni shu tarzda aniqlash uchun oksidlanish darajasi, bizning fikrimizcha, haqiqatni aniq aks ettirmaydi. Molekuladagi elementlarning elektron vositasini taqqoslash yanada to'g'ri bo'ladi. Axir, elektronegrativlik oksidlanish darajasi bilan bir xil (sifatni belgilaydi, faqat alohida element).
Siz elektr tarmog'ini olishingiz va har bir element uchun formulaga qo'yishingiz mumkin. Va keyin darhol ko'rinadi, qaysi elementlarga elektron pochta beriladi va ular olingan. Kompozitdagi tarkibdagi eng yuqori - salbiy qutb ekanligi, elektron ko'rsatadigan bu elementi elektronni beradi. Kimning elektron qo'li eng kichik - ijobiy qutb, elektronni oladi.
Agar buyumlar, tan olish, 3 yoki 4 molekulada hech narsa o'zgarmaydi. Hammasi ham elektron vositalarining kattaligini joylashtiradi va taqqoslaydi.
Garchi molekulaning tuzilishining modelini chizish unutilmasligi kerak. Darhaqiqat, har qanday birikmada, agar bu oddiy bo'lmasa, u bir turdagi elementlardan iborat emas, birinchisiga, birinchi navbatda, metallar va metallar bilan bog'liq. Metalletlar elektron va ular uchun bog'lab qo'yilgan elektronlarni tanlang. Va metall bo'lmagan, elektron bo'lmaganlar, elektron bo'lmaganlar 2-sonli yoki ko'proq aniq metall xususiyatlariga ega bo'lgan bir qator elementlarni tanlab olish mumkin. Shunday qilib, murakkab molekula paydo bo'ladi. Ammo bu bunday molekulada metall elementlar qattiq ulanish va bir-biri bilan paydo bo'ladi degani emas. Ehtimol, ular qarama-qarshi tomonlarda joylashgan bo'lishi mumkin. Agar yaqin atrofda bo'lsa - ular jalb qiladi. Ammo qattiq ulanish faqat bitta element boshqasidan ko'proq metallroq bo'lsa, shakllanadi. Elektron elementni tanlang - Elektronlarni tanlang - olib tashlanadi. Aks holda, element sodir bo'lmaydi - yuzidagi bepul fotonslardan ozod qilish. Ajratish maydoni yaxshi namoyon bo'lmaydi va bardoshli ulanish bo'lmaydi. u murakkab mavzu - Ta'lim kimyoviy aloqaVa biz bu haqda ushbu maqolada batafsil aytib bermaymiz.
Biz ishonamizki, biz "Oksidtemity", "Oksidit", "Oksidlanish" va "tiklanishi" va "tiklanishi" tushunchasiga bag'ishlangan mavzuni yuqori darajada yoritdik va diqqatingizga qiziquvchan ma'lumotlarga egamiz.
Kitob boshqargan orzulardan Dunyo muallifi Elena muallifiQayta tiklash "indi-nuqtaning yagona belgisi tug'iladi, mohiyat va hayot ikkiga bo'linadi. Shu paytgacha, agar oxirgi dunyoni etmasa, mohiyati va hayot hech qachon bir-birini ko'rmaydi ». Uilyam, institutdan keyin "Oltin gulning siri"
Kitob kitobi sirlar kitobi. Yer va chet elda juda aniq ko'rinadi Muallif Vyatkin Arkadiy DmitrievichUshbu ma'noda istakli varaqa miqdori sifatida masshizm - bu o'z ixtiyori varaqasi masofam telekommunikatsiyaga o'xshaydi. Mazochichilar - bu yoqimli hissiyotlarni o'z jismoniy va ruhiy azoblaridan oladigan odamlar. Boshqacha qilib aytganda, ular uni urishganda, masxara qilishadi, masxara qilishadi
Rossiyadagi vampirlardan. Siz ular haqida bilishingiz kerak! Muallif Bauer AleksandrVampir qon ichganda qon yo'qotish darajasini qanday aniqlash mumkin, keyin bir yarim litrdan bir yarim litrgacha iching. Inson tanasi faqat besh yoki olti litr qonni o'z ichiga oladi, shunda bunday qon yo'qotish hayot uchun xavfli emas. Biroq, Vampire mumkin
Kelajakni tushda modellashtirish kitobidan Dunyo muallifi Elena muallifiKengaytirilgan kompaniyada muhandis sifatida ishlash, men o'z joyida emasligimni anglab, men kasbni o'zgartirishga qaror qildim va keyinchalik klassik ofis uchun "Yazz" ni improvizatsiya maktabiga kirdim. .
Fengshui kitobidan. Muvaffaqiyat, farovonlik va uzoq umr ko'rish uchun 10 ta oddiy qadam Muallif Rudin Valentin LeonidovichTashqi ob'ektlarning salbiy ta'sir darajasi tashqi ob'ektlarga eng katta salbiy ta'sir ko'rsatadi, uyga kirishdan oldin darhol bo'ladi. Ammo ular ko'proq kirish burchakda joylashgan bo'lsa, zaiflik ularning ta'siriga aylanadi. Ob'ekt to'g'ridan-to'g'ri
Eduardning muallifi tomonidanBirinchi daraja: pishirish. Nibanniy va'zim va Xudoning Masihining holati, Jalila Xillidan boshlanadi va "Xudoning Shohligi" haqida e'lon boshlanadi. Ushbu bashorat bizning mashhur ko'rsatmalarini bildiradi. Shu bilan birga, bu yanada balandlikka tayyorgarlik
Ilohiy evolyutsiya kitobidan. Sphinxdan Masihga Eduardning muallifi tomonidanTashabbusning ikkinchi darajasi (tozalash). Ajoyib shifo. Axloqiy va intellektual tayyorgarlik uchun barcha qadimiy sirlardagi xristian terapiyasi ruhni tozalab, unda yangi organlarni jonlantirishi va keyinchalik qobiliyat beradi
Kitobdan katta sfinx jumboq Muallifning muallifi GruzesHaykalni tiklash Katta sfinchinning haqiqiy yoshi Adam davrining boshiga qaytadi. Hech bo'lmaganda u zamonaviy piramida, u biz ko'radigan darajada, uni tugatdik. Katta skhyxning surati ko'p asrlar davomida ta'sir ko'rsatdi
Qalbni shifo berish kitobidan. 100 ta meditotatsiya usullari, shifo mashqlari va dam olish Muallif RAJNANN BHAGWAN SRIRitmni tiklash ... Yotoqqa yotish uchun bir xil vaqtni o'rnating - agar har oqshom bo'lsa, bu o'n bir. Bu birinchi vaqtni anglatadi va tez orada tana bu ritmga kira oladi. Bu vaqtni o'zgartirmang, aks holda siz tanani tanlaysiz. Tana
muallif Kuzmishin E. L. tomonidanTalaba olish darajasiga talaba darajasiga ko'tarilish darajasi. Yaratilish va domenlarning domenlari va turar joyning shiftini yarqirashsiz ko'k va oq korpusni yopishtirish kerak. Ekspertster boshlig'i ustida o'z markazidagi uchburchak porlash bilan o'ralgan
Kaloiosostro va Misr MessiaSonri kitobidan muallif Kuzmishin E. L. tomonidanTalaba darajasida qabul. Lodborlarning bezaklari va domenlari va turar joyning shiftida yarqiramasdan ko'k va oq materiya bilan osilgan bo'lishi kerak. Ekspertster boshlig'i ustida uchburchak porlash bilan o'ralgan bo'lib, uning markazida kashta tikkan
Kitob avtobiografiyasi yoga Muallif Yogadan paramyansa23-bob Men universitet darajasini olaman - siz darslikning falsafiy ta'riflarini, shubhasiz, ba'zi yaxlitlik "sezgi" sizni barcha imtihonlarda ushlab turadi. Ammo agar siz zudlik bilan ko'proq ilmiy usul bilan maslahat bermasangiz, unda men kerak
Kabbala kitobidan. Eng yuqori dunyo. Yo'lning boshlanishi Muallif Yengil Maykl.7.5. "Tezlashtirish" maqolasida aniqlik va baxtni bilish darajasi, zavq va sabrsizlik darajasida - azob va sabrsizlik darajasiga ko'ra - Yaratganning farqlari darajasida aniqlanadi. Bunga muvofiq, xudbin biz uchun jirkanch va chidab bo'lmas.
1 variant
1. Quyidagi ulanishlarda kimyoviy elementlarning atomlarini oksidlash darajasini aniqlang: Hno₃₃, NO NO, H₃N, NOBO.
2. Vaqti-vaqti-vaqti bilan foydalanish, elektron jadvalni olish uchun quyidagi elementlarni o'z ichiga oladi: o, n, B, B, Li, Li, Sodium ushbu ketma-ket qaerda joylashganligini aniqlash. Javobni tushuntiring. 
3. Oltingugurt atomining oksidlash darajasi bunga qanday o'zgarganda o'zgaradi? Javob javobni tushuntiring.
2-variant.
1. Quyidagi ulanishlarda kimyoviy elementlarning atomlarini komolifikasini aniqlang: Co₂, Hăpo₄, Sih₄, P₂₂, MG₂SI.
2. Kimyoviy element umumiy tarzda siljiydigan atomlar yo'nalishi bo'yicha elektron juftliklar, Quyidagi ulanishlarning molekulalari: bfę, pclę, cs₂, cclę, hb? Oqilona javob bering.
3. Formation davrida uglerod oksidlanish darajasi o'zgaradimi yoki yo'qmi ijara kislotasi HăCO uglerod dioksidi va suvi? Javob javobni tushuntiring.
3-variant.
1. Quyidagi ulanishlarda kimyoviy elementlarning atomlarini oksidlash darajasini aniqlang: CLI, NACLO, CACL₂, HF, Srow, Clṣo₇₇.
2. Foydalanish davriy tizim Kimyoviy elementlar, ularning elektronegratini oshirish tartibida quyidagi elementlarni joylashtiring: P, AL, CL, Na, S, Mg. Ushbu ketma-ket kaliy va ftorni toping. Javob javobni tushuntiring. 
3. Uglerod oksidi (IV) va suvni shakllantirish bilan metan cli-ni yoqishda uglerod oksidlanish darajasi qanday o'zgaradi? Javob javobni tushuntiring.
4-variant.
1. Quyidagi ulanishlarda kimyoviy elementlarning atomlarini oksidlash darajasini aniqlang: HăSo₄, Yo'q, no₂, bf₃, h₂s.
2. atomlarga qarab kimyoviy elementlar General elektron juftliklarni ko'rsatadi, quyidagi ulanishlarning molekulalarida: hgo, pclù, hgn, h₂s, cou? Oqilona javob bering.
3. Suv o'zgarganda atomlarning oksidlanishi darajasining o'zgarishi o'zgaradimi yoki yo'qmi oddiy moddalar - vodorod va kislorodmi? Javob javobni tushuntiring.


