Elektronegativite, bir kimyasal elementin, bu elementin bileşiklerde kimyasal bir bağ oluşturduğu diğer elementlerin atomlarından elektronları atomuna çekme özelliğidir.
Farklı elementlerin atomları arasında kimyasal bir bağ oluştuğunda, ortak elektron bulutu daha elektronegatif bir atoma kayar, bu nedenle bağ kovalent olarak polar hale gelir ve elektronegatifliklerde büyük bir fark olan iyonik olur.
Kimyasal formüller yazılırken elektronegatiflik dikkate alınır: ikili bileşiklerde, en elektronegatif elementin sembolü arkasına yazılır.
Elektronegatiflik, her dönemin elemanları için soldan sağa doğru artar ve aynı PS grubunun elemanları için yukarıdan aşağıya düşer.
Değerlik element, atomlarının belirli sayıda diğer atomlarla birleşebilme özelliğidir.
Stokiyometrik, elektronik değerlik ve koordinasyon numarası arasında ayrım yapın. Biz sadece stokiyometrik değeri dikkate alacağız.
Stokiyometrik değerlik, başka bir elementin kaç atomunun bu elementin bir atomuna eklendiğini gösterir. Değerlik birimi hidrojen değerliği olarak alınır, çünkü hidrojen her zaman tek değerlidir. Örneğin, HCl, H20, NH 3 bileşiklerinde (modern kılavuzlarda amonyak H 3 N'nin doğru yazımı zaten kullanılmaktadır), CH 4 klor tek değerlidir, oksijen iki değerlidir, nitrojen üç değerlidir ve karbon dört değerlidir.
Oksijenin stokiyometrik değeri genellikle 2'dir. Hemen hemen tüm elementler oksijenli bileşikler oluşturduğundan, onu başka bir elementin değerinin belirlenmesi için bir standart olarak kullanmak uygundur. Örneğin, Na20, CoO, Fe203, S03 sodyum bileşiklerinde tek değerlikli, kobalt iki değerlikli, demir üç değerlikli, kükürt altı değerlikli.
Redoks reaksiyonlarında elementlerin oksidasyon durumlarının belirlenmesi bizim için önemli olacaktır.
Paslanma durumu Bir maddedeki element, artı veya eksi işareti ile alınan stokiyometrik değerliği olarak adlandırılır.
Kimyasal elementler, elementlere bölünmüştür sabit değer değişken değerlik unsurları.
1.3.3. Moleküler ve moleküler olmayan yapıya sahip maddeler. Kristal kafes tipi. Maddelerin özelliklerinin bileşimlerine ve yapılarına bağımlılığı.
Bileşiklerin doğada bulunduğu duruma bağlı olarak, moleküler ve moleküler olmayan olarak ayrılırlar. İÇİNDE moleküler maddeler En küçük yapısal parçacıklar moleküllerdir. Bu maddeler bir moleküler kristal kafese sahiptir. Moleküler olmayan maddelerde, en küçük yapısal parçacıklar atomlar veya iyonlardır. Kristal kafesleri atomik, iyonik veya metaliktir.
Kristal kafes tipi, büyük ölçüde maddelerin özelliklerini belirler. Örneğin metaller metal tipi kristal kafes, diğer tüm unsurlardan farklıdır yüksek plastisite, elektriksel ve termal iletkenlik... Bu özellikler ve diğerleri - işlenebilirlik, metalik parlaklık vb. metal atomları arasındaki özel bir bağ nedeniyle - metal bağlantı. Metallere özgü özelliklerin yalnızca yoğunlaştırılmış durumda göründüğüne dikkat edilmelidir. Örneğin, gaz halindeki gümüş, metallerin fiziksel özelliklerine sahip değildir.
Metallerdeki özel bir bağ türü - metalik - değerlik elektronlarının eksikliğinden kaynaklanır, bu nedenle metalin tüm yapısında ortaktırlar. Metallerin yapısının en basit modeli, metallerin kristal kafesinin serbest elektronlarla çevrili pozitif iyonlardan oluştuğunu, elektronların hareketinin gaz molekülleri gibi düzensiz bir şekilde gerçekleştiğini varsaydı. Ancak böyle bir model, metallerin birçok özelliğini niteliksel olarak açıklarken, nicel doğrulamada yetersiz kalmaktadır. Metalik durum teorisinin daha da geliştirilmesi, yaratılmasına yol açtı metallerin bölge teorisikuantum mekaniği kavramlarına dayanmaktadır.
Kristal kafesin düğümlerinde katyonlar ve metal atomları vardır ve elektronlar kristal kafes boyunca serbestçe hareket eder.
Metallerin karakteristik bir mekanik özelliği, plastik, kristallerinin iç yapısının özelliklerinden dolayı. Plastisite, dış kuvvetlerin etkisi altındaki cisimlerin, dış etkinin sona ermesinden sonra bile kalan deformasyona uğrama yeteneği olarak anlaşılır. Metallerin bu özelliği, dövme sırasında farklı şekillerde şekillendirilmelerine, levhalar halinde yuvarlanmalarına veya tel haline getirilmelerine izin verir.
Metallerin plastisitesi, dış etki altında, kristal kafesi oluşturan iyon katmanlarının, kopmadan birbirlerine göre kaydırılmasından kaynaklanmaktadır. Bu, serbest yeniden dağıtım nedeniyle yer değiştiren elektronların iyonik katmanlar arasında iletişim kurmaya devam etmelerinin bir sonucu olarak ortaya çıkar. Atomik kafesli bir katı üzerindeki mekanik etki altında, tek tek katmanları yer değiştirir ve kırılma nedeniyle aralarındaki yapışma bozulur. kovalent bağlar.
iyonlar, sonra bu maddeler oluşur iyonik tip kristal kafes.

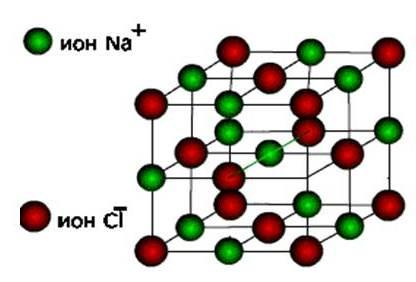
Bunlar, tipik metallerin oksitleri ve hidroksitlerinin yanı sıra tuzlardır. Bunlar sert, kırılgan maddelerdir, ancak ana kaliteleri : Bu bileşiklerin çözeltileri ve eriyikleri elektrik akımı iletir.
Kristal kafesin siteleri atomlar, sonra bu maddeler oluşur atomik kristal kafes türü(elmas, bor, alüminyum ve silikonun silikon oksitleri). Çok sert ve refrakter özelliktedir, suda çözünmez.
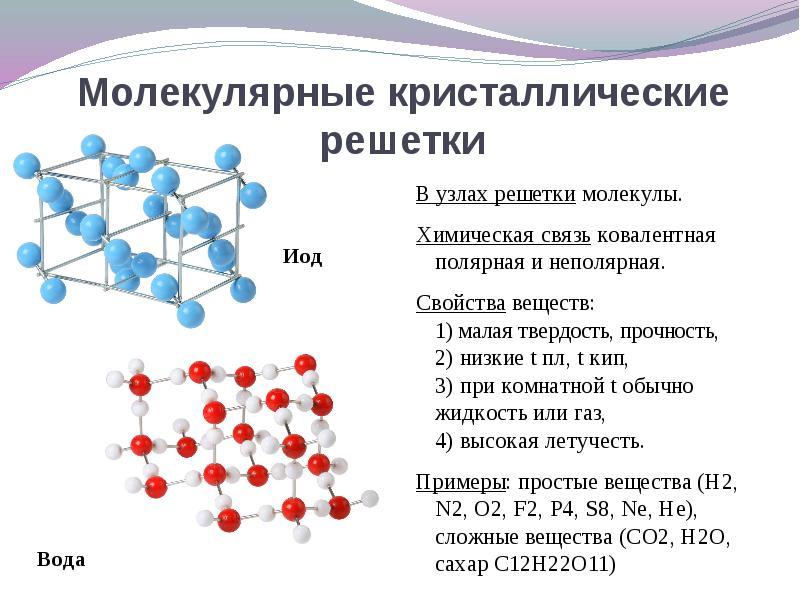
Kristal kafesin siteleri moleküllerdaha sonra bu maddeler oluşur (normal şartlar altında gazlar ve sıvılar: О 2, HCl; I 2 organik madde).
30 ° C sıcaklıkta eriyen metal galyuma dikkat etmek ilginçtir. Bu anormallik, Ga 2 moleküllerinin kristal kafesin düğümlerinde yer alması ve moleküler kristal kafesli maddelere benzeyen özellikleriyle açıklanmaktadır.
Misal.Grubun tüm metal olmayanları moleküler olmayan bir yapıya sahiptir:
1) karbon, bor, silikon; 2) flor, brom, iyot;
3) oksijen, sülfür, nitrojen; 4) klor, fosfor, selenyum.
Moleküler olmayan maddelerde, en küçük yapısal parçacıklar atomlar veya iyonlardır. Kristal kafesleri atomik, iyonik veya metaliktir
Ne zaman karar bu soruyu tersine çevirmek daha kolaydır. Kristal kafesin siteleri moleküller, sonra bu maddeler oluşur moleküler tip kristal kafes(normal koşullar altında gazlar ve sıvılar: O 2, HCl; ayrıca I 2, eşkenar dörtgen sülfür S 8, beyaz fosfor P 4, organik maddeler). Özelliklerine göre bunlar kırılgan, düşük erime noktalı bileşiklerdir.
İkinci cevapta, üçüncü - oksijen ve nitrojen gazlarında, dördüncü - klor gazında flor gazı var. Bu, bu maddelerin moleküler bir kristal kafese ve moleküler yapıya sahip olduğu anlamına gelir.
İÇİNDE ilk Cevap, tüm maddelerin normal koşullar altında katı bileşikler olması ve atomik bir kafes oluşturması, yani moleküler olmayan bir yapıya sahip olmalarıdır.
Doğru cevap:1) karbon, bor, silikon
- En az elektronegatif kimyasal element
- demir
- magnezyum
- kalsiyum
"En az elektronegatif" ifadesine, yani en büyük metalik özelliklere sahip elemente dikkat edilmelidir. Bu argüman, nitrojeni metal olmayan bir madde olarak olası cevaplardan hariç tutmamıza ve görevde önerilen metallerin en aktifi olarak kalsiyuma odaklanmamıza izin verecektir. Cevap: 4.
- Moleküllerden birindeki en polar kimyasal bağ
- CCl 4
- CBr 4
D.I. Periyodik Tablosunun dönemleri ve gruplarında elektronegatiflikteki değişikliklerin düzenliliği bilgisi. Cevap: 2.
- Hidrojen klorür ve klor moleküllerinde sırasıyla kimyasal bağ
- iyonik ve kovalent polar
- iyonik ve kovalent polar olmayan
- kovalent polar ve kovalent polar olmayan
- hidrojen ve kovalent polar olmayan
Bu görevi hızlı ve doğru bir şekilde tamamlamak için anahtar kelime "buna göre" dir. Önerilen varyantlarda, cevaplardan sadece biri, "kovalent polar", yani hidrojen klorürün bir bağ özelliği olan kelimelerle başlar. Cevap: 3.
- Formülü K 2 MnO 4 olan bir bileşikte manganezin yükseltgenme durumu
Formül ile elementlerin oksidasyon durumlarını hesaplamak için kuralları bilmek, doğru cevabı seçmenize izin verecektir. Cevap: 3.
- Tuzdaki kükürt en düşük oksidasyon durumuna sahiptir
- potasyum sülfat
- potasyum sülfit
- potasyum sülfür
- potasyum hidrojen sülfat
Açıktır ki, bu görevin hızlı bir şekilde tamamlanması, tuzların isimlerinin formüllere çevrilmesiyle kolaylaştırılacaktır. Kükürt, VIA grubunun bir öğesi olduğundan, en düşük oksidasyon durumu -2'dir. Bu değer, K2S - potasyum sülfit formülüne sahip bir bileşiğe karşılık gelir. Cevap: 3.
- Klor atomunun iyonda sahip olduğu oksidasyon durumu +5
- C1O - 4
- C1O -
- C1O - 3
- C1O - 2
Bu görevi yerine getirirken, koşulun elektriksel olarak nötr bileşikler değil, birim negatif yüklü ("-") klor iyonları verdiğine dikkat etmelisiniz. İyondaki atomların yükseltgenme durumlarının toplamı iyonun yüküne eşit olduğundan, istenen iyondaki oksijen atomlarının toplam negatif yükü -6 (+5 - 6 \u003d -1) olmalıdır. Cevap: 3.
- -3 nitrojenin iki bileşiğin her birinde bulunan oksidasyon durumu
- NF 3 VE NH 3
- NH 4 Cl ve N 2 O 3
- NH 4 Cl ve NH 3
- HNO 2 ve NF 3
Doğru cevabı belirlemek için, cevap seçeneklerini zihinsel olarak sol ve sağ alt sütunlara ayırmanız gerekir. Ardından, bileşiklerin daha basit bir bileşime sahip olduğu birini seçin - bizim durumumuzda bu, ikili bileşiklerin sağ alt sütunudur. Oksit ve florürde nitrojen, daha az elektronegatif bir element gibi pozitif bir oksidasyon durumuna sahip olduğundan, analiz 2 ve 4 numaralı cevapların hariç tutulmasına izin verecektir. Bu argüman, içindeki ilk madde aynı nitrojen florür olduğu için cevabı 1 dışlamamıza izin verir. Cevap: 3.
- Maddelere moleküler yapı uygulama
- karbon dioksit
- metan
- hidrojen klorür
- kalsiyum karbonat
Görev koşulunun doğasında bulunan olumsuz yargıya dikkat edilmelidir. Normal koşullar altında gaz halindeki maddeler katı halde bir moleküler kristal kafese sahip olduklarından, 1-3 seçenekleri görev koşulunu karşılamaz. Kalsiyum karbonatın tuzlara atanması doğru cevabı bir kez daha teyit edecektir. Cevap: 4.
- Maddelerin özellikleri ve yapıları hakkında aşağıdaki yargılar doğru mu?
A. Islak çamaşırlar soğukta kurur çünkü moleküler yapıdaki maddeler süblimleşebilir (süblimleşme).
B. Su molekülleri düşük moleküler ağırlığa sahip olduğu için ıslak çamaşır soğukta kurur.
- sadece A doğrudur
- sadece B doğrudur
- her iki yargı da doğru
- her iki yargı da doğru değil
Bilgi fiziksel özellikler Moleküler yapıdaki maddeler, ıslak giysilerin soğukta kurutulmasının sebebinin, su moleküllerinin dipol yapısı değil, buzun süblimleşme yeteneği olduğuna karar vermemizi sağlar. Cevap 1.
- Maddelerin her biri, formülleri dizide verilen moleküler bir yapıya sahiptir.
- CO 2, HNO 3, CaO
- Na 2 S, Br 2, NO 2
- H 2 SO 4, Cu, O 3
- SO 2, I 2, HCl
Önerilen seçeneklerin her biri üç madde içerdiğinden, bu seçeneklerin zihinsel olarak üç dikey sütuna bölünmesi mantıklıdır. Her birinin analizi, daha basit bir bileşime sahip maddelerden (orta sütun) başlayarak, metal kristal kafesi olan bakır metal içerdiğinden 3. cevabı hariç tutmamızı sağlayacaktır. Sağ alt sütunun benzer bir analizi, bir alkalin toprak metal oksit (iyonik kafes) içerdiğinden, cevabı 1'i hariç tutmamıza izin verecektir. Kalan iki seçenekten, bir alkali metal tuzu - sodyum sülfür (iyonik kafes) içerdiğinden seçenek 2 hariç tutulmalıdır. Cevap: 4.
Kendi kendine çalışma ödevleri
- Oksidasyon durumu +5 nitrojen, formülü olan bileşikte sergilenir.
- N 2 O 5
- N 2 O 4
- N 2 O
- Formülü (NH4) 2Cr207 olan bir bileşikte kromun oksidasyon durumu
- Azotun oksidasyon durumu, formülleri olan bir dizi maddede azalır.
- NH 3, NO 2, KNO 3
- N 2 O 4, KNO 2, NH 4 Cl
- N 2, N 2 O, NH 3
- HNO 3, HNO 2, NO 2
- Klorun oksidasyon durumu, formülleri olan birçok maddede artar.
- НСlO, НСlO 4, КСlO 3
- Сl 2, С1 2 O 7, КСlO 3
- Ca (C1O) 2, KClO 3, HClO 4
- КСl, КСlO 3, КСlO
- Moleküldeki en polar kimyasal bağ
- amonyak
- hidrojen sülfit
- hidrojen bromür
- hidrojen florid
- Kovalent polar olmayan bağa sahip madde
- beyaz fosfor
- alüminyum fosfit
- fosfor (V) klorür
- kalsiyum fosfat
- Satırda sadece iyonik bağlara sahip maddeler için formüller yazılır
- sodyum klorür, fosfor (V) klorür, sodyum fosfat
- sodyum oksit, sodyum hidroksit, sodyum peroksit
- karbon disülfür, kalsiyum karbür, kalsiyum oksit
- kalsiyum florür, kalsiyum oksit, kalsiyum klorür
- Atomik kristal kafesi
- sodyum oksit
- kalsiyum oksit
- sülfür (IV) oksit
- alüminyum oksit
- İyonik bağlantı kristal kafes klorun ile etkileşimi ile oluşur
- fosfor
- baryum
- hidrojen
- gri
- Amonyum klorür hakkında aşağıdaki kararlar doğru mu?
A. Amonyum klorür - kovalent polar ve iyonik bağlar nedeniyle oluşan iyonik yapıdaki bir madde.
B. Amonyum klorür iyonik yapıda bir maddedir ve bu nedenle katı, dayanıklı ve uçucu değildir.
- sadece A doğrudur
- sadece B doğrudur
- her iki yargı da doğru
- her iki yargı da yanlış
08. Elektronegatiflik, oksidasyon durumu, oksidasyon ve indirgeme
Kimyada var olan ve bilimde sıklıkla olduğu gibi oldukça kafa karıştırıcı olan ve baş aşağı kullanılan son derece ilginç kavramların anlamını tartışalım. "Elektronegatiflik", "oksidasyon durumu" ve "redoks reaksiyonları" hakkında konuşacağız.
Bu ne anlama geliyor - kavram baş aşağı mı kullanılıyor?
Bunu size yavaş yavaş anlatmaya çalışacağız.
Elektronegatiflik bize bir kimyasal elementin redoks özelliklerini gösterir. Yani bedava foton alma veya verme yeteneği. Ve ayrıca bu elementin bir enerji kaynağı mı yoksa emici mi (eter) olduğu. Yang veya Yin.
Paslanma durumu Elektronegatifliğe benzer bir kavramdır. Aynı zamanda elementin redoks özelliklerini de karakterize eder. Ama aralarında şu fark var.
Elektronegatiflik, tek bir elementin özelliğini verir. Kendi başına, herhangi bir kimyasal bileşiğin bileşiminde bulmanın dışında. Oksidasyon durumu, element bir molekülün parçası olduğunda tam olarak redoks yeteneğini karakterize ederken.
Oksitleme yeteneğinin ne olduğu ve geri yükleme yeteneğinin ne olduğu hakkında biraz konuşalım.
Oksidasyon Serbest fotonların (elektronların) başka bir elemente aktarılması işlemidir. Oksidasyon, artık bilime inandığı gibi, elektronların geri çekilmesi değildir. ... Bir element başka bir elementi oksitlediğinde, asit veya oksijen gibi davranır (dolayısıyla "oksidasyon" adıdır). Oksitlemek, elementlerin yok edilmesini, çürümesini ve yanmasını teşvik etmek anlamına gelir ... Oksitleme yeteneği, moleküllerin kendilerine aktarılan enerji (serbest fotonlar) ile yok olmasına neden olma yeteneğidir. Enerjinin her zaman maddeyi yok ettiğini unutmayın.
Bilimde mantıkta ne kadar zamandır çelişkiler olduğu kimsenin fark etmediği şaşırtıcı.
Örneğin: "Artık bir oksitleyici maddenin elektronları alan bir madde olduğunu ve indirgeyici bir maddenin onları açığa çıkaran bir madde olduğunu biliyoruz" (Genç bir kimyagerin Ansiklopedisi, "Redoks reaksiyonları)".
Ve tam orada, aşağıdaki iki paragraf: "En güçlü oksidan elektrik akımıdır (negatif yüklü elektronların akışı)" (ibid.).
Şunlar. İlk alıntı, oksidanın elektronları kabul eden şey olduğunu ve ikincisinin pes eden oksidan olduğunu söylüyor.
Ve böylesine hatalı, çelişkili sonuçlar sizi okullarda ve enstitülerde ezberletiyor!
En iyi oksitleyici ajanların metal olmayan maddeler olduğu bilinmektedir. Dahası, periyot numarası ne kadar küçük ve grup numarası ne kadar büyükse, oksitleyici maddenin özellikleri o kadar belirgindir. Bu şaşırtıcı değil. Bunun nedenlerini periyodik tablonun analizine adanmış bir makalede nükleonların renginden bahsettiğimiz ikinci bölümde tartıştık. Grup 1'den 8'e, elementlerdeki nükleonların rengi kademeli olarak mordan kırmızıya değişir (d ve f elementlerinin mavi rengini de hesaba katarsak). Sarı ve kırmızı parçacıkların kombinasyonu, biriken serbest fotonların salınmasını kolaylaştırır. Sarılar birikir, ancak zayıf bir şekilde korunur. Kırmızı olanlar etkiye katkıda bulunur. Fotonları yaymak oksidasyon sürecidir. Ancak bazıları kırmızı olduğunda, foton biriktirme kapasitesine sahip parçacıklar yoktur. Bu nedenle 8. grubun elementleri olan asal gazlar, komşularından, halojenlerden farklı olarak oksitleyici maddeler değildir.
Kurtarma Oksidasyona zıt işlemdir. Günümüzde bilimde, bir kimyasal element elektron aldığında azaldığına inanılmaktadır. Bu bakış açısı oldukça anlaşılabilir (ancak kabul edilmedi). Kimyasal elementlerin yapısını incelerken, elektron yaydıkları bulundu. Elektronların elementlerin bir parçası olduğu sonucuna vardılar. Bu, elektronların bir elemente transferinin, onun kayıp yapısının bir tür restorasyonu olduğu anlamına gelir.
Ancak gerçekte durum böyle değil.
Elektronlar özgür fotonlardır. Onlar nükleon değiller. Elementin gövdesinin bir parçası değildirler. Çekilirler, dışarıdan gelirler ve nükleonların yüzeyinde ve aralarında birikirler. Ancak bunların birikmesi, bir elementin veya molekülün yapısının restorasyonuna hiçbir şekilde yol açmaz. Aksine, yaydıkları eter (enerji) ile bu fotonlar, elementler arasındaki bağları zayıflatır ve yok eder. Ve bu bir oksidasyon sürecidir, ancak bir indirgeme değildir.
Bir molekülü eski haline getirmek, gerçekte, ondan enerji almaktır (bu durumda, serbest fotonlar) ve iletişim kurmak değil. İndirgeyici eleman foton alarak maddeyi yoğunlaştırır - geri yükler.
En iyi indirgeyici maddeler metallerdir. Bu özellik, doğal olarak kalitatif ve kantitatif bileşiminden kaynaklanır - Çekim Alanları en büyüktür ve yüzeyde her zaman çok veya yeterli parçacık vardır. mavi renk.
Aşağıdaki metal tanımını bile çıkarabilirsiniz.
Metal Yüzey katmanları mavi parçacıklar içermesi gereken kimyasal bir elementtir.
Bir metal olmayan - Bu, mavi fotonların olmadığı veya neredeyse hiç olmadığı yüzey katmanlarının bileşiminde bulunan ve her zaman kırmızı olanların bulunduğu bir elementtir.
Güçlü çekiciliğe sahip metaller, elektronları mükemmel şekilde uzaklaştırır. Ve böylece onlar onarıcıdır.
Kimya ders kitaplarında bulunabilecek "elektronegatiflik", "oksidasyon durumu", "redoks reaksiyonları" kavramlarının bir tanımını verelim.
« Paslanma durumu - Bir bileşikteki bir atomun, yalnızca iyonlardan oluştuğu varsayımıyla hesaplanan koşullu yükü. Bu kavramı tanımlarken, geleneksel olarak bağ (değerlik) elektronlarının daha elektronegatif atomlara aktarıldığı ve bu nedenle bileşiklerin, olduğu gibi, pozitif ve negatif yüklü iyonlardan oluştuğu varsayılır. Oksidasyon durumu sıfır, negatif veya pozitif olabilir ve bu genellikle en üstteki element sembolünün üstüne yerleştirilir.
Oksidasyon durumunun sıfır değeri, serbest durumda olan elementlerin atomlarına atfedilir ... Oksidasyon durumunun negatif bir değeri, bağ elektron bulutunun (elektron çifti) yer değiştirdiği atomlara sahiptir. Tüm bileşiklerindeki flor için -1'dir. Diğer atomlara değerlik elektronları bağışlayan atomlar, pozitif bir oksidasyon durumuna sahiptir. Örneğin, alkali ve toprak alkali metaller için sırasıyla +1 ve +2'dir. Basit iyonlarda iyonun yüküne eşittir. Çoğu bileşikte, hidrojen atomlarının oksidasyon durumu + 1'dir, ancak metal hidritlerde (hidrojen ile bileşikleri) ve diğerlerinde –1'dir. Oksijen için oksidasyon durumu -2'dir, ancak örneğin flor ile kombinasyon halinde +2 ve peroksit bileşiklerinde -1 olacaktır. ...
Bir bileşikteki atomların oksidasyon durumlarının cebirsel toplamı sıfırdır ve karmaşık bir iyonda iyonun yüküdür. ...
En yüksek oksidasyon durumu, en yüksek pozitif değeridir. Çoğu element için, periyodik sistemdeki grup sayısına eşittir ve bileşiklerindeki bir elementin önemli bir nicel karakteristiğidir. Bileşiklerinde oluşan bir elementin oksidasyon durumunun en küçük değerine genellikle en düşük oksidasyon durumu denir; geri kalan her şey orta düzeydedir ”(Ansiklopedik Sözlüğü Genç Kimyager, makale“ Oksidasyon Durumu ”).
İşte bu konseptle ilgili temel bilgiler. Başka bir terim olan elektronegatiflik ile yakından ilgilidir.
« Elektronegatiflik - bu, bir molekül içindeki bir atomun kimyasal bir bağ oluşumunda rol oynayan elektronları çekme yeteneğidir ”(Encyclopedic Dictionary of a Young Kimyager, makale“ Elektronegativite ”).
“Redoks reaksiyonlarına, reaktiflerden birinin (indirgeyici ajan) atomundan diğerinin atomuna elektronların hareketinin bir sonucu olarak, reaktanları oluşturan atomların oksidasyon durumundaki bir değişiklik eşlik eder. Oksidasyon-indirgeme reaksiyonları aynı anda oksidasyon (elektronların salımı) ve indirgeme (elektronların eklenmesi) meydana getirir "(Chemical Encyclopedic Dictionary, ed. IL Knunyants, makale" Redoks reaksiyonları ").
Bize göre, bu üç kavramda gizli birçok hata var.
Başta , iki element arasında kimyasal bir bağ oluşmasının, elektronlarını sosyalleştirme süreci olmadığına inanıyoruz. Kimyasal bağ, yerçekimsel bir bağdır. Çekirdeğin etrafında uçtuğu varsayılan elektronlar, bir elementin gövdesi içinde ve aralarında nükleonların yüzeyinde biriken serbest fotonlardır. İki element arasında bir bağlantı oluşması için, serbest fotonlarının elementler arasında katlanmasına gerek yoktur. Bu gerçekleşmiyor. Gerçekte, daha ağır olan element, serbest fotonları daha hafif olandan uzaklaştırır (çeker) ve onları (daha doğrusu kendi başına) tutar. Ve bu fotonların çıkarıldığı daha hafif element bölgesi, az çok çıplak hale gelir. Bu bölgedeki çekiciliğin daha büyük ölçüde ortaya çıkması nedeniyle. Ve daha hafif olan element, ağır olanı çeker. Kimyasal bir bağ bu şekilde ortaya çıkar.
İkincisi Modern kimya, elementlerin elektronları kendilerine çekebilme yeteneğini çarpıtılmış olarak görüyor. Bir elementin elektronegatifliği ne kadar yüksekse, elektronları kendisine o kadar çok çekebildiğine inanılmaktadır. Flor ve oksijen sözde en iyisini yapıyor - diğer insanların elektronlarını çekiyorlar. 6 ve 7 grubun diğer unsurlarının yanı sıra.
Aslında bu görüş bir yanılsamadan başka bir şey değildir. Grup sayısı ne kadar büyükse, elementlerin o kadar ağır olduğu yanılgısına dayanmaktadır. Ve ayrıca, çekirdeğin pozitif yükü ne kadar büyükse. Bu saçmalık. Bilim adamları, kendi bakış açılarına göre neyin bir "suç" olduğunu açıklama zahmetine bile girmiyorlar. Basitçe, numerolojide olduğu gibi, tüm unsurları sırayla saydılar ve sayıya göre şarj miktarını belirlediler. Harika yürüyüş!
Çocuk için gazın yoğun metalden daha hafif olduğu da açıktır. Kimyada gazların elektronları kendilerine çekmede daha iyi olduğuna nasıl inanılmaktadır?
Tabii ki yoğun metaller elektronları çekmede daha iyidirler.
Elbette kimya bilimcileri, çok yaygın olduğu için "elektronegatiflik" kavramını kullanımda bırakabilirler. Bununla birlikte, anlamını tam tersi şekilde değiştirmek zorunda kalacaklar.
Elektronegatiflik Bir moleküldeki kimyasal elementin elektronları kendine çekme yeteneğidir. Ve doğal olarak metaller bu kabiliyete metal olmayanlardan daha iyi sahiptir.
Moleküldeki elektrik kutuplarına gelince, aslında, negatif kutup - bunlar, daha düşük Çekim Alanlarıyla elektron bağışlayan metal olmayan elementlerdir. Bir pozitif - bunlar her zaman daha belirgin metalik özelliklere ve geniş çekim alanlarına sahip unsurlardır.
Birlikte gülümseyelim.
Elektronegatiflik - bu, bir kimyasal elementin kalitesini mevcut kütle ve yük ile birlikte tanımlamaya yönelik başka bir girişimdir. Sık sık olduğu gibi, başka bir bilim dalından bilim adamları, bu durumda kimya, sanki fizikçilerine güvenmiyormuş gibi, daha çok basitçe keşif yapan herhangi bir kişi kendi yoluna gidiyor ve sadece başkalarının deneyimlerini keşfetmekle kalmıyor.
Bu sefer de oldu.
Kütle ve yük, kimyagerlerin birbirleriyle etkileşime girdiklerinde atomlarda neler olduğunu anlamalarına yardımcı olmak için hiçbir şey yapmadı - ve elektronegatiflik ortaya çıktı - bir elementin kimyasal bir bağ oluşumunda yer alan elektronları çekme yeteneği. Bu kavram fikrinin oldukça doğru bir şekilde ortaya konulduğu kabul edilmelidir. Gerçeği baş aşağı yansıtan tek değişiklikle. Daha önce de söylediğimiz gibi, yüzey nükleonlarının renginin özelliklerinden dolayı elektronları metallere değil metallere çekmek en iyisidir. Metaller en iyi indirgeyici maddelerdir. Metal olmayanlar oksitleyici ajanlardır. Metaller alınır, metal olmayanlar verilir. Metaller - Yin, metal olmayan - Yang.
Ezoterizm, Doğanın sırlarını anlama meselelerinde bilimin yardımına gelir.
İlgili paslanma durumu , o zaman bu, serbest elektronların dağılımının bir kimyasal bileşik - bir molekül içinde nasıl gerçekleştiğini anlamak için iyi bir girişimdir.
Bir kimyasal bileşik homojen ise - yani basitse, yapısı aynı türden elementlerden oluşuyorsa - o zaman her şey doğrudur, aslında, bileşikteki herhangi bir elementin oksidasyon durumu sıfırdır. Bu bileşiğin oksitleyici maddeleri ve indirgeyici maddeleri olmadığı için. Ve tüm unsurlar eşit kalitede. Kimse elektronları alıp götürmez, kimse vermez. Yoğun bir madde, sıvı veya gaz olması fark etmez.
Oksidasyon durumu, elektronegatiflik gibi, bir kimyasal elementin kalitesini gösterir - yalnızca bir kimyasal element çerçevesinde. Oksidasyon durumu, bileşikteki kimyasal elementlerin kalitesini karşılaştırmak için tasarlanmıştır. Bize göre fikir iyidir, ancak uygulanması tamamen tatmin edici değildir.
Kimyasal elementlerin yapısı ve aralarındaki bağların tüm teori ve kavramına kategorik olarak karşıyız. Peki, fikirlerimize göre grup sayısının 8'den fazla olması gerektiği için olsaydı, bu tüm sistemin çöktüğü anlamına geliyor. Ve sadece bu değil. Genel olarak, atomlardaki elektron sayısını "bir yandan" saymak bir şekilde ciddi değildir.
Mevcut konsepte uygun olarak, en küçük geleneksel yüklerin en güçlü oksidanlara atandığı ortaya çıktı - florin tüm bileşiklerde -1 yükü vardır, oksijen neredeyse her yerde -2'dir. Ve çok aktif metaller için - alkali ve alkali toprak - bu yükler sırasıyla +1 ve +2'dir. Hiç mantıklı değil. Yinelememize rağmen, bunun yapıldığı genel şemayı çok iyi anlıyoruz - hepsi tablodaki 8 grup ve dış enerji seviyesinde 8 elektron uğruna.
Asgari olarak, halojenler ve oksijen için bu yüklerin değeri, eksi işaretiyle en büyüğü olmalıdır. Alkali ve toprak alkali metallerde de büyüktür, sadece artı işaretiyle.
Herhangi birinde kimyasal bileşik elektron bağışlayan elementler vardır - oksitleyiciler, metal olmayanlar, negatif yük ve elektron veren elementler - redüktörler, metaller, pozitif yük. Bu şekilde elementleri karşılaştırmak, birbirleriyle ilişkilendirmek ve oksidasyon durumlarını belirlemeye çalışmak.
Bununla birlikte, bu şekilde bulmak için oksidasyon durumu, bize göre, gerçeği tam olarak tam olarak yansıtmamaktadır. Bir moleküldeki elementlerin elektronegatifliğini karşılaştırmak daha doğru olacaktır. Sonuçta, elektronegatiflik, oksidasyon durumuyla hemen hemen aynıdır (yalnızca tek bir elementin kalitesini karakterize eder).
Elektronegatiflik ölçeğini alabilir ve değerlerini her bir element için formülde yazabilirsiniz. Ve sonra hangi elementlerin elektronları bıraktığı ve hangilerinin ellerinden aldığı hemen görülecektir. Bileşikteki elektronegatifliği en büyük olan element - negatif kutup, elektronları bağışlar. Ve elektronegatifliği en küçük olan - pozitif kutup, elektronları alır.
Bir molekülde örneğin 3 veya 4 element varsa, hiçbir şey değişmez. Ayrıca elektronegatiflik değerlerini koyar ve karşılaştırırız.
Bununla birlikte, molekül yapısının bir modelini çizmeyi unutmamalısınız. Aslında, herhangi bir bileşikte, basit değilse, yani bir tür elementten oluşmuyorsa, her şeyden önce metaller ve metal olmayanlar birbirine bağlanır. Metaller, metal olmayanlardan elektron alır ve onlara bağlanır. Ve metal olmayan bir elementten elektronlar, daha belirgin metalik özelliklere sahip 2 veya daha fazla elementten aynı anda alınabilir. Karmaşık, karmaşık bir molekül bu şekilde ortaya çıkar. Ancak bu, böyle bir molekülde metal elementlerin birbirleriyle güçlü bir bağ kuracağı anlamına gelmez. Belki de birbirlerinin zıt taraflarında yer alacaklar. Bir dahaki sefere çekilecekler. Ancak güçlü bir bağ, yalnızca bir element diğerinden daha metalik ise oluşur. Bir elementin elektronları seçmesi - onları uzaklaştırması zorunludur. Aksi takdirde, element açığa çıkmayacaktır - yüzeydeki serbest fotonlardan kurtulma. Çekim Alanı tam olarak tezahür etmeyecek ve güçlü bir bağlantı olmayacak. o karmaşık konu - Eğitim kimyasal bağlarve bu yazıda bununla ilgili ayrıntıya girmeyeceğiz.
"Elektronegatiflik", "oksidasyon durumu", "oksidasyon" ve "indirgeme" kavramlarının analizine ayrılmış konuyu yeterince ayrıntılı olarak ele aldığımıza ve size birçok ilginç bilgi verdiğimize inanıyoruz.
Rehberli Düşler kitabından yazar Mir ElenaRestorasyon “Bireyselleşmenin Tek İşareti doğduğunda, öz ve yaşam ikiye ayrılır. Şu andan itibaren, nihai barışa ulaşılmadıkça, öz ve yaşam bir daha asla birbirini görmeyecek. " William, "Altın Çiçeğin Sırrı" Üniversiteden sonra
Sırlar Kitabı'ndan. Dünya ve ötesinde inanılmaz aşikar yazar Vyatkin Arkady DmitrievichAşırı derecede gönüllü vampirizm olarak mazoşizm Bu anlamda mazoşizm, karşılıklı bağımlılığa benzer. Mazoşistler, kendi fiziksel ve zihinsel acılarından hoş duygular alan kişilerdir. Başka bir deyişle, dövülmeyi, azarlanmayı, zorbalığa uğramayı severler.
Rusya'daki Vampirler kitabından. Onlar hakkında bilmeniz gereken her şey! yazar Bauer AlexanderKan Kaybı Düzeyi Nasıl Belirlenir Bir vampir kan içtiğinde, bir seferde yarım litreden bir buçuk litreye kadar kan içer. İnsan vücudunda yalnızca beş ila altı litre kan vardır, bu nedenle bu tür kan kaybının yaşamı tehdit etmesi gerekmez. Ancak bir vampir
Bir Rüyada Geleceği Modellemek kitabından yazar Mir Elenaİyileşme Mezun olduktan sonra kapalı bir işletmede mühendis olarak çalışarak benim yerimde olmadığımı fark ettim ve mesleğimi değiştirmeye karar verdim ve doğaçlama caz okuluna, ardından müzik okulunun klasik bölümüne girdim.
Feng Shui'nin Altın Kuralları kitabından. Başarı, esenlik ve uzun ömürlülük için 10 kolay adım yazar Ogudin Valentin LeonidovichDış nesnelerin olumsuz etki derecesi Dış nesneler, doğrudan evin girişinin önünde olmak üzere en büyük olumsuz etkiye sahiptir. Ancak girişe ne kadar açılı yerleştirilirlerse, etkileri o kadar zayıflar.
yazar Shure EduardBirinci derece: Yemek pişirme. Dağdaki Vaaz ve Tanrı Mesih'in Krallığı'nın çalışması, bir Celileli idil ve "Tanrı'nın krallığının" duyurulmasıyla başlar. Bu tahmin bizi onun popüler öğretilerine işaret ediyor. Aynı zamanda daha yüce bir hazırlıktır.
İlahi Evrim kitabından. Sfenks'ten Mesih'e yazar Shure Eduardİkinci başlama derecesi (saflaştırma). Mucizevi şifalar. Hristiyan terapisi Tüm eski gizemlerde, ahlaki ve entelektüel hazırlığı, ruhun arındırılması izledi, bu da ruhun içinde yeni organları canlandırması ve ardından ona yetenek kazandırması
Büyük Sfenks'in Bilmecesi kitabından yazar Barbaren GeorgesHeykelin Restorasyonu Büyük Sfenks'in gerçek yaşı, dem döneminin başlangıcına dayanmaktadır. En azından, göreceğimiz gibi topluluğu kendisiyle tamamladığı piramitlerin çağdaşıdır.Büyük Sfenks'in görüntüsü, geçtiğimiz yüzyıllarda ortaya çıkmıştır.
Ruhu İyileştirme kitabından. 100 meditasyon tekniği, iyileştirici egzersizler ve rahatlama yazar Rajneesh Bhagwan ShriRitmi eski haline getirmek ... Yatağa gitmek için aynı zamanı ayarlayın - eğer her akşam saat on bir, sonra on bir ... Bu ilk: belirli bir saatte başlayın ve yakında vücut bu ritme girebilecektir. Bu sefer değiştirmeyin, aksi takdirde bedeni karıştırırsınız. Vücut
yazar Kuzmishin E.L.Çıraklık Derecesine Çıraklık Kabulü Kutu ve cüppe süslemesi Kutunun duvarları ve tavanı yaldızsız mavi beyaz bezle asılmalıdır. Tapan Efendinin başının üstünde, ortasında adı yazılı olan ve ışıltıyla çevrili bir üçgen var.
Cagliostro ve Mısır Masonluğu kitabından yazar Kuzmishin E.L.Köşk ve Mezarlıklar Çırak Süsleme Derecesine Giriş Locanın duvarları ve tavanı yaldızsız mavi beyaz bezle asılacaktır. Saygıdeğer Üstad'ın başının üstünde, ortasında "Yehova" adının yazılı olduğu ışıltıyla çevrili bir üçgen vardır.
Bir Yoginin Otobiyografisi kitabından yazar Yogananda ParamahansaBölüm 23 Üniversite Derecesi Alıyorum - Ders kitabınızın felsefi tanımlarını görmezden geliyorsunuz, şüphesiz sınavlar boyunca size rehberlik edecek bazı "sezgiler" e güveniyorsunuz. Ama acilen daha bilimsel bir yönteme dönmezseniz, o zaman ben
Kabala kitabından. Üst dünya. Yolun başlangıcı yazar Laitman Michael7.5. Kötülüğün Gerçekleşme Derecesi “Tevrat Verme” başlıklı makalede anlatıldığı gibi, zevk ve mutluluk, özelliklerde Yaradan'a benzerlik derecesi ile belirlenirken, acı ve sabırsızlık Yaradan'dan farklılığın derecesi ile belirlenir. Buna göre, bencillik bize iğrenç ve dayanılmaz derecede acı vericidir.
seçenek 1
1. Aşağıdaki bileşiklerdeki kimyasal elementlerin atomlarının oksidasyon durumunu belirleyin: HNO₃, NO₂, H₃N, SO₂, N₂O.
2. Periyodik tabloyu kullanarak, elektronegatifliği azaltma sırasına göre aşağıdaki öğeleri düzenleyin: O, N, Be, B, Li, C. Florin ve sodyumun bu sırada nerede olması gerektiğini belirleyin. Cevabı açıklayın. 
3. SO₂'nin SO₃'ya oksidasyonu sırasında bir sülfür atomunun oksidasyon durumu nasıl değişir? Cevabı açıklayın.
seçenek 2
1. Aşağıdaki bileşiklerdeki kimyasal elementlerin atomlarının oksidasyon durumunu belirleyin: CO₂, H₃PO₄, SiH₄, P₂O₅, Mg₂Si.
2. Genel kimyasal elementi olan atomlar yönünde elektronik çiftleraşağıdaki bileşiklerin moleküllerinde: BF₃, PCl₃, CS₂, CCl₄, HBr? Gerekçeli bir cevap verin.
3. Oluşum sırasında karbonun oksidasyon durumu değişir mi karbonik asit Karbon dioksit ve sudan H₂CO₃? Cevabı açıklayın.
3. Seçenek
1. Aşağıdaki bileşiklerdeki kimyasal elementlerin atomlarının oksidasyon durumunu belirleyin: Cl₂, NaClO, CaCl₂, HF, SO₃, Cl₂O₇.
2. kullanma periyodik sistem kimyasal elementler, elektronegatifliklerinin artan sırasına göre aşağıdaki elementleri düzenler: P, Al, Cl, Na, S, Mg. Bu sırada potasyum ve florür için bir yer bulun. Cevabı açıklayın. 
3. Metan CH мет'nin yanması üzerine karbon monoksit (IV) ve su oluşumu ile karbonun oksidasyon durumu nasıl değişir? Cevabı açıklayın.
4. seçenek
1. Aşağıdaki bileşiklerdeki kimyasal elementlerin atomlarının oksidasyon durumunu belirleyin: H₂SO₄, SO₂, NO₂, BF₃, H₂S.
2. Neyin atomlarına doğru kimyasal elementler Ortak elektron çiftleri, aşağıdaki bileşiklerin moleküllerinde yer değiştirir: H₂O, PCl₃, H₃N, H₂S, CO₂? Gerekçeli bir cevap verin.
3. Atomların yükseltgenme durumları, suyun basit maddeler - hidrojen ve oksijen? Cevabı açıklayın.


