





















 Rudi mbele
Rudi mbele
ATTENTION! Slides ya hakikisho hutumiwa tu kwa madhumuni ya habari na inaweza kutoa mawazo juu ya uwezo wote wa kuwasilisha. Ikiwa una nia ya kazi hii, tafadhali pakua toleo kamili.
Lengo. somo:
- Elimu. - Sababu lengo unahitaji kujifunza nyenzo mpya, kuchangia kwa ujuzi wa ujuzi juu ya mada "Aina kemikali Bond.", Kuanzisha wanafunzi wenye dhana:" Wanandoa wa Jumuiya ya Kufunga Electronic "," uhusiano wa kemikali "; Kurudia na kuimarisha dhana: "Umeme", "hali endelevu ya atomi", "kukamilika kwa kiwango cha nishati ya nje".
- Kuendeleza - Ili kuunda uwezo wa kuanzisha mahusiano ya causal, kuimarisha vifaa, kutekeleza hitimisho juu ya mada; Kukuza maendeleo ya kufikiri, ujuzi na ujuzi wa kawaida.
- Elimu - Kuunda mtazamo wa dhamiri kuelekea kazi ya kujifunza, msukumo mzuri kwa ujuzi, ujuzi wa mawasiliano; Ili kuwashawishi haja ya kuvutia sayansi ya kemia kuelewa na kuelezea taratibu kwenda ulimwenguni.
Njia: kuzaa, kutafuta sehemu.
Fomu ya malezi: Sensual (hotuba), kuona, kutatua tatizo, utafiti wa mbele, kazi ya kujitegemea.
Njia za Elimu:
- elimu na Nyenzo: Reagents kemikali, Kompyuta, Projector, Vitabu, TSO;
- didactico-Methodical: Lugha ya Kemikali, Jaribio la Kemikali, Vifaa vya Didactic;
- kisaikolojia na mafundisho: Kazi ya habari (maswali, vipimo, algorithms).
Fomu ya shirika la kazi katika darasani: Mtu binafsi, mbele.
Somo la Muda:
- Hatua ya Shirika - 1 min.
- Kuendeleza ujuzi. Kuweka madhumuni na kazi za somo. - 7 min.
- Kujifunza nyenzo mpya.Kuzingatia ujuzi mpya na njia za hatua - 23 min.
- Kufunga vifaa vya habari.Upimaji wa msingi wa uelewa - dakika 8.
- Kutafakari na kuhesabu juu- 4 min.
- Kazi ya nyumbani - dakika 2.
Somo hili linaweza kutumika kwa wanafunzi wa madarasa 8 wakati wa kusoma mada "Mawasiliano ya kemikali", kwa wanafunzi wa daraja la 9 kama kurudia kabla ya kujifunza "discociation electrolytic", katika madarasa 10 na 11 ya kuimarisha ujuzi juu ya mada "Kemikali ya Mawasiliano" . Kwa wanafunzi, abstracts hutolewa kwa somo ( kiambatisho 1.) Kujaza somo katika mchakato, katika abstract ni kazi ya nyumbani. Hifadhi ya kukamilika na kazi ya nyumbani imefanya ni kupasuliwa katika somo linalofuata na linatathminiwa.
Wakati wa madarasa.
I. Hatua ya Shirika.
II. Kuendeleza ujuzi. Kuweka madhumuni na kazi za somo.
Katika hatua ya kuendeleza ujuzi, wanafunzi kukumbuka muundo wa atomi na muundo wa shell ya umeme ya atomi, mabadiliko katika mali ya atomi katika mfumo wa vipengele mara kwa mara, dhana ya electronegativity.
Kulingana na mawazo ya kisasa. mawasiliano ya kemikali. kati ya atomi ina hali ya umeme. Chini ya dhamana ya kemikali kuelewa vikosi vya umeme vya kivutio, na kufanya chembe za kila mmoja. Vipande vinavyoshiriki katika malezi ya vifungo vya kemikali vinaweza kuwa atomi, molekuli au ions. Kwa hiyo, kurudia kwa dhana ya electronegativity ni muhimu sana. Kwenye The. slide ya pili Maswali ambayo yanapaswa kujibiwa
- Ni nini utajiri wa umeme?
- Kwa kitengo kilichopitishwa umeme ambacho kipengele?
- Ni kipengele gani kilicho na Electronenence kubwa?
- Jinsi ya kusema mambo kwa metali na yasiyo ya metali na electronegativity?
- Jinsi thamani ya electronegability inabadilishwa juu ya meza ya vipengele d.I. Mendeleev? (Kiambatisho 2, majibu).
Katika maswali ya maswali ya madai ya majibu ya wanafunzi.
I.II.. Kujifunza nyenzo mpya.
Elimu. misombo ya kemikali Kutokana na tukio la dhamana ya kemikali kati ya atomi katika molekuli na fuwele.
Kemikali Bond ni kushikamana kwa atomi katika molekuli na lattice kioo kama matokeo ya hatua kati ya atomi ya vikosi vya kivutio vya umeme.
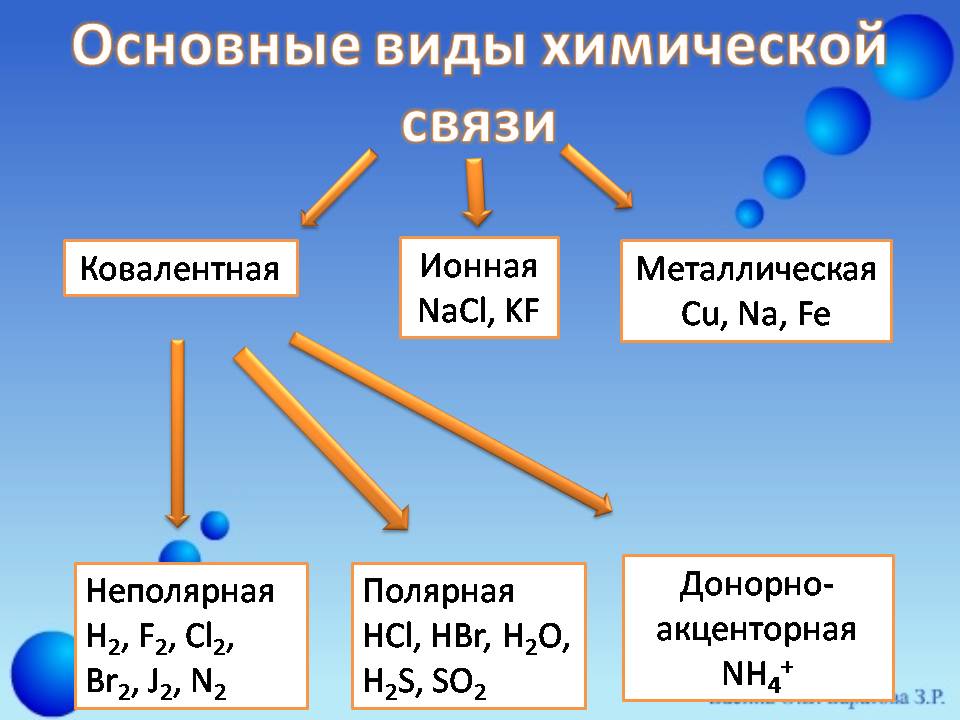
Aina tatu za vifungo vya kemikali zinajulikana: couvavarent, ionic, metali (Slide 3) .
- Mawasiliano ya Covalent. (mawasiliano ya Atomic., Mawasiliano ya Homepolar) - Kemikali Bond iliyoundwa na kuingiliana (jamii) michache ya valence elektroniki mawingu. Mawasiliano inayotokana kati ya atomi ya vipengele ambao umeme huo ni sawa au tofauti, lakini sio sana.
- Mawasiliano ya Ion. - Bond ya kemikali kati ya atomi ya vipengele, electronegativity, ambayo ni tofauti sana na mazingira ya elektroni ya kutosha yanapatikana kwa mabadiliko ya jumla ya jumla ya wiani wa elektroni kwa atomi ya kipengele cha electronegative zaidi.
- Mawasiliano ya Metal. - Kemikali Bond, ambayo ni kutokana na mwingiliano wa ions chanya chuma ni crystal Lattice., na gesi ya elektroniki kutoka kwa elektroni za valence.
Mawasiliano ya Covalent. (Slide 4.).
Katika neno "covalent" kiambishi "KO-" inamaanisha "ushiriki wa pamoja." Na "Valentine" ilitafsiriwa katika uwezo wa Kirusi - nguvu, uwezo. Katika kesi hiyo, ina maana katika akili uwezo wa atomi kushikamana na atomi nyingine. Bond covalent ni sumu kutokana na jozi ujumla elektroniki inayotokea katika shells ya atomi kuhusishwa.
Wakati dhamana ya msingi imeundwa, atomi huchanganya elektroni zao kama ilivyokuwa, kwa kawaida "benki ya nguruwe" - molekuli orbital.Ambayo huundwa kutoka kwenye shells ya atomiki ya atomi za mtu binafsi. Shell hii mpya ina imekamilika Idadi ya elektroni na inachukua nafasi ya atomi za shell zao za atomiki zisizokwisha.
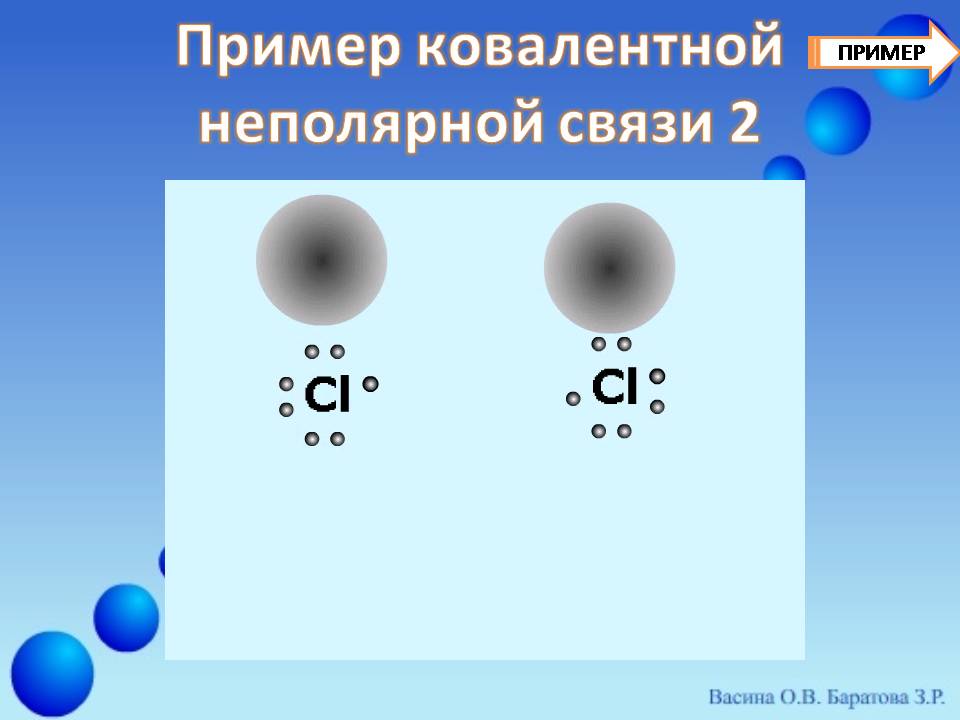
- Mawasiliano ya kemikali ya covalent. inaweza kuundwa na atomi ya kipengele hicho (electronegability ya atomi ni sawa.Na kisha yeye notolar. (Slide 5.) . Bond kama hiyo imezingatiwa katika elimu. dutu rahisi - Nemmetalov: H 2., Cl 2., N 2., O 2. na nk.
- Mawasiliano ya kemikali ya covalent.sumu na atomi ya vipengele tofauti ambazo electronegativity ni tofauti kidogo polar. (Slide 6). Kesi hii ni ya kawaida katika malezi ya molekuli: H 2.O., HCl., Ch 4., NH 3. na nk.
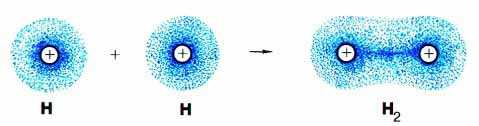
Fikiria tukio la dhamana ya msingi juu ya mfano wa malezi ya molekuli ya hidrojeni ya atomi mbili za hidrojeni (Slide 7, tini.1) .

Kielelezo. 1. Tukio la dhamana ya msingi katika malezi ya molekuli ya hidrojeni ya atomi mbili za hidrojeni. Vipande vya umeme vya atomi za hidrojeni (na s-elektroni moja katika kila atomi) kuunganisha katika wingu wa umeme (molekuli orbital), ambapo elektroni zote ni "kutumikia" nuclei, bila kujali kama ni kernel au "mgeni".
Wakati shells za umeme za atomi mbili za hidrojeni zinakuja karibu na kuunda mpya, sasa molecular.shell ya umeme (Kielelezo 1), shell hii mpya ni kama imekamilika atomi ya shell ya umeme ya heliamu ya gesi yenye heshima ( 1S 2.). Katika mfumo huo wa atomi mbili za hidrojeni, kila kernel hutumiwa na elektroni mbili. Katika shell mpya (molekuli), haiwezekani kutofautisha ambayo elektroni hapo awali ilikuwa ya hii au atomi nyingine. Ni desturi ya kusema kwamba elektroni. jumuiya ya Madola.
Kwa kuwa cores zote zinadai jozi la elektroni shahada sawaUzito wa umeme hujilimbikizia pande zote karibu na nuclei na katika nafasi kati ya atomi (hii inavyoonyeshwa kwenye tini2). Ni eneo hili la wiani wa juu wa elektroni kati ya nuclei na inaitwa tie imara .
Kielelezo. 2. Njia nyingine ya picha ya atomiki na molekuli: unene wa pointi huonyesha "wiani wa elektroni", yaani, uwezekano wa kupata elektroni wakati wowote wa nafasi karibu na nuclei ya atomi za hidrojeni. Inaweza kuonekana kuwa wiani mkubwa wa elektroni hujilimbikizia nafasi kati ya nuclei mbili katika molekuli ya hidrojeni.
Katika takwimu 1 na 2, unaona picha ya kina ya dhamana ya msingi. Katika mazoezi, tumia zaidi njia rahisi. Kwa mfano, chemist ya Marekani J. Lewis mwaka wa 1916 alipendekeza kuashiria elektroni points. Karibu na alama za vipengele. Hatua moja inaashiria elektroni moja. Katika kesi hiyo, malezi ya molekuli ya hidrojeni kutoka kwa atomi imeandikwa kama ifuatavyo:
Mfumo wa miundo
Ilibadilika kuwa formula ya Lewis ina maana ya kina ya kemikali. Tunaona kwamba uhusiano kati ya atomi za hidrojeni unaonyeshwa na elektroni. Kama Lewis alipendekeza, ni jozi ya elektroni. Inakuwezesha kuunda uhusiano mzuri. Baadaye, dhana hii imethibitishwa na nadharia ya quantum. Formula na dashes kati ya atomi huitwa. formula za miundo.
Bond covalent inaitwa kumfunga kwa atomi kwa msaada wa jumla (umegawanyika kati yao) jozi za elektroniki.
Fikiria kumfunga kwa atomi mbili za klorini 17 CL. (Slide 8) (Malipo ya kiini z \u003d 17) ndani ya molekuli ya ductomic kutoka nafasi ya muundo wa shells za elektroniki za klorini. Ili kufanya hivyo, weka formula ya elektroniki kwa atomi ya klorini na usanidi wa shell yake ya nje ya umeme:
majibu ya mwanafunzi
Mwalimu.: Idadi ya elektroni kwenye ngazi ya nje?
Mwanafunzi: Katika klorini ya nje ya elektroni ina 2S + 5P \u003d 7 elektroni.
Mwalimu: Kwa kuwa elektroni za kiwango cha chini hazishiriki katika mwingiliano wa kemikali, pointi ambazo tumeelezea elektroni tu ya njeNgazi ya tatu.. Elektroni hizi za nje (vipande 7) vinaweza kuwekwa kwa namna ya jozi tatu za elektroniki na elektroni moja isiyo na uwezo.
Baada ya kuchanganya atomi katika molekuli ya elektroni mbili zisizofaa za atomi, jozi mpya ya elektroniki inapatikana:

Kwa kuongeza, kila atomi za klorini zinageuka kuwa zimezungukwa Octet. elektroni. Hii inathibitishwa kwa urahisi ikiwa unavunja kupitia mug wa atomi yoyote ya klorini. Sura ya mwisho ni formula ya kimuundo ambayo. para ya Mungu Electroni zinaashiria na dash.
Bond Covalent Fomu tu jozi ya elektroni kati ya atomi. Inaitwa. mgawanyiko wa jozi (kumfunga) . Jozi iliyobaki ya elektroni huitwa. wanandoa mchanganyiko . Wanajaza shells na hawashiriki katika kumfunga.
Lewis sio tu alipendekeza nadharia ya dhamana ya msingi, lakini pia wa kwanza kuunda utawala wa okatet-dublet. Sheria hii kama inatumika kwa vifungo vya kemikali inaweza kuandaliwa kama ifuatavyo:
atomi hufanya vifungo vya kemikali kama matokeo ya ushirikiano wa elektroni kama hiyo ili kupata usanidi wa elektroniki sawa na usanidi wa kumaliza umeme wa atomi za gesi zenye heshima.
Atomi mbili za hidrojeni, kuunganisha katika molekuli, zilizopatikana "Imekamilishwa" molecular. Shell.Sawa na shell iliyokamilishwa ya umeme aTOM Gelia Gesi yenye heshima (1s 2). Atomi za klorini katika molekuli kununuliwa molecular.shell sawa na shell iliyokamilishwa aTOM Argon. (... 3s 2 3p 6).
Uunganisho kati ya atomi unaweza kufanyika sio lazima moja, lakini pia mbili Na hata tatu.wanandoa waliogawanyika kama hii inahitaji utawala wa octet. Uunganisho huo unaitwa. mara mbili Na mara tatu. Fikiria kuundwa kwa mawasiliano kwa molekuli ya oksijeni na nitrojeni.
Kutoa usanidi wa elektroniki kwa atomi ya oksijeni, usambazaji wa elektroni na seli za quantum, zinaonyesha jinsi ngapi elektroni katika ngazi ya mwisho ya elektroni, ni kiasi gani maana
jibu la mwanafunzii 1S 2 2S 2 2P 4 +8 O.
![]()
Katika ngazi ya nje ya elektroni 6 elektroni, jozi tatu zisizo na maana.
Mwalimu.: Hivyo, oksijeni inayozingatiwa na sisi inaweza kuunda molekuli ya awamu mbili na octet ya elektroni katika kila atomi tu wakati jozi mbili zilizogawanyika zinawekwa kati ya atomi (Slide 9) :

Na kwa atomi ya nitrojeni, kuleta usanidi wa umeme, na usambazaji kuu wa elektroni na seli za quantum
jibu la mwanafunzii 1S 2 2S 2 2P 3 +7 N.

Mwalimu: atomi za nitrojeni (... 2s 2 2p 3 Katika shell ya mwisho) pia huhusishwa na molekuli ya dioksidi, lakini kwa ajili ya shirika la electron octet, wanahitaji kuwa katika jozi tatu zilizogawanyika (Slide 10):

Ni desturi ya kuonyesha jozi za elektroniki (yaani, vifungo vya kemikali) kati ya atomi dashs.. Kila Dialer ni jozi iliyogawanyika ya elektroni. Katika kesi hiyo, molekuli maarufu zaidi inaonekana kama hii:

Formula na dashes kati ya atomi huitwa. fomu za miundo. . Fomu za kimuundo ni nzuri sana kwa picha ya molekuli: zinaonyesha wazi - kama atomi zinaunganishwa, kwa namna gani na uhusiano huo.
Jozi kuu ya elektroni katika formula ya Lewis ni sawa na mtoto mmoja katika kanuni za kimuundo.
Mahusiano mawili na mara tatu yana jina la kawaida - multiPles. Mawasiliano.. Kuhusu molekuli ya nitrojeni inasema kuwa ina oRDER ya mawasiliano sawa na tatu. Katika molekuli ya oksijeni, utaratibu wa mawasiliano ni sawa na mbili. Amri ya mawasiliano katika molekuli ya hidrojeni na klorini ni moja. Katika hidrojeni na klorini sio nyingi, lakini uhusiano rahisi.
Amri ya mawasiliano ni idadi ya jozi zilizogawanyika kati ya atomi mbili zinazohusiana. Utaratibu wa mawasiliano hapo juu haupatikani. Juu ya utaratibu wa mawasiliano, nguvu ya atomi imeunganishwa pamoja na fupi uhusiano yenyewe.
Kuna njia kadhaa za kuunda mahusiano ya Valence. Kutokana na kuingiliana kwa mawingu ya elektroniki (Slide 11) .
| mawasiliano ya S. |  |
| s-P- Mawasiliano. |  |
| p-P - Mawasiliano. | |
| p-P - Mawasiliano. |  |
w.- Mawasiliano ni nguvu sana. r.- Mawasiliano, na r.-CECTM inaweza tu kuwa w.- Mawasiliano. Kutokana na uhusiano huu, viungo vya mara mbili na mara tatu vinaundwa.
Ikiwa orbitals za elektroniki zinaingiliana kupitia mstari unaounganisha nuclei ya atomi, basi uhusiano huo unaitwa w.- Mawasiliano (Sigma Bond). Katika kesi ya elimu r - R.- Connections (mara mbili au tatu) kutokana na eneo la pande zote katika atomi za orbitals P-elektroniki tu moja ya viungo inaweza kuwa W.- Mawasiliano. P-elektroniki iliyobaki iliyobaki inaingiliana pande zote mbili za mstari unaounganisha nuclei ya atomi. Uunganisho huo unaitwa. R.- Mawasiliano (Pi-Bond).
Molekuli ya misombo mingi inajumuisha atomi ya aina tofauti na kwa hiyo zina polar. vifungo vyema . Kwa mfano, vifungo vya polar vilivyopo katika misombo:

Bonds ya polar Wao hutengenezwa kati ya atomi na electronegitability tofauti. Ikiwa atomi ni tofauti, basi kiwango cha umiliki wa jozi ya kawaida ya elektroni imedhamiriwa na tofauti katika electronegatenes ya atomi. Atomi yenye electronegitability kubwa ni nguvu shukrani ya mawasiliano ya elektroni kwa yeye, na malipo yake ya kweli inakuwa hasi. Atom na electrone ya chini hupata, kwa mtiririko huo, malipo sawa mazuri. Ikiwa uunganisho huundwa kati ya tofauti mbili zisizo za metali, basi uhusiano huo unaitwa mawasiliano ya Polar Covalent..
Fikiria kuundwa kwa molekuli ya kloridi. (Slide 12)

Kutokana na uhamisho wa elektroni kutoka hidrojeni hadi klorini, mashtaka ya atomi ya klorini kwa kiasi kikubwa, hidrojeni ni sehemu nzuri.
Katika malezi ya molekuli ya H 2, H mbili (1s 1) na s (... 3s 2 3p 4) wanahusika. Mfumo wa molekuli ya elektroniki. N:S.: H., Mfumo wa miundo N -S. – H.(Slide 13).
Malezi ya molekuli ya maji.
Kwa kufanya hivyo, ni rahisi kwa fomu ya kwanza ya rekodi ya elektroniki kwa shell za nje za hidrojeni (1s 1) na oksijeni (... 2s 2 2p 4). Kisha kuandika formula za elektroniki ambazo zinaonyesha wazi jinsi "kukamilika" shells za elektroniki hutengenezwa karibu na atomi za hidrojeni na oksijeni katika molekuli ya maji (Slide 14):

Inageuka kuwa ni muhimu kuchukua atomi mbili za hidrojeni kwa atomi moja ya oksijeni. Hata hivyo, asili ni kwamba mali ya kukubalika ya atomi ya oksijeni ni ya juu kuliko ile ya atomi ya hidrojeni (juu ya sababu za hii baadaye kidogo). Kwa hiyo, jozi za elektroniki za kumfunga kwa maji zinabadilishwa kidogo kwa kernel ya atomi ya oksijeni. Mawasiliano katika molekuli ya maji - polar covalent, na mashtaka chanya na hasi huonekana juu ya atomi.
Kwa mfano, fikiria dioksidi ya sulfuri hivyo 2. Oxygen na sulfuri zina shells sawa ya valence (... 2s 2 2p 4) na (... 3S 2 2p 4), lakini elektroni za nje za sulfuri ni zaidi kutoka kwa kiini na kuvutia kernel dhaifu kuliko oksijeni. Kwa sababu ya hili, jozi za elektroniki zilizotengwa katika molekuli 2 zinabadilishwa pamoja na vifungo vya kemikali kuelekea atomi za oksijeni ambazo hupata malipo mabaya ya sehemu. Malipo ya sehemu hiyo yanaonyeshwa na barua ya Kigiriki "Delta". Atom ya sulfuri hupata malipo mazuri ya sehemu, na atomi za oksijeni ni malipo hasi ya sehemu.

Atomi tatu za hidrojeni (1s 1) na atomi ya nitrojeni (... 2s 2 2p 3) Shiriki katika malezi ya molekuli ya NH3. Mfumo wa miundo
 , katika atomi ya nitrojeni ina jozi moja ya vazi la elektroniki (Slide 15).
, katika atomi ya nitrojeni ina jozi moja ya vazi la elektroniki (Slide 15).
Uhusiano na covalent yasiyo ya polar na. uhusiano wa polar. Chini ya hali ya kawaida ni mara nyingi gesi au vinywaji. Ikiwa haya ni kali, yanayeyuka kwa urahisi, ingawa kuna tofauti. Ufumbuzi wa vitu vile sio kila wakati uliofanywa na umeme wa sasa, kwa sababu wakati wa kufutwa, hawawezi kugawanyika juu ya ions. Mchanganyiko wa kawaida na vifungo vya polar covalent: hcl kloridi, kaboni dioksidi co 2, maji h 2 o, suvie 2 mchanga, misombo mbalimbali kikaboni.
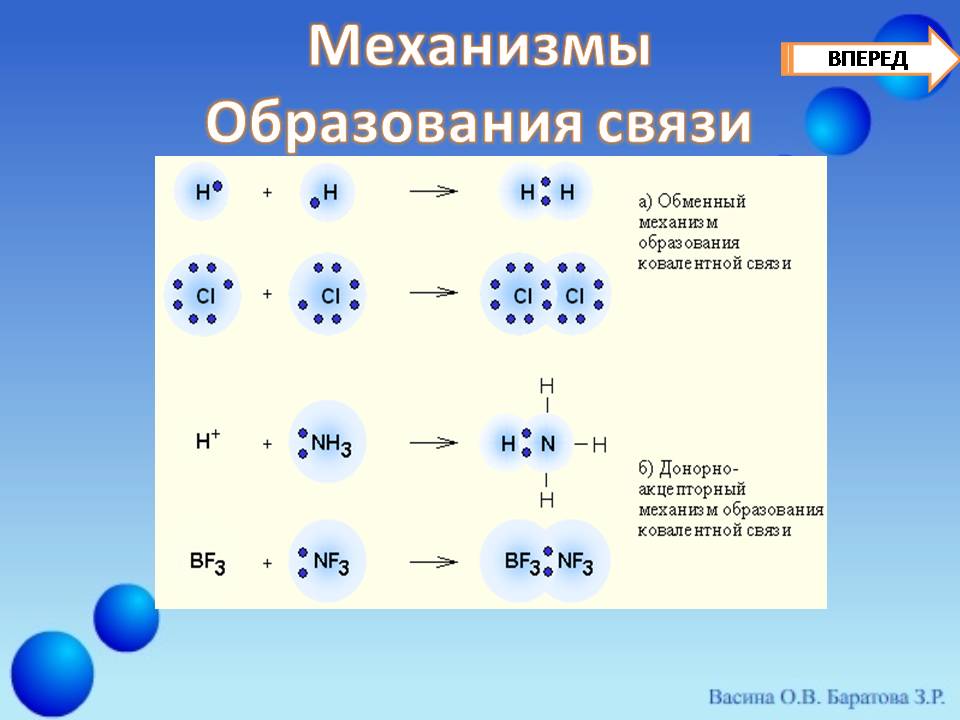
Mawasiliano ya Covalent. - Wengi fomu ya jumla Kemikali ya dhamana inayotokana na jamii ya kijamii wanandoa wa elektroniki Kupitia. mfumo wa kubadilishanaWakati kila atomi zinazoingiliana hutoa elektroni moja, au kwa mfumo wa kukubaliana na wafadhili.Ikiwa jozi ya elektroniki inapitishwa kwa matumizi ya jumla ya atomi moja (wafadhili) kwa atomi nyingine (kukubali) (Slide 16) .

Msaidizi wa kukubaliana na wafadhili mawasiliano ya Ion., Neno linaashiria mojawapo ya njia za kutengeneza dhamana ya kemikali. Bondano la kawaida kati ya atomi mbili ni kutokana na mwingiliano wa elektroni mbili - moja kwa moja kutoka kwa kila atomi. Mawasiliano ya kukubaliana na wafadhili hufanyika kutokana na jozi ya elektroni ya atomi moja (wafadhili) na bure (tupu) orbital (kukubali) (Slide 17, 18) . Kwa kushangaza, tofauti hii inaweza kuelezwa kama hii:
Katika matukio hayo yote, elektroni huwa kawaida kwa atomi mbili.
Mfano wa kawaida ni malezi ya amonia na mmenyuko wa amonia na ion ya hidrojeni (Proton) (Slide19):

Katika molekuli ya amonia naitrojeni Ina jozi isiyo na maana ya elektroni, ion ya hidrojeni 1s-orbital ni bure. Kwa ushirikiano wa kutosha wa NH 3 molekuli na ion ya N + ion, wingu mbili-electron ya nitrojeni iko katika nyanja ya kivutio cha ion hidrojeni na inakuwa ya kawaida kwa atomi ya nitrojeni, na kwa atomi ya hidrojeni, yaani, ya nne Bond covalent N - N. Maunganisho yote N - H Katika ion hii inakuwa sawa na haijulikani. Mfano mwingine muhimu - malezi ya ion ya oconia (Slide 20):

Katika kesi hiyo, molekuli ya maji ni wafadhili, protoni - kukubalika.
Njia hii ya kutengeneza dhamana ya msingi ina jukumu kubwa katika kemia ya misombo tata.
I.V. Kurekebisha nyenzo zilizojifunza..
(Slide 21), (kiambatisho 3. , Majibu).
- Kulingana na muundo wa atomi 6 C, 1 H na sheria za octet, fanya formula ya elektroniki ya kuunganisha mambo haya mawili, ambayo ina atomi 1 ya kaboni. Chora kwa ajili yake mfumo wa miundo.
- Msingi. mfumo wa umeme Atomi na sheria za octet, fanya formula za elektroniki kwa misombo yenye: a) kutoka atomu moja 6 c na atomi mbili 8 o; b) ya atomi mbili 6 c na atomi mbili 1 H. Je, ni wingi wa uhusiano kati ya atomi za kaboni katika uhusiano huu wawili? Kuteka formula zao za kimuundo.
- Kwa mujibu wa formula ya kimuundo, fanya formula ya elektroniki na dalili ya jozi zote za kutosha za elektroniki: H - C ≡ n
- Andika formula za kimuundo kwa ajili ya uhusiano: H 2 S, I 2, ICL. Pata hapa uhusiano wa dhamana ya msingi.
- Andika formula ya elektroniki kwa shell valence ya kipengele 34 se. Ni wangapi waliogawanyika na ngapi interface interface elektroniki katika uhusiano h 2 se? Chora formula yake ya kimuundo.
- Andika formula ya elektroniki na kuteka formula ya kimuundo kwa kuunganisha SF 6. Ni wangapi waliogawanyika na ngapi jozi za interface za elektroniki katika uhusiano huu? KUMBUKA: Fluorine ni mshambuliaji mkubwa wa elektroni, kwa hiyo jozi za elektroniki za vifungo vya kemikali zinabadilishwa kutoka atomi ya sulfuri hadi atomi za fluorine.
V. Reflexia..
Wanafunzi wanaulizwa maswali.(Slide 22. ):
- Je! Umefikia madhumuni ya somo? Kwa kiwango gani?
- Ni maswali gani yaliyosababisha shida kubwa?
Vi. Kazi ya nyumbani.
- §41 (kulingana na kitabu cha G. Erudzitis, F.G.Feldman Kemia Daraja la 8 - M.: "Mwangaza", 2009.), No. 25 - 28 katika abstract - kwa daraja la 8.
- Abstract, №25-28 mapema - kwa 9, madarasa 10.
- §Four (kulingana na kitabu cha O.s Gabrilyan et al. Kemia - daraja 11. Ngazi ya msingi - M.: DOCH, 2009.), No. 25 - 28 katika abstract - kwa daraja la 11.
Fasihi:
- G.E. Rudzitis, f.g. Feldman Chemicals Daraja la 8 - M.: "Mwangaza", 2009.
- Tutorial. Kemia Mkuu wa Kemia»ITCHEM.RU/
- Kozi ya awali ya kemia alhimik.ru/teleclass/konspect/konsp3-01.shtm.
- A.V. Manuilov, v.I. Rodinov Electronic Textbook www.hemi.Nsu.ru/index.htm.
- Kemia Mkuu www.chemel.ru/2008-05-24-19-19-34.html.
- V.V. Zagorsk kemikali dhamana na muundo wa molekuli en.edu.ru/publications/general/3869?catalogueid\u003d3.
- S.t. Kemia mende - 8-9 Hatari www.chem.msu.su/rus/school/zhukov1/welcome.html.
- O.S. Gabrilyan na wengine. Kemia - daraja la 11. Kiwango cha msingi - M.: DOWN, 2009.
Mawasiliano ya Covalent.. Dhamana ya msingi imeundwa kati ya atomi ya moja au zaidi vipengele vya kemikali na uwezekano wa ionization. In. fomu safi. Bond covalent inatekelezwa katika mwingiliano wa vipengele na nusu iliyojaa shells electron. Kutoka kwa kemia ya quantum ifuatavyo kwamba mfumo wa kiini cha kushtakiwa vizuri na vikwazo vya umeme vibaya vina nishati ndogo wakati shells za elektroniki zimejaa kabisa. Kwa hiyo, atomi na nusu iliyojaa electron shells kubadilishana elektroni. Wakati huo huo, jozi ya elektroni kwa muda mfupi ulioongozwa na magnetic hutengenezwa, na jozi hizi ni za atomi zote za jirani (Kielelezo 1). Kwa hiyo, dhamana ya msingi ni dhamana, iliyoundwa na kuchanganya wanandoa wa elektroni za valence.
Kuonekana kati ya jozi za kushtakiwa kwa vyema vya elektroni zilizosababishwa vibaya husababisha ukweli kwamba ions zote mbili zinavutiwa na elektroni zilizotangazwa na, na hivyo huvutia kila mmoja.
Kuongezeka kwa idadi ya mlolongo wa kipengele husababisha ongezeko la idadi ya shells za elektroniki, kuzuia uingiliano wa nuclei ya kushtakiwa kwa kiasi kikubwa na elektroni za valence, ambayo husababisha kupungua kwa nguvu ya kivutio cha pamoja. Matokeo yake, hatua ya kiwango hupungua na ongezeko la idadi ya mlolongo wa kipengele, mgawo wa upanuzi wa mafuta unakua, moduli ya elastic inapungua.
Kuchukuliwa katika Kielelezo 1.1. mawasiliano ya covalent ni yasiyo ya polar. , Hiyo ni, atomi zote zinazohusika katika malezi ya mawasiliano ni sawa katika suala la uwezekano wa ionization na jozi ya elektroni ni sahihi katikati kati ya nuclei ya atomi. Katika tukio ambalo dhamana ya msingi imeundwa kati ya atomi na uwezekano tofauti wa ionization (Kielelezo 1.2), jozi ya elektroni ya kawaida itahamia atomi na uwezo mkubwa wa ionization na dutu inayosababisha itakuwa polar (dipole), na uunganisho utakuwa kuitwa polar covalent. .
Mawasiliano ya Ion.. Uunganisho wa ionic huundwa wakati mwingiliano wa atomi na kiasi kidogo cha elektroni za valence na atomi na idadi kubwa ya elektroni kwenye shells ya valence. Katika kesi hiyo, elektroni za nje za atomi zilizo na uwezo wa ionization za chini zinahamishiwa kwenye valence shells ya atomi na uwezekano mkubwa wa ionization, kama inavyoonekana katika Mchoro 1.3. Matokeo yake, ions ya kushtakiwa na vibaya hutengenezwa, huvutia vikosi vya umeme.
Mkuu mali ya kimwili Dutu na dhamana ya kemikali ya ion ni kama ifuatavyo: ugumu wa juu, plastiki ya chini na mgawo wa ugani wa mstari, joto Kuyeyuka. Kwa kuongeza ukubwa wa ion, ongezeko la mali hizi.
Mawasiliano ya Metal. (Kielelezo 1.4) kinaundwa kati ya atomi ya vipengele vya kemikali moja au zaidi, ambako vifuniko vya umeme vya valence vinajazwa chini ya nusu. Kwa kuwa nishati ya ion ni ndogo na shell ya nje ya kujazwa, atomi hutoa elektroni ya nje ya valence na hubadilishwa kuwa ions vyema, kati ya ambayo elektroni ya bure iko (gesi electron). Kila moja ya ions ya kushtakiwa vizuri huvutiwa na elektroni za bure, na hivyo, ions huvutia kila mmoja.
 Kielelezo 1.5 - Mawasiliano ya mabaki Kielelezo 1.5 - Mawasiliano ya mabaki |
Uunganisho wa mabaki, au uhusiano wa van der Waals. Inaundwa chini ya kuunganishwa kwa molekuli au atomi za gesi za inert kutokana na mwingiliano na deformation ya shells zao za elektroniki. Atomi hugeuka kuwa dipoles ambazo zimevutia. Nambari kubwa ya mlolongo wa atomi, shells zaidi ya elektroniki. Hii inapunguza uhusiano wa elektroni ya valence na kiini, ambayo inafanya iwe rahisi kufuta shell. Kwa hiyo, wakati wa dipole wa atomi huongezeka na nishati ya dhamana kati ya atomi huongezeka. Kwa hiyo, hatua ya kuchemsha ya gesi ya inert nzito ni wazi juu ya kiwango cha kuchemsha cha gesi za mwanga.
Michakato kama hiyo hutokea katika kuungana kwa molekuli ya umeme ya neutral. Aidha, juu ya uzito wa Masi, wakati mkubwa wa molekuli na nishati ya juu ya mawasiliano. Kwa hiyo, dutu chini ya uzito wa molekuli katika joto la kawaida ni gesi, vitu vyenye maji makubwa ya uzito wa Masi, na vitu na uzito mkubwa zaidi wa Masi - miili imara.
Ni muhimu kukumbuka kwamba katika nyenzo sawa, aina kadhaa za vifungo vya kemikali zinaweza kutekelezwa kwa wakati mmoja. Kwa hiyo, ndani ya molekuli ya polyethilini, dhamana ya covalent, na kati ya molekuli ya mabaki. Katika almasi, atomi za kaboni zinahusishwa na dhamana ya msingi, na katika elektroni tatu elektroni huunda dhamana ya msingi, electron moja ni juu ya elimu metal Bond., na sumu ya molekuli ya gorofa huhusishwa na dhamana ya mabaki.
(Nyaraka)
n1.doc.
Sura ya 4. Mawasiliano ya Kemikali na Kujenga Molekuli.4.1. Uamuzi wa mawasiliano ya kemikali.Mali ya vitu hutegemea muundo, muundo, kwa aina ya dhamana ya kemikali kati ya atomi katika dutu. Kemikali Bond ina asili ya umeme. Chini ya dhamana ya kemikali kuelewa aina ya mwingiliano kati ya chembe katika dutu (au asili ya usambazaji wa wiani wa elektroni).
Nadharia ya kisasa ya Kemikali ya Kemikali ilipendekezwa mwaka wa 1916 na mwanasayansi wa Marekani Lewis na wakati huo huo na "mwanasayansi wa Kijerumani wa Kossel. Katika siku zijazo, nadharia hizi ziliongezewa, zimeongezeka, lakini ni za msingi.
Katika malezi ya vifungo vya kemikali, sio elektroni zote za atomi zinahusika, lakini ni elektroni za nje (katika S-na P-Elements, i.e. katika vipengele vya vikundi vikuu mfumo wa mara kwa mara) au elektroni ya ngazi ya nje ya antisomine (katika D-Elements, i.e. Katika vipengele subgroups upande). Electrons yenye uwezo wa kutengeneza vifungo vya kemikali huitwa valence. Kulingana na ngapi elektroni zilishiriki katika malezi ya vifungo vya kemikali, kipengele kinaweza kuwa katika hali moja au nyingine ya Valence (i.e. kuonyesha valence fulani).
Kwa valence ya kipengele cha kwanza iliitwa uwezo wake wa kuunganisha au kuchukua nafasi ya idadi fulani ya atomi ya vipengele vingine. Hivi sasa, dhana ya valence inahusishwa na aina fulani ya dhamana ya kemikali katika dutu hii.
Kiwanja cha atomi katika molekuli ni mchakato mzuri na daima unaongozana na kutolewa kwa nishati,thamani ya ambayo inafanana na nguvu (nishati) ya dhamana ya kemikali ya kusababisha:
H + h \u003d h 2 +103 Kcal / mole
Cl + cl \u003d cl 2 +58 kcal / mol
Nadharia ya muundo wa atomi ilielezea sababu ya kuchanganya atomi ndani ya molekuli kama tamaa ya safu mbili au nane-electron nje. Elimu endelevu ya usanidi wa umeme inaweza kupatikana njia tofauti: Recycling, kuongeza, bahati mbaya elektroni. Kwa hiyo, chini ya kuzingatia kemikali, aina mbalimbali za ushirikiano zinaeleweka kama kuwepo kwa kudumu kwa misombo miwili na ya polyhydric: molekuli, ions, fuwele na vitu vingine. Makala kuu ya mawasiliano ya kemikali yanaweza kuhusishwa:
A) kupungua kwa jumla ya nishati ya mfumo wa mbili au multiatomic
ikilinganishwa na nishati ya jumla ya chembe za pekee, ambazo
mfumo huu umeundwa;
B) Ugawaji wa wiani wa elektroniki katika uwanja wa kemikali ya kemikali ikilinganishwa na kuwekwa tu ya densities ya electron ya atomi zisizounganishwa, karibu na umbali wa mawasiliano.
Kwa asili yake, dhamana ya kemikali ni mwingiliano kati ya nuclei ya kushtakiwa kwa kiasi kikubwa na elektroni zilizosababishwa vibaya, pamoja na elektroni na kila mmoja.
Kuna aina kadhaa za vifungo vya kemikali ambavyo ni muhimu zaidi ionic, covalent, mawasiliano ya chuma.
4.2. Uunganisho wa ion. Katika malezi ya molekuli yoyote, atomi ya molekuli hii ni "kuhusishwa" na kila mmoja. Sababu ya kuundwa kwa molekuli ni kwamba vikosi vya umeme vinatumika kati ya atomi katika molekuli. Uundaji wa molekuli kutoka kwa atomi husababisha nishati ya kushinda, tangu kwa hali ya kawaida hali ya Masi ni imara zaidi kuliko atomiki.
Ikiwa ngazi ya nje ina idadi kubwa ya elektroni ambayo atomi inaweza kumiliki, basi ngazi hii inaitwa kukamilika. Viwango vya kukamilika vinajulikana kwa nguvu kubwa. Viwango vile vina atomi za gesi za inert. Hii ndiyo sababu ya ukweli kwamba gesi za inert chini ya hali ya kawaida haziingii katika athari za kemikali na vipengele vingine. Atomi za vipengele vingine vimejumuisha viwango vya nishati. Katika mchakato wa mwingiliano wa kemikali, wao ni kukamilika, i.e., kupata muundo wa gesi ya inert.
Aina ya mawasiliano ya ioni inawezekana tu katika vipengele ambavyo atomi hutofautiana kwa kasi kwa electronegility ya jamaa (angalia Sehemu ya 3.3.), I.E. Uwezo wa kutengeneza wiani wa elektroniki katika molekuli yenyewe.
Fikiria muundo wa umeme wa atomi za metali fulani. Non-metali na gesi ya gesi ya inert.
Atom ya Mfumo wa Electronic.
Sodiamu ni 2 2s 2 2p 6 3s 1 au 3s 1
Calcium ni 2 2s 2 2p 6 3s 2 3p 6 4s 2 au 4s 2
Klorini ni 2 2s 2 2p 6 3s 2 3p 5 au CS 2 3p 5
Oksijeni ni 2 2s 2 p 4 au 2s 2 2p 4
Neon ni 2 S 2 P 6.
Kama inavyoonekana kutoka kwa muundo wa umeme, Atom ya Neonom ina kiwango cha nishati ya nje kilicho na elektroni nane, na atomi za metali (sodiamu na kalsiamu) na zisizo za metali (klorini na oksijeni) - viwango vya nishati isiyofanywa. Katika mchakato wa athari za kemikali, wanatafuta kuzikamilisha, i.e., kupitisha usanidi wa gesi za inert.
Ili kukamilisha viwango vya nishati, atomi za sodiamu na kalsiamu ni rahisi kutoa elektroni moja na mbili, na atomi za klorini na oksijeni ni rahisi kuchukua elektroni moja au mbili. Hii hutokea wakati molekuli zimeanzishwa.
Uundwaji wa molekuli ya kloridi ya sodium (NACI) na oksidi ya kalsiamu (CAO) hutokea kulingana na mpango huu:
Na - ē? Na +.
Cl + ē? Cl -
Atom ya sodiamu inapoteza elektroni na inageuka kuwa ion ya sodiamu, ambayo inapata usanidi wa gesi ya inert (NE), na atomi ya klorini inaunganisha elektroni, inageuka kuwa ion ya klorini kwa kununua usanidi wa gesi ya Argon (AG).
Vile vile, malezi ya molekuli ya kalsiamu ya oksidi
CA - 2ē? CA 2+.
O + 2ē? O 2-
Ions, kutokana na nguvu ya kivutio cha umeme, fomu ya molekuli. Misombo ambayo iliundwa kwa kuvutia ions inaitwa ionic.
Kemikali ya kemikali kati ya ions iliyofanywa na mvuto wa umeme inaitwa mawasiliano ya ionic. Misombo ya ionic ni wachache. Nadharia ya mawasiliano ya kisasa inaelezea tukio la mawasiliano ya ionic kutoka kwa upeo wa kawaida wa polarization (uhamisho) wa jozi ya kawaida ya elektroni, wakati mwisho huo unakuwa na milki ya moja ya atomi ya kuunganisha, yaani, uunganisho wa ioni ni kesi kali ya covalent Bond.
Kwa hiyo, hakuna tofauti ya msingi katika utaratibu wa tukio la covalent isiyo ya polar, polar covalent na ionic uhusiano. Wanatofautiana tu kwa kiwango cha polarization ya wingu la umeme la molekuli. Hali ya dhamana ya kemikali ni moja.
Kwa misombo na vifungo vya ion, hatua ya juu ya kuchemsha na yenye kiwango ni sifa, conductivity ya umeme ina tu katika hali ya kuyeyuka, ni rahisi kufutwa katika ions katika maji.
Mawasiliano ya Ionic ina sifa ya kutokuwepo na kutokuwa na uhakika.
Uhusiano usio na mwelekeo wa ion.. Ions inaweza kuwakilishwa kama mipira ya kushtakiwa, mashamba ya nguvu ambayo yanasambazwa sawasawa katika pande zote katika nafasi. Kwa hiyo, kila ioni inaweza kuvutia ions kinyume cha ishara katika mwelekeo wowote (Kielelezo 5).
Ndani ya uunganisho wa ioni. Kuingiliana kwa ions mbili ya ishara kinyume haiwezi kusababisha fidia kamili kwa ajili ya mashamba yao ya nguvu. Kwa sababu ya hili, wanahifadhi uwezo wa kuvutia ishara kinyume na katika maeneo mengine (Kielelezo 6).

FIG.5 ION ION Mawasiliano Tini.6 Haifai na uunganisho wa ion.
4.3.
Uhusiano wa kawaida. Bond Kemikali, uliofanywa na kuingilia mawingu ya umeme ya atomi zinazoingiliana, inaitwa dhamana ya msingi.
4.3.1. Dhamana isiyo ya polar covalentant. Utaratibu wa tukio la vifungo vyema utaangalia mfano wa malezi ya molekuli ya hidrojeni.
- Uundaji wa molekuli. 2 . Msingi wa atomi ya hidrojeni ya bure imezungukwa na wingu la umeme la spherically. Chini ya kuunganishwa kwa atomi kwa umbali fulani, kuna uingiliano wa mawingu yao ya umeme ili kuunda wingu la molekuli na wiani wa juu wa elektroni katika nafasi kati ya cores. Ikiwa umbali kati ya nuclei ni 0.106 nm karibu na kugusa kwa atomi za hidrojeni, kisha baada ya kuingiliana (malezi ya molekuli H 2), umbali huu umepungua hadi 0.074 nm (Kielelezo 7). Kuongezeka kwa wiani wa wingu la umeme lililoshtakiwa vibaya kati ya nuclei iliyosababishwa kwa kiasi kikubwa inaongoza kwa ukweli kwamba kernels ni kama imesimama na dhamana hii ya wingu na kemikali.
Kwa hiyo, dhamana ya msingi inahakikishwa na nguvu za kivutio cha umeme kati ya wiani wa elektroni uliojilimbikizia katika nafasi ya interledstone, na kusababisha kutoka kwa mawingu ya elektroniki, na mashtaka mazuri ya cores. Bond covalent ni nguvu kuliko kiwango cha kuingiliana kwa mawingu ya elektroniki. Kama matokeo ya tukio la mawasiliano kati ya atomi za hidrojeni, kila atomi hufikia umeme
heliamu Inert Element Configurations:
N ∙ + ∙ h? N. :
N au h 2.
- Malezi ya molekuli ya klorini C1. 2 . Katika molekuli ya klorini, dhamana ya msingi hufanyika kwa msaada wa elektroni mbili za kawaida au jozi ya elektroniki. Kati ya elektroni saba za valence, kila atomi ya klorini ina moja isiyofunguliwa. Uundaji wa mawasiliano ya kemikali hutokea kutokana na elektroni zisizofaa za kila atomi. Matokeo yake, jozi ya electron ya jumla imeundwa, ambayo ni sawa na atomi zote na, kwa sababu ya kila atomi ya klorini inakamilisha ngazi yake ya nishati, kufikia usanidi wa kipengele cha inert. 7. Mpangilio wa kuingilia kati wa orbital ya Argon Electronic:
wakati molekuli ya hidrojeni imeundwa.
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
: C1 ∙ + ∙ C1? : C1. : C1. : au C1 2.
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
Au, kutoka kwa mtazamo wa jengo la atomi, hii inaweza kuwakilishwa kama:
mfumo wa umeme wa atomi ya klorini ni 2 2s 2 2p 6 3s 2 3Sp 5
Wakati molekuli imeundwa, P-orbitals kuingiliana (Kielelezo 8).
Kielelezo. 8. Mpango wa malezi ya vifungo vya kemikali katika molekuli ya klorini.
kutoka kwa mtazamo wa jengo la atomi, formula ya elektroniki ya atomi ya nitrojeni inaonekana kama hii:
?? ? ? ?
Katika molekuli ya nitrojeni, uunganisho unafanywa kwa kuingiliana P-mawingu matatu yaliyo karibu na X, Y, Z Axis. Kuna sigma moja (?) -Svyaz na uhusiano wa PI mbili kati ya atomi za nitrojeni (?).
Mawasiliano iliyoundwa na kuzunguka mawingu ya elektroniki kwenye mstari wa kuunganisha vituo vya atomi zinazoingiliana huitwa sigma (?) - Mawasiliano. Mawasiliano iliyoundwa na orbital overbitals pande zote mbili ya mstari kuunganisha vituo - atomi inaitwa Pi - Bond.
Ni wazi iliyotolewa katika Mchoro 9.

Kielelezo. 9.Fema ya malezi ya vifungo vya kemikali katika molekuli ya nitrojeni.
Tuliangalia uhusiano usio na polar au homepolar couvavarent. Kwa mawasiliano yasiyo ya polar. Uwezekano wa kuwepo kwa wiani wa elektroni kati ya kernels ni sawa. Vituo vya mvuto wa mashtaka mazuri na mabaya sanjari. Kituo cha malipo chanya kinachukuliwa katikati ya umbali kati ya nuclei. Katika molekuli ya vitu rahisi vya gesi H 2, CI 2, O 2, N 2, mawasiliano ya homepolar (yasiyo ya polar) yanazingatiwa katika awamu ya gesi.
Dutu na dhamana isiyo ya pola ya polar ina joto la chini la kuchemsha na kuyeyuka, hawajatenganishwa katika maji, hawafanyi umeme wa sasa.
4.3.2. Bond covalent polar. Uundaji wa molekuli kutoka kwa atomi za vipengele mbalimbali hutokea kwa msaada wa dhamana ya heteropolar (polar). Kesi rahisi ya mawasiliano ya heteropolar ni malezi ya molekuli ya klororal. Uundaji wa molekuli ya NS1 inaweza kuwasilishwa na mpango: . . . .
N ∙ + ∙ C1. : ? N. : C1. :
∙ ∙ ∙ ∙
Hapa kuna uingiliano wa S-wingu wa atomi ya hidrojeni na P-wingu wa atomi ya klorini (Kielelezo 10).

Kielelezo. 10. Mpango wa malezi ya vifungo vya kemikali katika molekuli ya mazao ya Harrow.
Lakini katika kesi hii, klorini ina electronegitability kubwa zaidi. Kwa hiyo, wiani wa elektroni kwenye atomi ya klorini hutokea. Poles nzuri na hasi hutokea katika molekuli. Bond ya Kemikali, ambayo wiani wa elektroniki hubadilishwa kwa mmoja wa washirika, huitwa dhamana ya heteropolar au polar. Kigezo cha uwezo wa atomi ili kuvutia elektroni inaweza kutumika umeme. Ya juu ya eo kwenye atomi, uwezekano mkubwa zaidi wa kuhama kwa jozi ya elektroniki kuelekea kernel ya atomi hii. Kwa hiyo, tofauti katika electronegability ya atomi ina sifa ya polarity ya mawasiliano.
Kutokana na uhamisho wa jozi ya elektroniki hadi moja ya nuclei, wiani wa malipo hasi huongezeka kwa atomi hii na, kwa hiyo, atomi inapata malipo inayoitwa malipo ya atomi? -. Atomi ya pili huongeza wiani wa malipo mazuri? +. Matokeo yake, dipole hutokea, ambayo ni mfumo wa electrical neutral na mashtaka mawili ya sawa na mabaya yaliyomo katika umbali fulani (urefu wa dipole) l. d kila mmoja. Kipimo cha polarity ya mawasiliano ni wakati wa umeme wa dipole sawa na bidhaa ya malipo ya ufanisi kwa urefu wa dipole l. D.
SV \u003d? l. D.
Wakati wa umeme wa dipole una kitengo cha kupima pendant
mita (cl ∙ m). Kitengo cha kipimo kinatumika pia kama kitengo cha kupima. D.,
sawa na 3.3-10 -30 kl ∙ M.
Bond Covalent Polar na?, Inakaribia hadi 1, inaweza kuchukuliwa dhamana ya ion. Hata hivyo, hata uhusiano wa ion.? chini ya vitengo. Kwa hiyo, uhusiano wowote wa ionic una sehemu fulani ya uwiano.
Kemikali ya kemikali katika misombo mengi ya kemikali inachanganya mali ya uhusiano wa covalent na ion. Kwa hiyo, inaweza kuzingatiwa kuwa na sehemu fulani ya ionicity. Kiwango cha ionicity kina sifa ya malipo ya atomi na ongezeko la ongezeko la tofauti katika mazungumzo ya umeme.
Mfumo ulio juu wa kuundwa kwa dhamana ya msingi (yasiyo ya polar na polar) inaitwa kiwango cha ubadilishaji. Utaratibu mwingine wa kuundwa kwa dhamana ya msingi pia inawezekana - Msaidizi-Msaidizi. Katika kesi hiyo, dhamana ya kemikali inatokea kwa sababu ya wingu mbili-electron ya atomi moja na orbit bure ya nyingine. Kwa mfano, fikiria utaratibu wa malezi ya amonia ion nh +
NH 3 + H +? +.
Katika molekuli ya amoniazot ina jozi ya elektroni (wingu mbili-elektroni). Wioni ya hidrojeni ni bure ya ls-orbital. Chini ya kuunganishwa, wingu mbili la elektroniki la nitrojeni linakuwa la kawaida kwa atomi ya nitrojeni na kwa atomi ya hidrojeni, i.e. iligeuka kuwa wingu la umeme la molekuli. Kwa hiyo, uhusiano wa nne uliofanyika uliondoka. Mchakato wa malezi ya ion ya amonia unaweza kuwasilishwa na mpango:
H H.
.. . . +
H. : N. : + H +? H nh. :
˙˙ ˙ ˙
Atomi hutoa wanandoa wa umeme wa maji yaliyoitwa. mONOU Atomi kukubali (i.e. kutoa orbital bure) inaitwa msaidizi. Mfumo wa kuundwa kwa dhamana ya msingi kwa sababu ya wingu mbili la elektroni la atomi moja (wafadhili) na orbit ya bure ya atomi nyingine (kukubali) inaitwa wafadhili-kukubali.
Kwa hiyo, katika cation ya amonia nne vifungo sawa sawa: tatu sumu juu ya utaratibu wa kubadilishana na moja - kulingana na wafadhili-kukubali.
Dutu za dhamana za polar zinachukua nafasi ya kati kati ya vitu na dhamana ya ion na dhamana isiyo ya polar. Aina ya covalent. Mawasiliano ni sifa ya lattices ya atomiki na molekuli ya kioo.
Haiwezekani kutekeleza mpaka kati ya uhusiano wa ionic na polar. Katika misombo iliyoundwa na vipengele vitatu na zaidi, aina mbalimbali za vifungo vya kemikali inaweza kuwa kati ya atomi.
4.3.3. Nguzo za dhamana za dhamana.Bond covalent kawaida ni sifa ya urefu wa mawasiliano, nishati ya mawasiliano, kueneza na mwelekeo.
Uhusiano mrefu. Inaitwa umbali wa kati kati ya atomi zinazohusishwa na kemikali, wakati vikosi vya kivutio vinalingana na majeshi ya kukataa na nishati ya mfumo ni ndogo. Bond Kemikali ni nguvu kuliko urefu wake. Hata hivyo, kipimo cha kiasi cha nguvu cha mawasiliano ni nishati.
Nishati mawasiliano. Sawa na theeenergy, ambayo ni muhimu kwa kuvunja sasa katika mawasiliano ya Masi. Inapimwa kwa kilodzhoules, inajulikana kwa 1 mol ya vitu, i.e., 6.02 10 23 uhusiano. Kwa hiyo, kwa mujibu wa data ya majaribio, urefu wa uunganisho wa molekuli ya hidrojeni, klorini na nitrojeni, kwa mtiririko huo, ina 0.074, 0.198 na 0.109 nm (nanometer), na nishati ya kumfunga ni kwa mtiririko wa 436, 242 na 946 kJ / mol. Kwa kuongezeka kwa wingi wa mawasiliano, ongezeko la nishati ya kisheria, na urefu hupungua.
Uwezo - Hii ni matumizi kamili ya atomi ya orbitals valence. Matokeo yake, inakuwa haiwezi kuanzisha uhusiano wa ziada. Kwa mfano, haiwezekani kushikilia atomi nyingine ya hidrojeni kwa molekuli 4 au ch 4. Katika molekuli hizi za mawasiliano zinajaa. Kutokana na utimilifu wa viungo vya molekuli, ina muundo fulani: H 2, h 2 o, HCl, nk.
Chakula Dhamana ya dhamana ya muundo wa molekuli, i.e., jiometri yao (sura). Bond covalent inatokea kwa uongozi wa upeo wa juu wa mawingu ya elektroniki (orbital) kando ya mstari wa atomi. Wakati molekuli ya HC1 imeundwa, S-orbital ya atomi ya hidrojeni na P-orbital ya atomi ya klorini hutokea. Molekuli ina fomu ya mstari. Vifungo vya kemikali katika molekuli ya maji vinaelekezwa kwa angle ya 104.5 °.
Vifungo vyema vinavyotengenezwa na atomi nyingi zimekuwa na mwelekeo wa anga. Corners kati ya uhusiano huitwa valence.
4.4. Njia ya mahusiano ya valence (MVS, jua). Kwa ufahamu wa kina wa kiini cha dhamana ya msingi, asili ya usambazaji wa wiani wa elektroni katika molekuli, kanuni za ujenzi wa molekuli ya rahisi na vitu vikali Njia ya mahusiano ya valence (jua, mvs) inahitajika.
Njia ya Viungo vya Valence inaelezea utaratibu wa tukio la dhamana ya msingi na inategemea kanuni za msingi zifuatazo:
1. Bond ya kemikali kati ya atomi mbili hufanyika kwa gharama ya jozi moja au zaidi ya elektroniki.
Vile vile elektroni ya jozi ya kawaida ya elektroni hufanyika wakati huo huo na cores mbili, ambayo ni faida zaidi kuliko kupata kila electrone katika uwanja wa "yake" kernel.
Bond vile kemikali ni twocenter.
2. Wakati wa kuunda jozi ya elektroniki ya jumla, mawingu ya elektroniki yanaingiliana; Eneo la wiani wa elektroni kati ya nuclei huchangia kivutio chao. Nguvu ya kuingiliana kwa mawingu ya electron (uwiano r 1 na r 2), nguvu ya dhamana ya kemikali (Kielelezo 11).
3. Wakati jozi ya elektroniki ya elektroni inaundwa, lazima iwe na kupambana na sambamba (kwa sababu elektroni na spins sambamba hupigwa, na uhusiano haufanyi).

Kielelezo. 11. Kupitia mawingu ya elektroniki 
4. Tu elektroni zisizofaa za atomi zinaweza kushiriki katika malezi ya jozi ya elektroniki ya jumla ili kuunda utaratibu ulioelezwa hapo juu (kwa maneno mengine, mawingu tu ya elektroniki). Kwa mfano, utaonyesha malezi ya molekuli F 2 kwa kutumia seli za quantum ya ngazi ya nje ya nishati (formula ya umeme ya Atom F: 1S 2 2S 2 2p 5):
2S 2 2P 5 2P 5 2S 2 2S 2 2P 6 2P 6 2S 2
?? ?? ?? ? + ? ?? ?? ?? ? ?? ?? ?? ?? ?? ?? ??
Elektroni zisizopandwa 8ē 8ē.
Mkuu (kugawanywa) jozi ya elektroni.
Elektroni zilizounganishwa za kuonekana kwa atomi kwa ajili ya malezi ya vifungo vya kemikali na atomi nyingine inapaswa kuondokana (sprinkled). Atom huenda katika hali mpya ya valence. Gharama ya nishati kwenye mchakato kama huo wa msisimko wa atomi hulipwa na nishati iliyotolewa wakati wa kuundwa kwa dhamana ya kemikali (ni lazima ikumbukwe kwamba uwezekano wa uchochezi wa atomi ni mdogo kwa idadi ya bure ya orbital katika nishati husika subcoins).
5. Bond covalent ina mali ya kueneza, kama matokeo ya molekuli ina muundo kamili kabisa.
Kwa mfano, katika malezi ya molekuli ya methane, kila mmoja wa elektroni nne zisizo na nguvu za atomi ya kaboni ya msisimko pamoja na elektroni ya atomi ya hidrojeni, vifungo 4 vilivyotengenezwa; Jozi zaidi ya elektroniki katika kesi hii haiwezi kuunda molekuli Ch 5, Ch 6, nk. Haipo.
(Kumbuka: mwingiliano wa misombo ya valented-iliyojaa kila mmoja inawezekana kwa malengo ya moja au zaidi ya ziada ya wafadhili wa kukubaliana kwa njia maalum).
6. Bond covalent ni kuelekezwa katika nafasi, ambayo husababisha muundo wa anga ya molekuli (kazi ya mwelekeo).
Kulingana na jinsi elektroni imeunganishwa - S-, P-, D- au F-elektroni, na nishati ya vifungo, urefu wa viungo, pamoja na mwelekeo wao katika nafasi ni tofauti sana.
Mawingu ya umeme yana maumbo tofauti, hivyo kuingiliana kwao kwa pamoja hufanyika kwa njia kadhaa: S- (sigma), P- (PI) na D (Delta) zinajulikana.

Ikiwa kuingiliana kwa mawingu ya elektroniki hutokea kwenye mstari unaounganisha kernel ni S-Bond; Ikiwa mawingu yanaingiliana nje ya mstari huu, kuna P-na D-mawasiliano. Aina ya mawasiliano wakati wa mchanganyiko wa S-, R- na D-orbitals zinaonyeshwa katika michoro:


Mawasiliano -Mawasiliano.
Ikiwa jozi moja ya elektroni (kawaida ya s-dhamana) ilitokea kati ya atomi, uunganisho huo unaitwa moja, ikiwa ni mbili au zaidi, basi nyingi: mara mbili, mara tatu.
Kwa mfano, malezi ya molekuli ya nitrojeni n 2 hufanyika kwa jozi tatu za kawaida za elektroniki. Katika kila atomi ya nitrojeni, kuna 3 elektroni zisizo na nafasi zilizoelekezwa katika nafasi tatu-dimensional kwa angle ya 90 0 kwa kila mmoja na kuelekezwa kulingana na axes X, Y, Z (kama vile mali ya P-suti na p- Orbitals, iliyoagizwa na idadi ya kiasi cha magnetic).

Atomi mbili za nitrojeni, kuunganisha kwenye molekuli n 2, inaweza kuunda S-Bond moja (mawingu ya mawingu ya mawingu kwenye mhimili wa X) na viungo vya P mbili (mawingu ya mawingu yaliyoelekezwa pamoja na axes y na z).

Configuration ya angular ya molekuli ya maji h 2 o, ambayo huamua polarity yake ya juu na vipengele vya mali, inahusishwa na mwelekeo katika nafasi ya S-Bonds mbili za kemikali, katika malezi ambayo P-electrop ya P-electrop ya oksijeni Atom na s-elektroni moja ya atomi za hidrojeni zilishiriki.
1S 2 2S 2 2P 4.
H 8 o? ?? ?? ? ?
Angle ya kuanzia ya 90 ° kati ya atomi mbili za P-orbital huongezeka kwa sababu ya kupungua kwa n atomi zinazobeba ziada ya malipo mazuri (kutokana na uhamisho wa wiani wa elektroni kutoka H hadi O).
Kwa hiyo, muundo wa molekuli unategemea hasa aina na mali ya orbital hizo, ambazo hutolewa kwa malezi ya vifungo vya kemikali. Lakini, pamoja na jambo hili, jambo la uchanganuzi wa orbitals huathiri muundo wa anga wa molekuli.
Uchanganuzi huitwa uundaji wa sawa sawa na fomu na nishati ya orbitals kutoka kwa orbitals ya aina tofauti. Mchanganyiko, orbitals ya mseto katika michoro ni masharti:

Kutoka kwa S-Orbital na P-Orbital moja, mseto mbili, mchanganyiko wa aina ya SP hutengenezwa, kwa lengo la kila mmoja 180 °

Kutoka kwa s-orbital na P-orbitals mbili, orbitals tatu-hybrid orbitals ni sumu, iko katika ndege sawa kwa angle ya 120 ° kwa kila mmoja:

sP 3 geibridization hutokea kama moja ya orbital na P-orbitals tatu ni pamoja; Nne sp 3-mseto orbitals hutengenezwa, sio katika ndege hiyo, lakini kwa kiasi cha tetrahedra na kuelekezwa kutoka katikati ya tetrahedron hadi verti zake 4; Angle ya valence kati ya vifungo viwili vya kemikali ni 109 ° 28 ў

Matukio magumu zaidi ya kuchanganyikiwa na ushiriki wa D-elektroni inawezekana (kwa mfano, SP 3 D 2 - Hybridization).
Uhamasishaji wa uzushi, i.e. Kuchanganya, usawa wa wiani wa elektroni, kwa manufaa kwa atomi, kwani orbitals ya mseto hutokea kuingiliana zaidi na vifungo vya nguvu vya kemikali vinaundwa. Gharama ndogo za nishati kwa ajili ya uchochezi wa atomi na uchanganuzi wa orbitals na ziada ni fidia na nishati iliyotolewa katika tukio la vifungo vya kemikali. Vipande vya valence vinatajwa kwa masuala ya ulinganifu wa juu na utulivu.
Mfano wa SP 3 -Typ hybridization ni muundo wa molekuli ya methane 4. Atomi ya kaboni katika hali ya msisimko ina elektroni nne ambazo hazipatikani: moja na tatu za P-elektroni. Inaonekana kwamba vifungo vinne vya kemikali vinavyotengenezwa nao na s-elektroni za atomi nne za hidrojeni zinapaswa kuwa sawa. Hata hivyo, ilitengenezwa kwa majaribio kwamba vifungo vyote 4 katika molekuli ya CH 4 ni sawa kabisa kwa urefu na nishati, na pembe kati ya vifungo ni 109 ° 28. Kwa hiyo, SP 3-hybridization hutokea katika molekuli ya CH 4.

Mifano nyingine ya kuchanganyikiwa: Bea 2 (SP-), BF 3 (SP- 2), RSL 5 (SP 3 D-), nk.
Katika orbitals ya mseto, kama katika orbital ya kawaida, inaweza kuwa si tu kwa electron moja, lakini pia mbili. Kwa mfano, atomi nne za mseto orbil oxygen ni kama ifuatavyo kwamba wawili wao wana jozi ya elektroni, na electron mbili - moja isiyo na uwezo. Kutoka nafasi za kisasa, muundo wa molekuli ya maji unachukuliwa kuzingatia uchanganuzi wa orbital ya muundo wa o na tetrahedral wa H 2 o molekuli kwa ujumla.
4.5. Metal Orbitals (MMO, MO).Kwa muda mrefu, njia ya MO ilionekana baadaye kuliko njia ya jua, kwa kuwa walibakia katika nadharia ya masuala ya dhamana ambayo hayawezi kuelezewa na njia ya jua. Tunafafanua baadhi yao.
Kama inavyojulikana, nafasi kuu ya njia ya jua ni kwamba uhusiano kati ya atomi unafanywa kwa gharama ya jozi za elektroniki (kumfunga mawingu ya electron mbili). Lakini sio daima kesi. Katika hali nyingine, elektroni binafsi hushiriki katika malezi ya dhamana ya kemikali. Hivyo, katika ion ya molekuli h 2 + uhusiano wa moja kwa moja. Njia ya jua ya malezi ya mawasiliano ya seli moja haiwezi kuelezea, inapingana na nafasi yake kuu.
Njia ya jua pia haina kuelezea majukumu ya elektroni zisizopigwa katika molekuli. Molekuli zilizo na elektroni zisizopigwa paramagnetic., I.E. inayotokana na shamba la magnetic, kwa kuwa elektroni isiyofunguliwa inajenga wakati wa kudumu wa magnetic. Ikiwa hakuna elektroni zisizopigwa katika molekuli, basi wao diamagnetic. - kusukuma nje ya shamba la magnetic. Molekuli ya oksijeni ni paramagnetic, kuna elektroni mbili na mwelekeo sawa wa spins, ambayo inapingana na njia ya jua. Inapaswa pia kuzingatiwa kuwa njia ya jua haikuweza kuelezea aina mbalimbali za mali ya misombo tata - chromaticity yao, nk.
Ili kuelezea ukweli huu, njia ya orbitals ya molekuli (MMO) ilipendekezwa.
4.5.1. Masharti kuu ya MMO, Mo.
1. Katika molekuli, elektroni zote ni za kawaida. Molekuli yenyewe ni nzima, jumla ya cores na elektroni.
2. Katika molekuli, kila elektroni inafanana na orbital ya molekuli, kama vile orbital atomiki inafanana na kila elektroni katika atomi. Na sifa za orbitals ni sawa:
JSC S, P, D, F.
Mo? ,, ?,?
3. Katika makadirio ya kwanza, orbital ya molekuli ni mchanganyiko wa mstari (kuongeza na kuondoa) ya orbitals ya atomiki. Kwa hiyo, wao huzungumzia njia ya L LKAo (molekuli orbital ni mchanganyiko wa mstari wa orbitals), ambayo kutoka N.JSC imeundwa. N. Mo (hii ndiyo nafasi kuu ya njia).

Kielelezo. 12. Mpango wa Nishati kwa ajili ya malezi ya molekuli ya hidrojeni h 2
Kuzingatia vifungo vya kemikali katika njia ya MO ni kusambaza elektroni katika molekuli katika orbitals yake. Mwisho huo umejaa kwa kuongeza nishati na kuzingatia kanuni ya Pauli. Kwa njia hii, ongezeko la wiani wa elektroni kati ya cores katika malezi ya dhamana ya msingi inadhaniwa.
Kutumia nafasi 1-3, kuelezea malezi ya molekuli ya H 2 kwa suala la njia ya MO. Kwa ushirikiano wa kutosha wa atomi za hidrojeni, kuzidi orbitals zao za umeme. Kwa mujibu wa aya ya 3 ya viungo viwili vinavyofanana, orbitals mbili za molekuli hutengenezwa: mmoja wao kutokana na kuongezea orbitals ya atomiki, nyingine kutoka kwenye uondoaji wao (Kielelezo 12). Nishati ya E 1 ya kwanza.
Orbital ya molekuli, nishati ambayo ni chini ya nishati ya atomic orbital ya atomi ya maboksi inaitwa kumfunga (Inaashiria ishara  SV), na elektroni ni juu yake kufunga elektroni.
SV), na elektroni ni juu yake kufunga elektroni.
Orbital ya molekuli ambayo nishati ni nishati zaidi. atomic Orbital, inayoitwa. kupambana na kumfunga au baya (iliyoainishwa na ishara ya solo), na elektroni ni juu yake - elektroni za balary.
Ikiwa atomi za hidrojeni zilizounganishwa za spins za elektroni ni kupambana na sambamba, basi watachukua nafasi ya kumfunga Mo, dhamana ya kemikali (Kielelezo 12), ikifuatana na kutolewa kwa E 1 E 1 (435 KJ / Mol). Ikiwa spins ya elektroni ya atomi za hidrojeni ni sambamba, basi kwa mujibu wa kanuni ya Pauli haiwezi kuingizwa kwenye orbital sawa ya molekuli: mmoja wao atakuwa katika kumfunga, na nyingine juu ya orbital ya kupasuka, inamaanisha kuwa kemikali Mawasiliano haiwezi kuunda.
Kwa mujibu wa njia ya Mo, malezi ya molekuli inawezekana kama idadi ya elektroni juu ya orbitals ya kumfunga ni kubwa kuliko idadi ya elektroni juu ya kuoka orbital. Ikiwa idadi ya elektroni juu ya kufungwa na kuoka orbitals ni sawa, basi molekuli hiyo haiwezi kuunda. Kwa hiyo, nadharia hairuhusu kuwepo kwa molekuli ya NE 2, kwa kuwa ndani yake elektroni mbili itakuwa kwenye orbitals ya kumfunga na mbili juu ya kupasuka. Daima elektroni ya kupasuka hupunguza hatua ya elektroni ya kumfunga.
Katika mfumo wa machapisho ya njia, majibu ya malezi ya molekuli ya hidrojeni kutoka kwa atomi imeandikwa kama ifuatavyo:
2h \u003d h 2 [(? CB 1s) 2],
Hiyo ni, alama zinazoonyesha uwekaji wa elektroni kwenye orbitals ya atomiki na molekuli hutumiwa. Wakati huo huo, ishara ya kila mo iko katika mabano na juu ya mabano upande wa kulia ni idadi ya elektroni kwenye orbital hii.
Idadi ya mahusiano ya valence imedhamiriwa na formula:
N SV - N.
ambapo: B - idadi ya uhusiano;
N SV, N mbalimbali, kwa mtiririko huo, idadi ya elektroni ya kisheria na kuoka katika molekuli.
Katika molekuli ya hidrojeni b \u003d (2-0): 2 \u003d 1, hidrojeni ni monovalent. H 2 molekuli ya diamagnetic (electron paired).
Sasa kwa urahisi anaelezea uunganisho mmoja wa elektroniki katika ion ya molekuli h 2 + (Kielelezo 13). Electron pekee ya ion hii inachukua SV 1 nzuri sana ya orbital SV. Mchakato wa equation:
H + H + \u003d h 2 + [(SV 1s) 1], δH \u003d - 259.4 KJ 

Kielelezo. 13. Mpango wa Nishati ya Elimu ya Kielelezo. 14. Mpango wa Nishati.
ion ya molekuli ya hh 2 malezi ya dizeli ion h 2
Idadi ya uhusiano katika ion h 2 + ni sawa na ile (kwa uhusiano mmoja wa elektroni). Ion H 2 + - Paramagnetic (ina elektroni moja isiyo na uwezo).
Kuwepo kwa ion ya diegelium ya molekuli si 2 + (Kielelezo14). Equation ya elimu yake
Yeye + \u003d yeye 2 + [(cb 1s) 2 (? Range 1s) 1], δH \u003d - 292.8 KJ
Ion hii inakabiliwa na majaribio. Idadi ya uhusiano ndani yake (2-1): 2 \u003d 1/2. 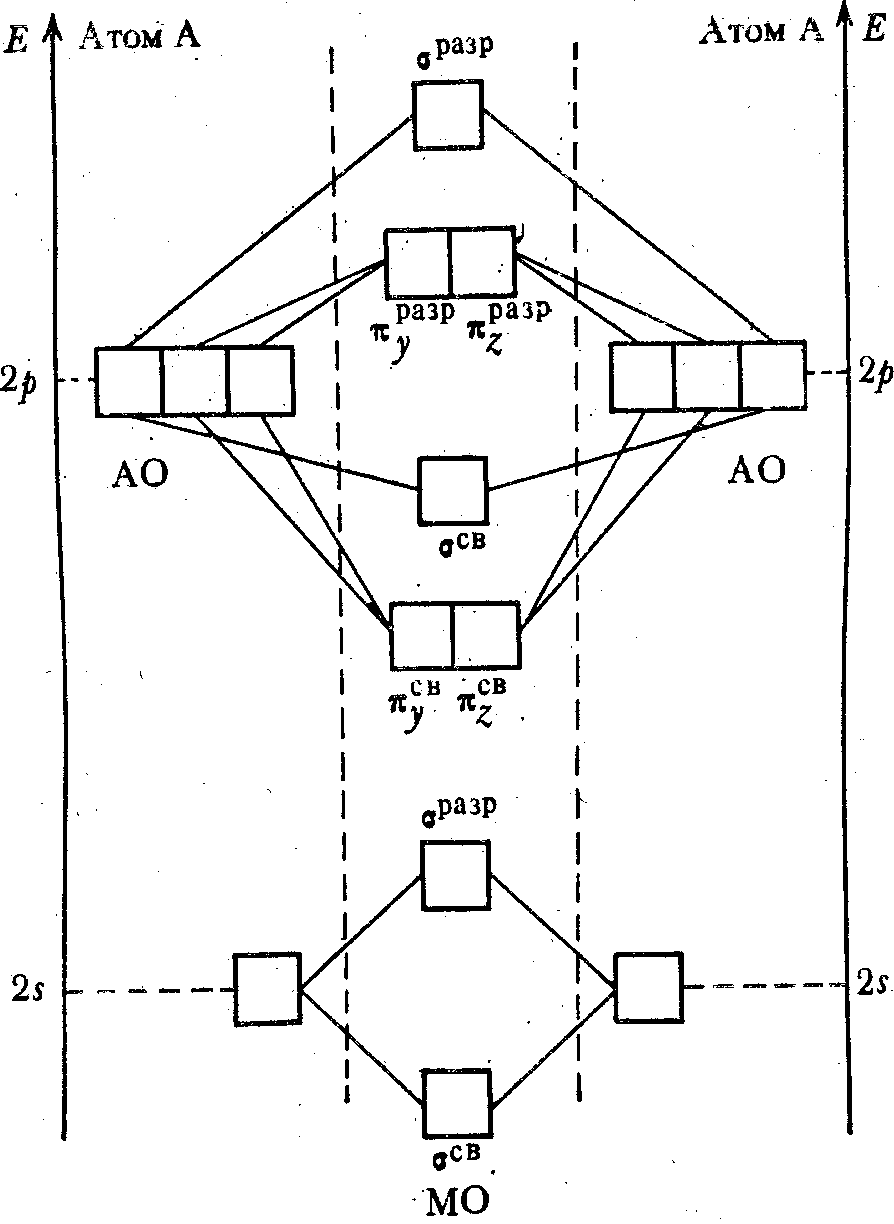
Kielelezo. kumi na tano. Mpango wa nishati kwa ajili ya malezi ya molekuli ya gomonuclear ya diatomic ya vipengele vya kipindi cha pili
Ion-paramagnetic (ina elektroni isiyo na uhakika).
4.5.2. Molekuli kuu ya gomonuclear ya vipengele vya vipengele vya 2.Kanuni inayozingatiwa ya kujenga AO mbili inayofanana inalindwa wakati wa kujenga molekuli ya gomonuclear ya vipengele vya kipindi cha 2 cha mfumo d.I. Mendeleeva. Wao hutengenezwa kama matokeo ya maingiliano ya 2S- na 2r x -, 2r y -
na 2p z -orbital.
Ushiriki wa elektroni za ndani 1s-orbitals zinaweza kupuuzwa (hazizingatiwa kwenye miradi ya nishati inayofuata). Ya 2 orbital ya atomi moja inaingiliana tu na orbital ya 2 ya atomi nyingine (lazima iwe karibu na maadili ya nishati ya kuingiliana orbitals), na kutengeneza Mo? SV 2 na? 2 S. Unapoingiliana (mwingiliano), 2p orbitals ya atomi zote mbili hutengenezwa na Mo:? X SV,? x raz ,? Katika SV,? Wakati wa kuvunja,? Z SV,? Z Dolra.
( 
Kielelezo. 16. Mpango wa Nishati kwa ajili ya malezi ya Molekuli ya Li 2.
kielelezo 15). Wale. Kati ya orbitals sita ya kwanza ya 2R, sita Mo hutengenezwa - tatu za kisheria na bass tatu. Mos kusababisha kutoka s.-
na p X-kanzu orbitals zinaashiria kwa barua, na kutoka kwa p y - na r Z - - barua  . Kutumia mchele. Ni rahisi kufikiria mipangilio ya elektroniki ya molekuli hizi katika mfumo wa machapisho ya njia ya MO.
. Kutumia mchele. Ni rahisi kufikiria mipangilio ya elektroniki ya molekuli hizi katika mfumo wa machapisho ya njia ya MO.
Mfano 1. Lithiamu lithiamu 2 molekuli. . Mpango wa malezi yake unawasilishwa kwenye Kielelezo 16. Ina elektroni mbili za kisheria, molekuli ya diamognetic (electron paired). Kuandika equations na formula inaweza kuwa rahisi, inaashiria ngazi ya ndani kupitiaK:
2LI \u003d LI 2.
Idadi ya uhusiano ni 1.
Mfano 2. Beerllia bia molekuli. Elektroni nane za molekuli zinawekwa kwenye Mo kama ifuatavyo:
VE 2.
Kama inavyoonekana, idadi ya uhusiano katika molekuli ni sifuri: elektroni mbili za kuoka huharibu hatua ya kumfunga mbili. Molekuli kama hiyo haiwezi kuwepo, na bado haijaonekana. Ikumbukwe kwamba molekuli ya dimensional haiwezekani katika vipengele vyote vya kundi la Iia, palladium na vipengele vya inert, kwa kuwa atomi zao zina muundo wa umeme uliofungwa.
Mfano 3.
Molecule Nitrovel n 2 (Kielelezo 17). Usambazaji wa elektroni 14 kulingana na Mo imeandikwa kama ifuatavyo:
N 2 [?
au kufupishwa:
N 2 [KK (? SCB) 2 (? SUME) 2 (? YCB) 2 (? ZCB) 2 (? XCB) 2]
1 -1 +1 +1 +1=3
Kielelezo. 17. Mpango wa Nishati kwa ajili ya malezi ya molekuli n 2
Fomu hiyo inaonyeshwa na idadi ya vifungo katika molekuli, kulingana na hesabu, kwamba elektroni mbili ziko kwenye Moja ya Moja ya Valence; Ishara ya pamoja inaonyesha orbital ya binders, ishara ndogo - kuvuta. Idadi ya uhusiano katika molekuli 3. Hakuna elektroni zisizo na nafasi - molekuli ya diatagnetic.
Mfano 4. O 2 molekuli (Kielelezo 18). Elektroni huwekwa kwa mlolongo:
O 2 [QC (? SCB) 2 (? Sumsro) 2 (? YCB) 2 (? ZCB) 2 (? XCB) 2 (? YRAZR) 1 (? Zrazr) 1]
1 -1 +1 +1 +1 - 1 / 2 - 1 / 2 =2
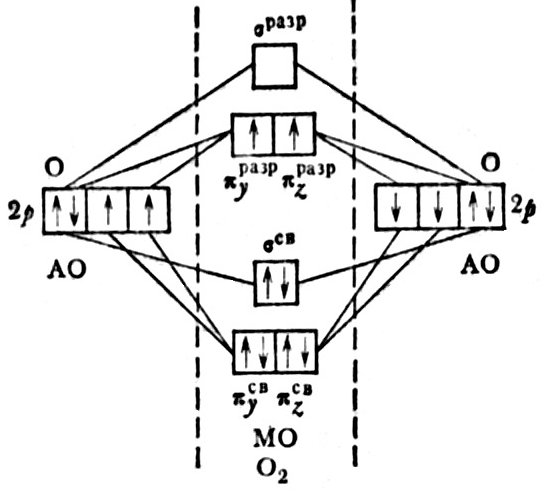
Kielelezo. 18. Mpango wa Nishati kwa ajili ya malezi ya molekuli o 2
Katika molekuli, mawasiliano ya valence mbili. Elektroni mbili za mwisho ziko kwenye aina mbalimbali? -Dorcel orbitals kwa mujibu wa utawala wa Gund. Elektroni mbili zisizoweza kuamua paramagnetism ya molekuli ya oksijeni.
4.5.3. Molekuli mbili za heteronuclear ya vipengele vya kipindi cha 2. Mpango wa nishati ya kuundwa kwa ufuatiliaji wa molekuli ya heteronuclear dioksidi yenye atomi ya vipengele vya kipindi cha 2 huwasilishwa kwenye Kielelezo. 19. Ni sawa na mpango wa malezi ya molekuli ya Mo Gomonuclear.
Tofauti kuu imepungua kwa ukweli kwamba maadili ya nishati ya jina moja na moja ya atomi ya vipengele tofauti si sawa na kila mmoja, kwani mashtaka ya nuclei ya atomiki ni tofauti. Kwa mfano, fikiria usanidi wa valence ya elektroniki ya ushirikiano na hakuna molekuli.

Kielelezo. kumi na tisa. Mpango wa nishati kwa ajili ya malezi ya molekuli mbili za atomiki ya vipengele vya kipindi cha pili
Mfano wa 5.
.
MOLECULE CO. Kanzu ya nje ya elektroni ya atomi ya kaboni ina muundo wa 2 wa 2p 2, na 2s 2 2p 4 oksijeni. Kwa hiyo, 4 + 6 \u003d elektroni 10 kushiriki katika kujaza molekuli. Kati ya hizi, mbili zinawekwa katika orbitals? SV 2, mbili - kwa orbitals? 2 S haraka, nne - katika orbitals? Y CB na? z cb, na tisa na kumi - juu? X SV. Hivyo, usanidi wa valence ya umeme wa molekuli ya CO inaweza kuelezwa na formula:
CO [KK (? SCB) 2 (? S SERAL) 2 (? YCB) 2 (? ZCB) 2 (? HCB) 2]
1 -1 +1 +1 +1=3
Kama ilivyofikiriwa, nadharia ya ndege, katika molekuli na viungo vitatu vya valence (kulinganisha na n 2). Molekuli Molecule - elektroni zote zimeunganishwa.
Mfano 6. Hakuna molekuli. Electroni 11 inapaswa kuingizwa katika molekuli ya molekuli ya nitrojeni (ii): tano nitrojeni - 2s 2 2p 3 na sita oksijeni - 2s 2 2p 4. Wests kumi huwekwa kwa njia sawa na elektroni ya molekuli ya kaboni ya oksidi (ii) (mfano wa 5), \u200b\u200bna kumi na moja itakuwa iko kwenye moja ya orbitals ya kufungia -? y mbalimbali au? Z mbalimbali (hizi orbitals ni nguvu sawa na kila mmoja). Kisha
Hakuna [ck (? SCB) 2 (? S SERAL) 2 (? YCB) 2 (? ZCB) 2 (? HCB) 2 (? YRAZR) 1]
1 -1 +1 +1 +1 - 1 / 2 =2 1 / 2
Ina maana kwamba hakuna molekuli ina viungo vya valence mbili na nusu, nishati ya kisheria ni kubwa -677,8ch / mol. Ni paramagnetic, kama ina elektroni moja isiyo na uwezo.
Mifano hapo juu hutumikia kama mfano wa uwezekano wa njia ya MO katika kuelezea muundo na mali ya molekuli.
Mfano wa 7. Je, ni valence gani kutokana na elektroni zisizofaa (spinvalence) inaweza kutumia fosforasi katika nchi za kawaida na zenye msisimko?
Uamuzi. Usambazaji wa elektroni ya ngazi ya nishati ya nje ya fosforasi 3 3 3p 3 (kutokana na utawala wa Hund,  )
kwa seli za quantum, ina fomu:
)
kwa seli za quantum, ina fomu:
3 s 3 px 3 py 3 pz.
Atomi za phosphorne zina D-orbital ya bure, hivyo mpito wa elektroni wa 3S inawezekana katika hali ya 3D:
3 s 3px 3py 3 pz 3dxy.
Hivyo valence (spinvalence) ya fosforasi katika hali ya kawaida ni tatu, na katika msisimko - tano.
Mfano. 8 . Je, ni uchanganuzi wa valence orbital? Ni aina gani ya muundo una molekuli ya aina ya AB, ikiwa uunganisho huundwa ndani yao kutokana na sp.-, sp. 2 -, Sp 3-hybridization ya atomi orbital ah?
Uamuzi. Nadharia ya mahusiano ya valence (jua) inahusisha ushiriki katika malezi ya vifungo vyema sio tu kwa JSC safi, lakini pia imechanganywa, kinachojulikana kama Hybrid, JSC. Katika hybridization, sura ya awali na nishati ya orbitals (mawingu ya elektroniki) mabadiliko ya pamoja na orbitals (mawingu) ya sura mpya ni sumu na kwa nishati sawa. Idadi ya orbitals ya mseto. (q) sawa na idadi ya chanzo. Angalia jibu katika meza. 13.
Jedwali 13.
Uchanganuzi wa molekuli ya molekuli ya orbital na spatial
Mfano 9. Kama njia ya orbitals ya molekuli (mo) inaelezea muundo wa molekuli ya homo-homo-tenor ya vipengele vya pili?
Uamuzi. Njia ya mahusiano ya valence (jua) haiwezi kuelezea mali kadhaa na muundo wa molekuli (paramagnetism ya molekuli o 2; kudumu zaidi ya viungo katika ions molekuli f +
2 na o + 2 kuliko, kwa mtiririko huo, katika molekuli f 2 na o 2; kinyume chake, nguvu ndogo ya dhamana katika ion n + 2 kuliko katika molekuli n 2; Kuwepo kwa ion ya molekuli si 2 + na kutokuwa na utulivu wa molekuli si 2, nk). Njia ya kuzaa zaidi ilikuwa njia nyingine ya ufafanuzi wa dhamana ya msingi - njia ya orbitals ya molekuli (mo). Katika njia ya Mo, hali ya molekuli inaelezewa kama seti ya orbitals ya molekuli ya elektroniki. Wakati huo huo, idadi ya orbitals ya molekuli ni sawa na jumla ya orbitals ya atomiki. Orbital ya molekuli inayotokana na kuongeza ya orbitals ya atomiki (AO) inafanana na nishati ya chini kuliko orbital ya awali. Mo ina wiani wa elektroni ulioongezeka katika nafasi kati ya cores, huchangia kuundwa kwa uunganisho wa kemikali na huitwa kumfunga.Orbital ya molekuli iliyoundwa kutoka kwa atomiki inafanana na nishati ya juu kuliko orbital ya atomiki. Uzito wa umeme katika kesi hii umejilimbikizia nyuma ya nuclei ya atomiki, na kati yao ni sifuri. Mo ni nguvu sana ya manufaa kuliko JSC ya awali, husababisha kudhoofika kwa dhamana ya kemikali na huitwa wazi. Electrons wanaoishi na kunyoosha orbitals huitwa kwa mtiririko wa kumfunga (CV) na kuacha (imara). Kujaza orbitals ya molekuli hutokea wakati kanuni ya Pauli na sheria ndogo kama nishati yao inavyoongezeka katika mlolongo kama huo:
? CB 1s tofauti 1s cb 2s roll 2s cb 2p x cb 2p y \u003d
CB 2P Z Run 2p y \u003d? Range 2p Z.
Katika Kielelezo. 20 inaonyesha mpango wa nishati kwa ajili ya malezi ya orbitals molekuli kutoka atomiki kwa datomic homoantic (moja na kipengele sawa) ya molekuli ya vipengele vya pili. Idadi ya kumfunga na kuvunja.
ORDER ya mawasiliano Molekuli huamua tofauti kati ya idadi ya elektroni ya kumfunga na kupasuka imegawanywa katika mbili. Utaratibu wa mawasiliano unaweza kuwa sifuri (hakuna molekuli), idadi nzima au sehemu nzuri.
Kama fomu za elektroniki zinaonyesha usambazaji wa elektroni katika atomi ya orbitals ya atomiki, katika molekuli ya molekuli ya molekuli inayoonyesha usanidi wao wa umeme. Kwa kufanana na atomic. s.-,
p.-,
d.-,
f-orbitals orbitals molekuli ni mteule na barua Kigiriki. 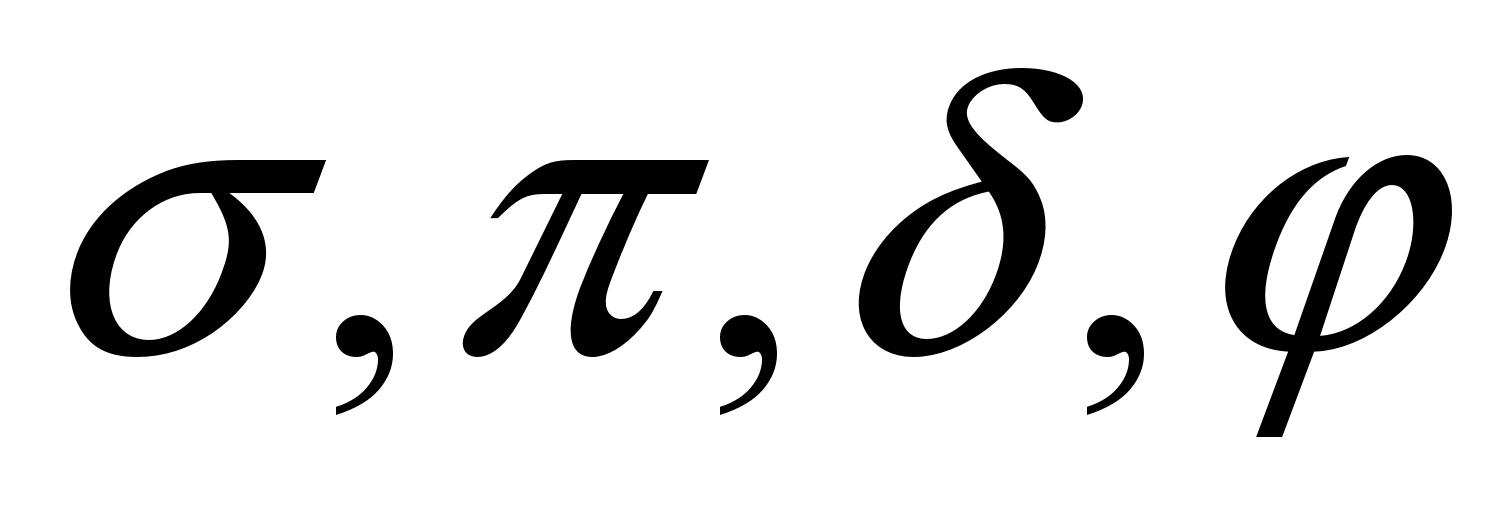 . Kwa hiyo, usanidi wa umeme wa O 2 molekuli imeandikwa kama ifuatavyo:
. Kwa hiyo, usanidi wa umeme wa O 2 molekuli imeandikwa kama ifuatavyo:
O 2 [KK (? SCB) 2 (? SUME) 2 (? PXCB) 2 (? PYCB) 2? Pzrex? Pyrian? Pzrazr]
Barua za CC zinaonyesha kuwa elektroni nne za 1 (mbili za kumfunga na machozi mbili) kwa kawaida haziathiri dhamana ya kemikali.
4.6. Mawasiliano ya Metal..
Jina yenyewe linasema kuwa itakuwa juu ya muundo wa ndani wa metali. Atomi za metali nyingi kwenye ngazi ya nishati ya nje zina idadi ndogo ya elektroni. Kwa hiyo, elektroni moja ina vipengele 16, vipengele viwili - 56, tatu na 4 na sifuri - tu PD moja. Wakati huo huo, katika ngazi za nje za atomi za chuma, orbitals nyingi za bure, ambazo zinaruhusu elektroni kwa karibu na kernels nzuri katika sehemu yoyote ya kioo.
Kutokana na nishati ya chini ya ionization, elektroni katika chuma hupoteza kugusa na atomi za mtu binafsi, ni rahisi kuzalisha, kutengeneza gesi ya umeme ni mchanganyiko wa elektroni za bure. Na jambo muhimu zaidi ni kwamba elektroni katika chuma ni kusonga, kwa urahisi kuhamia. Hizi ni simu, au zisizo za silishwa, elektroni.
Sasa unaweza kuwasilisha chuma kama muundo uliowekwa kwa tightly ya ions chanya kushikamana na kila gesi electron. Katika kesi hiyo, idadi ndogo ya elektroni ya tumaini inahusisha idadi kubwa ya ions.
Bond ya kemikali iliyoundwa na kivutio cha umeme kati ya ions ya chuma na elektroni za jumuiya (gesi ya electron) inaitwa dhamana ya metali. Ni tabia ya metali, alloys na uhusiano wa intermetallic. Hali ya mawasiliano ni umeme.
Mawasiliano ya Metal ina kufanana na couvarent, kwani inategemea generalization ya elektroni valence. Hata hivyo, kwa uhusiano thabiti, elektroni za valence zinazalishwa atomi mbili za jirani, wakati atomi zote zinahusika katika generalization ya elektroni hizi. Ndiyo sababu fuwele na dhamana thabiti ya tete, na kutoka kwa chuma - plastiki; Katika kesi ya mwisho, uhamisho wa ions bila kuharibu mawasiliano inawezekana. Hii inaonyesha yasiyo ya kasi (ukosefu wa mwelekeo) wa uunganisho wa metali. Ili kuongeza ugumu wa metali, vipengele vile huletwa ndani yao ambayo yanapendeza malezi ya viungo vya uongozi.
Kwa njia hii, mawasiliano ya Metal ni dhamana ya kemikali yenye nguvu isiyo ya makaa ya kemikali inayotokea wakati ambapo atomi zina elektroni ndogo za valence ikilinganishwa na idadi ya orbitals ya valence, na elektroni za valence kutokana na nishati ya chini ya ionization ni dhaifu uliofanyika na kernel. Inafafanua mali ya kimwili ya metali.
4.7. Dhamana ya hidrojeni. Dhamana ya hidrojeni ni aina ya dhamana ya kemikali. Inatokea kati ya molekuli, ambayo inajumuisha hidrojeni na kipengele cha umeme cha umeme. Vipengele vile ni fluorine, oksijeni, nitrojeni, klorini, nk.
Hali ya uhusiano wa hidrojeni ilielezwa kwa njia tofauti. Ushirikiano wa umeme ulipokea usambazaji mkubwa zaidi.
Utaratibu wa vifungo vya hidrojeni utaangalia mfano wa molekuli ya maji. Wakati dhamana ya polar imeundwa kati ya atomi za hidrojeni na atomi ya oksijeni, elektroni awali ya atomi ya hidrojeni inabadilishwa sana kuelekea oksijeni. Matokeo yake, atomi ya oksijeni inapata malipo makubwa ya ufanisi, na kernel ya atomi ya hidrojeni na nje kwa heshima na atomi ya oksijeni ni karibu kunyimwa wingu wa umeme. Kati ya proton ya atomi ya hidrojeni na atomi ya oksijeni ya oksijeni ya maji ya karibu, kivutio cha umeme hutokea, ambayo inaongoza kwa malengo ya vifungo vya hidrojeni.
Mchakato wa kutengeneza dhamana ya hidrojeni kwa mfano wa molekuli mbili za maji inaweza kuwakilishwa na mpango wafuatayo (pointi ni dhamana ya hidrojeni, na ishara? + ,? - - mashtaka ya atomi):
. .
?+ . .
?–
: O - N ∙ ∙ ∙ O - N.
Inapaswa kuwa sahihi zaidi kwamba mwingiliano wa kukubaliana wafadhili hushiriki katika malezi ya mawasiliano ya hidrojeni. Baada ya yote, uhusiano huu unahusishwa na mwelekeo katika nafasi na kueneza. Kwa mara ya kwanza, N. D. Sokolov, ambaye alianzisha nadharia ya quantum-mitambo ya vifungo vya hidrojeni.
Kwa mujibu wa nadharia ya wafadhili, dhamana ya hidrojeni huanza na mwingiliano wa umeme, kama matokeo ambayo jozi ya elektroniki ya atomi ya hidrojeni ni zaidi ya makazi yao katika mwelekeo wa oksijeni, kutokana na ambayo atomi ya hidrojeni "imechukuliwa mbali", kwa wengine Maneno ya atomi ya hidrojeni, atomi ya hidrojeni ni "iliyotolewa" na inakuwa na uwezo wa kuchukua jozi ya umeme ya atomi ya oksijeni molekuli nyingine. Shamba la Proton ni kubwa na kuvutia jozi ya elektroni ya atomi ya oksijeni kwa ufanisi sana, wakati hakuna elektroni nyingine kuhusu proton, hivyo kuenea kwa molekuli nyingine ya maji katika atomi ya hidrojeni imepunguzwa sana.
Utaratibu huu unaelezea kwa nini tu hidrojeni ina uwezo wa kutengeneza dhamana ya hidrojeni. Katika atomi nyingine yoyote, wakati wa kutolewa kwa orbital, kernel si "umbo" na shells ndani hutoa repulsion kutoka shells elektroniki ya molekuli ya pili.
Utaratibu uliozingatiwa wa kuundwa kwa dhamana ya hidrojeni inahitaji kwamba atomi ya kipengele kinachounganisha na hidrojeni, ina electronegility ya juu na alikuwa na jozi ya elektroni ya molar. Tu juu ya hali hii, wingu la umeme la atomi ya hidrojeni linashusha sana kwa atomi ya mpenzi. Kwa njia hii, h.bond ya lengo iliyoundwa na hidrojeni yenye polarized ya A-H (au Polar Group-A-H) na atomi hasi ya umeme katika molekuli nyingine au sawa inaitwa dhamana ya hidrojeni.
Uundaji wa mawasiliano ya hidrojeni ni kutokana na ukweli kwamba katika polar molekuli ah. au polar. vikundi -A-N. Atomi ya hidrojeni yenye polarized ina mali ya pekee: ukosefu wa shells za ndani za elektroni, mabadiliko makubwa ya jozi ya elektroni hadi atomi yenye electronegitativent ya juu ni ndogo sana. Kwa hiyo, hidrojeni inaweza kuletwa kwa undani katika shell ya umeme ya atomi ya jirani ya polarized.
Mfano wa umeme wa malengo ya vifungo vya hidrojeni ni kweli tu katika makadirio ya kwanza, kwani nishati ya ziada ya atomi ya hidrojeni inapaswa kuwa nayo hali ya kemikali. Njia ya vifungo vya valence haiwezi kuelezea malezi ya atomi ya ziada ya dhamana, tangu atomi ya hidrojeni ni monovalent. Njia ya orbitals ya molekuli katika tofauti yake ya multicenter inatoa maelezo yafuatayo ya malezi ya dhamana ya hidrojeni. Chini ya kuunganishwa kwa atomi ya H, kwa kuzingatia kwa atomi ya kipengele cha electronegative a? - - H? +, Na atomi nyingine pia ni kipengele cha Electurey b? - Kituo cha tatu kinachofunga orbital kinatokea, kukaa ambapo jozi ya elektroniki ya atomi ni faida zaidi kuliko atomi ya obiti ya atomiki.
Kawaida, mawasiliano ya hidrojeni yanaonyeshwa na pointi na hii inaonyesha kuwa ni dhaifu kuliko dhamana ya covalent (karibu mara 15-20). Hata hivyo, ni wajibu wa chama cha molekuli. Kwa mfano, malezi ya dimers ya aceti inaweza kuwakilishwa na mpango wa aggregations ya molekuli kutokana na vifungo hidrojeni:
1. Elimu ya minyororo ya zigzag katika hidrojeni ya maji ya kioevu ya maji:

2. Uundaji wa hydrate ya amonia Nn 3 ∙ h 2 o Wakati wa kufuta amonia katika maji:
H - N ∙ ∙ ∙ h - O.
4.8. Mwingiliano kati ya molekuli.Chini ya kuunganishwa kwa molekuli, kivutio kinaonekana, ambayo husababisha tukio la hali iliyohifadhiwa ya dutu hii. Aina kuu ya mwingiliano wa molekuli inapaswa kuhusishwa na wapigaji vifungo vya hidrojeni. na mwingiliano wa kukubaliana.
4.8.1. Vanderwalvas nguvu.Mnamo mwaka wa 1873, mwanasayansi wa Kiholanzi I. Van Der Waals alipendekeza kuwa kuna nguvu zinazoamua kivutio kati ya molekuli. Vikosi hivi baadaye vilipokea jina la vikosi vya vanderwals. Wao ni pamoja na vipengele vitatu: Dipole-dipole, uingiliano wa kuingiliana na usambazaji.
D.  ipol-dipole. mwingiliano. Kwa kuunganisha kwa molekuli ya polar, wao ni mwelekeo kwa namna ambayo upande mzuri wa dipole moja inalenga upande mbaya wa dipole nyingine (Kielelezo 3.1). Kuingiliana kati ya dipiles huitwa Dipole Dipole au orientational. Nishati ya mwingiliano wa Dipole-Dipole ni sawa na wakati wa umeme wa dipole katika shahada ya nne na ni inversely sawia na umbali kati ya vituo vya dipiles katika shahada ya sita na joto kabisa katika shahada ya kwanza.
ipol-dipole. mwingiliano. Kwa kuunganisha kwa molekuli ya polar, wao ni mwelekeo kwa namna ambayo upande mzuri wa dipole moja inalenga upande mbaya wa dipole nyingine (Kielelezo 3.1). Kuingiliana kati ya dipiles huitwa Dipole Dipole au orientational. Nishati ya mwingiliano wa Dipole-Dipole ni sawa na wakati wa umeme wa dipole katika shahada ya nne na ni inversely sawia na umbali kati ya vituo vya dipiles katika shahada ya sita na joto kabisa katika shahada ya kwanza.
Mwingiliano wa kuingizwa. Dipiles inaweza kuathiri molekuli zisizo za polar, kugeuka kuwa dipiles (induced) (Kielelezo 1.1 ). Kuna kivutio kati ya dipiles ya kudumu na ya kudumu, nishati ambayo ni sawa na wakati wa umeme wa dipole hadi shahada ya pili na ni inversely sawia na umbali kati ya vituo vya molekuli katika shahada ya sita. Nishati ya mwingiliano wa uingizaji huongezeka kwa ongezeko la polarizability ya molekuli, i.e. Uwezo wa molekuli kuunda dipole chini ya ushawishi wa uwanja wa umeme. Ukubwa wa polarizability huelezwa katika vitengo vya kiasi. Uwezeshaji katika aina hiyo ya molekuli inakua kwa ongezeko la ukubwa wa molekuli (Jedwali 14). Nishati ya mwingiliano wa uingizaji ni chini ya nishati ya mwingiliano wa dipole-dipole (Jedwali 14).
Kivutio cha usambazaji. Katika molekuli yoyote au atomi nzuri ya gesi, kushuka kwa umeme kwa umeme, kama matokeo ya dipiles papo hapo kuonekana, ambayo kwa hiyo husababisha dipiles papo hapo katika molekuli jirani (Kielelezo 3.1 ).
Mwendo wa dipoles ya papo huwa thabiti, kuonekana na kuoza na kuoza hutokea kwa synchronously. Kama matokeo ya mwingiliano wa dipoles papo, nishati ya mfumo hupungua. Nishati ya ushirikiano wa kueneza ni sawa na polarizability ya molekuli na ni inversely sawia na umbali kati ya vituo vya chembe. Kwa molekuli zisizo za polar, mwingiliano wa kueneza ni sehemu pekee ya vikosi vya vanderwals (Jedwali 14).
Jedwali 14.
Mchango wa vipengele vya mtu binafsi katika nishati ya intermolecular
mwingiliano
| Dutu | Dipole umeme wakati, D. | Polarizability. M 3 ∙ 10 30. | Maingiliano ya Nishati, KJ / Mole. | Joto la kuchemsha, kwa |
|||
| orientational. | induction. | utawanyiko | jumla |
||||
| H 2. | 0 | 0,8 | 0 | 0 | 0,17 | 0,17 | 20,2 |
Nishati ya mwingiliano wa vanderwals. Nishati ya aina zote za mwingiliano wa VanderWALAS ni kinyume cha usawa na umbali kati ya vituo vya molekuli katika sita.
Kwa kuunganisha nguvu ya molekuli, nguvu za kupuuza zinaonyeshwa kati yao, ambazo ni sawa na uwiano: kati ya molekuli-katika hatua ya kumi na mbili. Kwa hiyo, utegemezi wa nishati inayosababisha mwingiliano wa vanderwalsov na kutoka umbali kati ya molekuli, I. B, iliyoonyeshwa na equation.
l. 6 B. l. 12 B.
Ambapo: A na B ni mara kwa mara.
Mfumo wa chini wa mfumo hutolewa kwa umbali kati ya vituo vya molekuli 0.40.5 nm, i.e. kwa kiasi kikubwa kuliko kuunganisha kemikali /
Kama inaweza kuonekana kutoka meza. 14, malezi ya ukubwa wa molekuli katika mfululizo wa AR-XE na NS1-Hi inakua polarizability yao na nishati ya kivutio cha usambazaji. Mahusiano ya mwelekeo hufanya mchango mkubwa kwa vikosi vya Vanderwali tu katika kesi ya molekuli na wakati mkubwa wa umeme wa dipole. Kwa ongezeko la nishati ya jumla ya mwingiliano wa intermolecular, hatua ya kuchemsha ya maji inaongezeka, wakati joto la uvukizi wao linaunganishwa.
Nishati ya jumla ya mwingiliano wa molekuli ya molekuli na amri ya 1-2 ni ya chini kuliko nishati ya vifungo vya kemikali.
Kwa hiyo, kati ya molekuli kuna maonyesho dhaifu ya ushirikiano, ikiwa ni pamoja na vikosi vya kueneza, na kwa molekuli ya polar na kivutio cha dipole-dipole na mwingiliano wa induction.
4.8.2. Mwingiliano wa kukubaliana na molekuli. Misombo kamili.Ikiwa moja ya molekuli mbili ina atomi yenye bure ya orbital, na nyingine ni atomi yenye elektroni ya mvuke, basi kati yao kuna mwingiliano wa kukubaliana, ambao unasababisha kuundwa kwa dhamana ya msingi, kwa mfano:
NH 3 + BF 3 \u003d NH 3 BF 3
Katika atomi ya nitrojeni katika molekuli ya amonia, kuna jozi nyingi za elektroni, na kwenye atomi ya boron katika molekuli ya Boron ya Trifluoride - orbital wazi.
Katika ushirikiano wa utaratibu wa kukubaliana, atomi ya nitrojeni inatoa elektroni kadhaa juu ya uhusiano, na Atom ya Boron ni orbital wazi, na kusababisha uhusiano thaolent
H - N + ڤ B - F? H - N - B - F.
Katika kiwanja kilichopatikana, jumla ya boron na valence ya nitrojeni ni sawa na nne.
Complexes. Vile vile, kiwanja cha CRF 6 kinaundwa wakati KF na PF 5 inavyoingiliana, ambayo inaweza kuandikwa kwa namna ya [PF 6].
Katika mwingiliano wa sulfate ya shaba na amonia, kiwanja kikubwa kinaundwa
CUSO 4 + 4NH 3 \u003d CUSO 4 4NN 3
ambayo inaelezwa na formula [CU (NN 3) 4] hivyo 4. Misombo tata ambayo ina vifungo vyema vinavyotengenezwa na utaratibu wa kukubaliana na wafadhili walipata jina la misombo tata au uratibu. (Angalia Sura ya 9).


