La electricidad se llama la propiedad del elemento químico para atraer a los electrones a su átomo de átomos de otros elementos con los que este elemento forma un enlace químico en las conexiones.
Cuando el enlace químico se forma entre átomos de diferentes elementos, la nube electrónica general se desplaza a un átomo más negativo de electrones, por lo que la conexión se vuelve covalentemente polar, y con una gran diferencia de el ion electronegatidad.
La electricidad se tiene en cuenta al escribir fórmulas químicas: el símbolo del elemento más electronegativo se registra en las conexiones binarias.
La electricidad aumenta en la dirección de izquierda a derecha para los elementos de cada período y disminuye en la dirección de arriba a abajo para los elementos del mismo grupo PS.
Valencia El elemento se llama la propiedad de sus átomos para conectarse a un cierto número de otros átomos.
Hay número estequiométrico, de valencia electrónica y coordinación. Consideraremos solo valencia estequiométrica.
Estoquiométrico La valencia muestra cuántos átomos de otro elemento adjunta un átomo de este elemento. Por unidad de valencia adoptó la valencia de hidrógeno, porque El hidrógeno es siempre monovalente. Por ejemplo, en HCl, H2O, compuestos NH3 (la escritura adecuada del amoníaco H 3 N ya se usa en los manuales modernos), el cloro CH 4 es monovalente, el oxígeno bivalente, el triunfo de nitrógeno y el carbono tetravalenten.
La valencia estequiométrica de oxígeno suele ser igual a 2. Dado que casi todos los elementos forman compuestos con oxígeno, es conveniente usarlo como una referencia para determinar la valencia de otro elemento. Por ejemplo, en los compuestos NA 2 O, COO, Fe 2 O 3, por lo que 3 monovalente de sodio, cobalto bivalente, hierro es trivalente, azufre hexavalente.
En reacciones oxidativas y restaurativas, será importante para nosotros determinar los grados de oxidación de los elementos.
Grado de oxidación El elemento en la sustancia se llama su valencia estequiométrica, tomada con un signo más o menos.
Los elementos químicos se dividen en elementos. valencia permanente Elementos de valencia variable.
1.3.3. Sustancias moleculares y no elásticas. Tipo de celosía de cristal. La dependencia de las propiedades de sustancias de su composición y estructura.
Dependiendo de qué estado del compuesto está en la naturaleza, se dividen en molecular y no serecular. EN sustancias moleculares Las partículas estructurales más pequeñas son las moléculas. Estas sustancias tienen una celosía de cristal molecular. En sustancias no meculares, los átomos o iones son las partículas estructurales más pequeñas. La celosía de cristal es atómica, ión o metal.
El tipo de celosía de cristal determina en gran medida las propiedades de las sustancias. Por ejemplo, los metales que tienen tipo de metal de celosía de cristaldifieren de todos los demás elementos alta plasticidad, conductividad eléctrica y térmica.. Estas propiedades, así como muchas otras, forjando, gloss metálicos, etc. Debido a un tipo especial de comunicación entre átomos de metal - conexión de metal. Cabe señalar que las propiedades inherentes a los metales se manifiestan solo en estado condensado. Por ejemplo, la plata en un estado gaseoso no tiene las propiedades físicas de los metales.
Un tipo especial de comunicación en metales es metálico, debido a la deficiencia de los electrones de valencia, por lo que son comunes a toda la estructura del metal. El modelo más simple de la estructura metálica asumió que la red cristalina de metales consiste en iones positivos rodeados de electrones libres, el movimiento de electrones se produce caóticas, como las moléculas de gas. Sin embargo, un modelo de este tipo, una explicación cualitativa que explica muchas propiedades de los metales, con una verificación cuantitativa resulta insuficiente. El desarrollo adicional de la teoría del estado metálico llevó a la creación. teoría de la zona de los metales.que se basa en las actuaciones de la mecánica cuántica.
En los nodos de la red cristalina hay cationes y átomos de metal, y los electrones se mueven libremente a lo largo de la celosía de cristal.
La propiedad mecánica característica de los metales es el plasticoDebido a las peculiaridades de la estructura interna de sus cristales. Bajo la plasticidad, la capacidad de los cuerpos bajo la acción de las fuerzas externas para someterse a deformación, que permanece y después del cese de la influencia externa. Esta propiedad de Metales les permite darles una forma diferente al cortar, montar metales en hojas o tírela en un cable.
La plasticidad de los metales se debe al hecho de que con los efectos externos de las capas de iones que forman la red cristalina, se desplazaban en relación entre sí sin romperse. Esto ocurre como resultado del hecho de que los electrones en movimiento debido a la redistribución gratuita continúan comunicándose entre las capas de iones. En el efecto mecánico en el sólido con una parrilla nuclear, sus capas separadas se desplazan y la adherencia entre ellas se rompe debido a la ruptura corbatas covalentes.
ionesLuego se forman estas sustancias. tipo de iones de celosía de cristal.

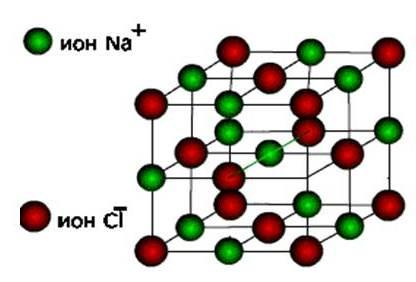
Estas son sales, así como óxidos y hidróxidos de metales típicos. Estas son sustancias sólidas, frágiles, pero su principal calidad. : Soluciones y fundidos de estos compuestos realizan corriente eléctrica..
Si se encuentran en los nodos de la celosía de cristal. ÁtomosLuego se forman estas sustancias. tipo atómico de celosía de cristal.(Diamante, bor, aluminio de silicio y óxidos de silicona). Según las propiedades, muy sólidas y refractarias, insolubles en agua.
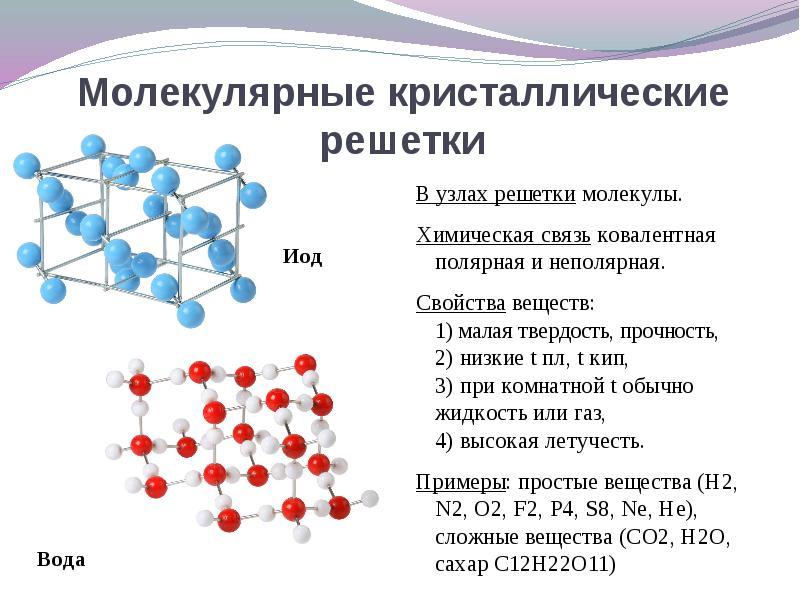
Si se encuentran en los nodos de la celosía de cristal. moléculasEstas sustancias se forman (en condiciones normales de gases y líquidos: O 2, HCl; I 2 sustancias orgánicas).
Es interesante observar el metal de galio, que se derrite a una temperatura de 30 o C. Esta anomalía se explica por el hecho de que las moléculas GA 2 y sus propiedades se encuentran en las asambleas de la red cristalina.
Ejemplo.La estructura nemolecular tiene todos los no metales del grupo:
1) carbono, boro, silicona; 2) flúor, bromo, yodo;
3) oxígeno, azufre, nitrógeno; 4) cloro, fósforo, selenio.
EN sustancias no elásticas Las partículas estructurales más pequeñas son átomos o iones. La celosía de cristal es atómica, iónica o metal.
Para solución Esta pregunta es más fácil de pasar de lo contrario. Si se encuentran en los nodos de la celosía de cristal. moléculasLuego se forman estas sustancias. tipo molecular de celosía de cristal.(En condiciones normales de gases y líquidos: O 2, HCl; también I 2, azufre rombico S 8, fósforo blanco P 4, sustancias orgánicas). Por propiedades, estos son compuestos frágiles de baja fusión.
En la segunda respuesta, hay un gas de flúor, en el oxígeno de tercer gases, nitrógeno, en el cuarto de gas de cloro. Así, estas sustancias tienen una celosía de cristal molecular y una estructura molecular.
EN primero Responda todas las sustancias: compuestos sólidos en condiciones normales y forman una rejilla nuclear, lo que significa que hay una no ética.
Respuesta correcta:1) carbono, bor y silicio
- El menos electronegativo es el elemento químico.
- planchar
- magnesio
- calcio
Se debe prestar atención a la frase "menos electronegativa", es decir, el elemento con las propiedades metálicas más grandes. Este argumento eliminará de posibles respuestas de AZOT como no metall, y detenerse en el calcio, como lo más activo de los metales propuestos en la tarea. Respuesta: 4.
- El enlace químico más polar en una de las moléculas.
- CL 4.
- St. 4.
El conocimiento de los patrones de los cambios en la monatidad electrónica en los períodos y grupos del sistema periódico di Mendeleev permite excluir de la lista de compuestos cuatriculares de metano de carbono CH 4, y de los haluros restantes para detenerse en CF 4, como en el Compuesto de carbono con la más electronegativa de todos los elementos químicos: flúor. Respuesta: 2
- En moléculas de cloruro y comunicación química de cloro, respectivamente
- polar iónico y covalente
- iónico y covalente no polar
- covalent polar y covalente no polar.
- hidrógeno y covalente no polar.
La palabra clave para la ejecución rápida y correcta de esta tarea es la palabra "respectivamente". En las versiones propuestas, solo una de las respuestas comienza con las palabras "covalent polar", es decir, los bonos característicos del clanor. Respuesta: 3.
- El grado de oxidación del manganeso en el compuesto, cuya fórmula a 2 mNO 4 es igual
El conocimiento de las reglas para calcular los grados de oxidación de los elementos por la fórmula le permitirá elegir la respuesta correcta. Respuesta: 3.
- El mayor grado de oxidación tiene un azufre en sal.
- potasio de sulfato
- potasio sulfit
- potasio de sulfuro
- hidrosulfato de potasio
Obviamente, el rápido cumplimiento de esta tarea será traducir los nombres de las sales en la fórmula. Dado que el azufre es un elemento del grupo a través, entonces su menor grado de oxidación es -2. Este valor corresponde a un compuesto con la fórmula K2 S - sulfuro de potasio. Respuesta: 3.
- El grado de oxidación es +5 El átomo de cloro tiene en ion.
- C1O - 4.
- C1O -
- C1O - 3.
- C1O - 2.
Al realizar esta tarea, debe prestar atención al hecho de que no hay compuestos electrónicos en la condición, sino iones de cloro con una sola carga negativa ("-"). Dado que la suma de los grados de la oxidación de los átomos en el ion es igual a la carga del ion, la carga negativa total de los átomos de oxígeno en el ion articulado debe ser -6 (+5 - 6 \u003d -1). Respuesta: 3.
- El grado de oxidación -3 tiene nitrógeno en cada una de las dos conexiones.
- NF 3 y NH 3
- NH 4 CL y N 2 O 3
- NH 4 CL y NH 3
- HNO 2 y NF 3
Para determinar la respuesta correcta, es necesario dividir mentalmente las opciones para respuestas al pitido izquierdo y derecho. Luego, elija el que los compuestos tienen una composición más sencilla, en nuestro caso, este es el compuesto binario deseado correcto. El análisis eliminará las respuestas 2 y 4, como en óxido y fluoruro en nitrógeno el grado positivo de oxidación, como en un elemento menos electronegativo. Este argumento hace posible excluir y responder 1, ya que es la primera sustancia, todo el mismo fluoruro de nitrógeno. Respuesta: 3.
- A las sustancias de la estructura molecular no incluyen.
- dióxido de carbono
- metano
- cloro
- carbonato de calcio
Debe prestar atención al juicio negativo, establecido en la condición de asignación. Dado que las sustancias gaseosas en condiciones normales tienen una parrilla cristalina molecular en un estado sólido, la condición de asignación 1-3 no corresponde a la condición de la condición. La atribución de carbonato de calcio a las sales de nuevo confirman la respuesta correcta. Respuesta: 4.
- ¿Son los siguientes juicios sobre las propiedades de las sustancias y su estructura?
A. La ropa interior mojada se seca en heladas porque las sustancias de la estructura molecular son capaces de sublimación (sublimación).
B. La ropa interior mojada se seca en las heladas porque las moléculas de agua tienen un peso molecular bajo.
- verdadero solo A.
- sólo justo B.
- ambos juicios son ciertos
- ambos juicios no son ciertos.
Conocimiento propiedades físicas Las sustancias de la estructura molecular permiten decidir que la causa del secado de la ropa seca en la escarcha es la capacidad del hielo a sublimación, y no la estructura dipolo de las moléculas de agua. Respuesta 1.
- La estructura molecular tiene cada una de las sustancias, cuyas fórmulas se dan en la fila.
- CO 2, HNO 3, SAO
- Na 2 S, BR 2, NO 2
- H 2 SO 4, CU, O 3
- Así 2, I 2, NSL
Dado que las opciones propuestas contienen tres sustancias, es lógico dividir mentalmente estas versiones en tres pitidos verticales. El análisis de cada uno de ellos, comenzando con sustancias de una composición más sencilla (PODSTOLBIK promedio), eliminará la respuesta 3, ya que contiene cobre metálico, con una cuadrícula cristalina de metal. Un análisis similar del pitido derecho permitirá eliminar la respuesta 1, ya que contiene el óxido del metal de la tierra de tono (celosía de iones). De las dos opciones restantes, es necesario excluir la opción 2, ya que contiene una sal de metal alcalino - sulfuro de sodio (enrejado de iones). Respuesta: 4.
Tareas para trabajos independientes.
- El grado de oxidación es de +5 exhibiciones de nitrógeno en el compuesto, cuya fórmula
- N 2 o 5
- N 2 o 4
- N 2 O.
- El grado de oxidación del cromo en el compuesto, la fórmula de la cual (NH 4) 2 CR 2 O 7, es igual a
- El grado de oxidación de nitrógeno disminuye en una fila de sustancias, las fórmulas de las cuales
- NH 3, NO 2, KNO 3
- N 2 O 4, KNO 2, NH 4 CL
- N 2, n 2 O, NH 3
- HNO 3, HNO 2, NO 2
- El grado de oxidación de cloro aumenta en una serie de sustancias, las fórmulas.
- NSLO, NSLO 4, KSLO 3
- CL 2, C1 2 O 7, KSLO 3
- CA (C1O) 2, KSLO 3, NSLO 4
- KSL, KSLO 3, KSLO
- La comunicación química más polar en la molécula.
- amoníaco
- serovodorod.
- bromomodorod
- fluorodorod
- Sustancia con un enlace covalente no polar.
- fósforo blanco
- fosfuro de aluminio
- cloruro de fósforo (V)
- fosfato de calcio
- Fórmulas de sustancias solo con un enlace de iones registradas en una fila
- cloruro de sodio, cloruro de fósforo (V), fosfato de sodio
- oxido de sodio, hidróxido de sodio, peróxido de sodio.
- seroberod, carburo de calcio, óxido de calcio.
- fluoruro de calcio, óxido de calcio, cloruro de calcio.
- La celosía de cristal atómica tiene
- Óxido de sodio
- Óxido de calcio
- Óxido de azufre (iv)
- óxido de aluminio
- Conexión con iónico. red cristalina formado cuando el cloro interactúa con
- fósforo
- bario
- hidrógeno
- gris
- ¿Son los siguientes juicios sobre el cloruro de amonio?
A. El cloruro de amonio es la sustancia de la estructura iónica formada por lazos polares e iónicos covalentes.
B. cloruro de amonio: la sustancia de la estructura de iones, y por lo tanto sólida, refractaria y no volátil.
- verdadero solo A.
- sólo justo B.
- ambos juicios son ciertos
- ambos juicios son incorrectos
08. Electricidad, grado de oxidación, oxidación y recuperación.
Discutamos el significado de conceptos extremadamente interesantes que existen en química, y a menudo sucede en la ciencia, lo suficientemente confuso y se usan en la forma invertida. Será sobre "electronegatividad", "el grado de oxidación" y "reacciones redox".
¿Qué significa esto: el concepto se usa en una forma invertida?
Intentaremos decirlo gradualmente.
Electricidad Nos demuestra las propiedades redox del elemento químico. Es decir, su capacidad de tomar o dar fotones gratis. Y también es una fuente o absorbente de energía (éter). Yang o yin.
Grado de oxidación - Este es un concepto similar al concepto de "electronegatividad". También caracteriza las propiedades redox del elemento. Pero entre ellos está la siguiente diferencia.
La electricidad da la característica de un elemento separado. Por sí mismo, fuera de encontrarlo en un compuesto químico. Mientras que el grado de oxidación caracteriza precisamente sus habilidades oxidativas y restaurativas cuando el elemento es parte de cualquier molécula.
Hablemos un poco sobre cuál es la capacidad de oxidar, y cuál es la capacidad de restaurar.
Oxidación - Este es el proceso de transferencia a otro elemento de fotones libres (electrones). La oxidación no es excluyendo los electrones en absoluto, como ahora se considera que está en la ciencia. . Cuando el elemento oxida otro elemento, actúa como un ácido u oxígeno (de ahí el nombre "oxidación"). Oxidarse: significa promover la destrucción, la decadencia, los elementos ardientes . La capacidad de oxidar es la capacidad de causar la destrucción de las moléculas por la energía transmitida por ellos (fotones libres). Recuerda que la energía siempre destruye la sustancia.
Sorprendentemente, cuánto tiempo en la ciencia hay contradicciones en la lógica, no son notables por nadie.
Aquí, por ejemplo: "Ahora sabemos que el agente oxidante es una sustancia que los electrones adquieren, y el agente reductor es la sustancia que les da" (enciclopedia del químico joven, un artículo "oxidación y reacción)".
E inmediatamente, dos párrafos a continuación: "El oxidante más fuerte es una corriente eléctrica (una corriente de electrones cargados negativamente)" (ibid.).
Esos. la primera cotización establece que el agente oxidante es lo que toma los electrones, y en la segunda llamada oxidante lo que da.
¡Y conclusiones erróneas similares que se contradicen entre sí están obligadas a memorizar en las escuelas e institutos!
Se sabe que los mejores oxidantes son no metales. Además, cuanto menor sea el número de período y más número de grupo, más fuertes se expresan las propiedades del oxidante. Esto no es sorprendente. Desmontamos las razones de esto en un artículo dedicado al análisis del sistema periódico, en la segunda parte, donde hablaron sobre el color de los nucleones. Desde el 1er grupo a 8, el color de los nucleones en los elementos está cambiando gradualmente de púrpura a rojo (si considera el color azul de D- y F-Elements). La combinación de partículas amarillas y rojas facilita la devolución de fotones libres acumulados. Amarillo acumulado, pero sostenga débilmente. Y el rojo contribuye a la devolución. Poner fotones: este es el proceso de oxidación. Pero cuando algunos son rojos, entonces no hay partículas que puedan acumular fotones. Es por eso que los elementos de 8 grupos, gases nobles, no agentes oxidantes, a diferencia de sus vecinos, halógenos.
Restauracion - Este es un proceso opuesto a la oxidación. Ahora, en la ciencia, se cree que cuando el elemento químico recibe electrones, se restaura. Este punto de vista es muy posible entender (pero no aceptar). Al estudiar la estructura de los elementos químicos, se descubrió que emiten electrones. Concluyó que los electrones son parte de los elementos. Significa que la transferencia de elemento de electrones es, un tipo, restauración de su estructura perdida.
Sin embargo, de hecho, todo está mal.
Los electrones son fotones libres. No son nucleones. No son parte del cuerpo del elemento. Se sienten atraídos entrando al exterior, y se acumulan en la superficie de los nucleones y entre ellos. Pero su acumulación no es en absoluto para restaurar la estructura del elemento o la molécula. En contraste, estos fotones emitidos por ellos éter (energía) debilitan y destruyen los vínculos entre los elementos. Y este es el proceso de oxidación, pero no la recuperación.
Restaure la molécula, en realidad, - tome energía de ella (en este caso, fotones gratis), y no informe. Selección de fotones, el recuperador de elementos compacta la sustancia: lo restaura.
Los mejores agentes reductores son metales. Esta propiedad sigue naturalmente de su composición cualitativa y cuantitativa: sus campos de atracción son los más grandes y en la superficie necesariamente, hay muchas o suficientes partículas. de color azul.
Incluso puede retirar la siguiente determinación de los metales.
Metal - Este es un elemento químico, en la composición de las capas de superficie de las cuales hay una partículas necesariamente azules.
PERO no metal - Este es un elemento, en la composición de las capas de superficie de las cuales no hay o casi no hay fotones de azul, y necesariamente hay rojo.
Los metales con su fuerte atracción toman perfectamente electrones. Y por lo tanto están reductores de agentes.
Damos la definición de los conceptos de "electronegacidad", "el grado de oxidación", "reacciones redox", que se pueden encontrar en libros de texto en química.
« Grado de oxidación - La carga condicional del átomo en el compuesto calculada sobre la base del supuesto de que consiste solo en iones. Al determinar este concepto, se cree convencionalmente que los electrones de las aglutinantes (valencia) van a los átomos más electronegativos, y por lo tanto los compuestos consisten en que eran de iones positivos y cargados negativamente. El grado de oxidación puede tener cero, valores negativos y positivos, que generalmente se configuran sobre el símbolo del elemento desde arriba.
El valor cero del grado de oxidación se atribuye a los átomos de los elementos en el estado libre ... El valor negativo del grado de oxidación tiene esos átomos a los que se desplaza la nube de electrones de carpeta (par de electrones). El flúor en todas sus conexiones es igual a -1. Un grado positivo de oxidación tiene átomos que dan electrones de valencia a otros átomos. Por ejemplo, metales alcalinos y alcalinos, es respectivamente +1 y +2. En los iones ordinarios, es igual a la carga del ion. En la mayoría de los compuestos, el grado de oxidación de los átomos de hidrógeno es + 1, pero en las hidruros de metales (compuestos con hidrógeno) y otros, es igual a -1. Para el oxígeno, el grado de oxidación -2 es característico, pero, por ejemplo, en un compuesto con flúor, será +2, y en las conexiones de peroxidación -1. ...
La suma algebraica de la oxidación de los átomos en el compuesto es cero, y en el ión complejo, la carga del ion. ...
El mayor grado de oxidación es el mayor valor positivo. Para la mayoría de los elementos, es igual al número de grupo en el sistema periódico y es una característica cuantitativa importante del elemento en sus conexiones. El valor más pequeño del grado de oxidación del elemento, que se produce en sus compuestos, es habitual que se denomina un menor grado de oxidación; Todos los demás - intermedios "(Diccionario enciclopédico de la química joven, artículo" Grado de Oxidación ").
Aquí están la información básica relacionada con este concepto. Está estrechamente relacionado con otro término - "electricidad".
« Electricidad - Esta es la capacidad de un átomo en la molécula para atraer electrones involucrados en la formación de un enlace químico "(Diccionario enciclopédico del químico juvenil, artículo" Electricidad ").
"Las reacciones redox están acompañadas por un cambio en el grado de oxidación de los átomos que forman parte de las sustancias que reaccionan, como resultado de los electrones en movimiento del átomo de uno de los reactivos (agente reductor) al otro átomo. Con reacciones oxidativas y reductoras, se producen oxidación (retorno de electrones) y recuperación (la adición de electrones) (Diccionario enciclopédico químico) (Diccionario enciclopédico químico ed. I.L. Knunyantz, Artículo "Oxidación y reacciones reductoras").
En nuestra opinión, hay unos pocos errores en estos tres conceptos.
primeramente , creemos que la formación de una conexión química entre los dos elementos no está en todo el proceso de la socialización de sus electrones. El enlace químico es una conexión gravitacional. Los electrones, supuestamente volando alrededor del núcleo, son fotones libres que se acumulan en la superficie de los nucleones en el cuerpo del elemento y entre ellos. Para que surjan una conexión entre dos elementos, sus fotones libres no necesitan correr entre los elementos. Esto no sucede. De hecho, el elemento más pesado quita (atrae) fotones libres con más ligeros, y los deja (más precisamente, sobre ti mismo). Y la zona de un elemento más ligero con el que se eliminaron estos fotones, de una forma u otra. Debido a que la atracción en esta zona se manifiesta en mayor medida. Y el elemento más fácil se siente atraído por mucho. Así surge el bono químico.
en segundo lugar , La química moderna ve la capacidad de los elementos para atraer los electrones distorsionados, invertidos. Se cree que cuanto mayor sea la electronegatividad del elemento, más es capaz de atraer electrones a sí mismo. Y el flúor con oxígeno supuestamente lo hace mejor: atraen a otros electrones a sí mismos. Así como otros elementos de 6 y 7 elementos.
De hecho, esta opinión no es más que un engaño. Se basa en la vista errónea, como si el número de más grupo, los elementos más difíciles. Y también, mayor será la carga positiva del núcleo. Esta es una mierda. Los científicos ni siquiera se molestan para explicar que desde su punto de vista es un "cargo". Simplemente, como en la numerología, recalcularon todos los elementos en orden y se firmaron de acuerdo con el número de valores de carga. ¡Gran caminata!
Esto es claro y niño que el gas es más ligero que el metal denso. ¿Cómo sucedió que en la química se considera que los gases son mejores que atraen electrones?
Metales densos, por supuesto, son mejores atrayores de electrones.
Los científicos-químicos, por supuesto, pueden dejar el concepto de "electronegance" en el curso, ya que es tan común. Sin embargo, tendrán que cambiar su significado en lo contrario directo.
Electricidad - Esta es la capacidad del elemento químico en la molécula para atraer electrones. Y, por supuesto, en los metales, esta habilidad se expresa mejor que los no metales.
En cuanto a los postes eléctricos en la molécula, entonces, de hecho, polo negativo - Estos son elementos no metálicos que dan electrones con campos más pequeños de atracción. PERO positivo - Siempre son elementos con propiedades metálicas más pronunciadas, con grandes campos de atracción.
Sonríe juntos.
Electricidad - Este es otro, otro intento de describir la calidad del elemento químico, junto con el peso y la carga ya existentes. Como sucede a menudo, los científicos de un área de ciencia diferente, en este caso, química, como si no fueran confiando con sus colegas a los físicos, sino, simplemente, simplemente porque cualquier persona, haciendo descubrimientos, es a su manera, y no Simplemente explorando la experiencia de los demás.
Así sucedió esta vez.
La masa y el cargo no ayudaron a ningún químico para comprender lo que estaba sucediendo en los átomos cuando se estaban interactuando entre sí, y se introdujo el electronegato, la capacidad del elemento para atraer los electrones involucrados en la formación de un enlace químico. Debe reconocerse que la idea de este concepto es muy cierta. Con la única enmienda que refleja la realidad en una forma invertida. Como dijimos, es mejor atraer electrones de metal, en lugar de no metales, en virtud de las características del color de los nucleones de superficie. Los metales son los mejores agentes reductores. No metales - agentes oxidantes. Se toman metales, los no metales dan. Metales - Yin, Nemmetalla - Yang.
Esotérico viene a ayudar a la ciencia en cuestiones de comprender los secretos de la naturaleza.
Sobre grado de oxidación Este es un buen intento de entender cómo se está produciendo la distribución de electrones libres dentro del compuesto químico - moléculas.
Si el compuesto químico es uniformemente, es decir, es simple, su estructura consiste en elementos del mismo tipo: entonces todo es cierto, realmente el grado de oxidación de cualquier elemento en el compuesto es cero. Dado que no hay oxidantes a este respecto y no hay reiniciadores. Y todos los elementos son iguales en calidad. Nadie toma los electrones, nadie le da. Si es una sustancia densa, o líquido, o gas, sin importar.
El grado de oxidación, así como la electronegatividad, demuestra la calidad del elemento químico, solo dentro del marco del elemento químico. El grado de oxidación está diseñado para comparar la calidad de los elementos químicos en el compuesto. En nuestra opinión, la idea es buena, pero su implementación no satisface del todo.
Nosotros categóricamente contra toda la teoría y el concepto de la estructura de los elementos químicos y las conexiones entre ellos. Bueno, aunque solo sea porque la cantidad de grupos, de acuerdo con nuestras ideas, debe ser más de 8. y, por lo tanto, todo el sistema se derrumba. Sí, y no solo eso. En general, vuelva a calcular el número de electrones en los átomos de "dedos" de alguna manera no es grave.
De acuerdo con el concepto actual, resulta que los oxidantes más fuertes se asignan los cargos condicionales más pequeños: el flúor tiene una carga -1 en todos los compuestos, oxígeno en casi todas partes, 2. Y en metales muy activos, tierra alcalina y alcalina, estos cargos, respectivamente, +1 y +2. Después de todo, no es absolutamente lógico. Aunque, repetimos, entendemos muy bien el esquema general, de acuerdo con el que se realizó, todo por el bien de 8 grupos en la tabla y 8 electrones en el nivel de energía externa.
Sin embargo, como mínimo, se suponía que la magnitud de estos cargos en halógeno y oxígeno era el más grande con un signo menos. Y los metales alcalinos y alcalinos de la tierra también son grandes, solo con un signo más.
En cualquier compuesto químico Hay elementos que dan electrones, agentes oxidantes, no metales, cargas negativas y elementos que toman electrones, reductores de agentes, metales, carga positiva. Esta es exactamente la forma de comparar los elementos, relacionarse entre sí y intentarlo, determinando su grado de oxidación.
Sin embargo, para averiguarlo de esta manera, el grado de oxidación, en nuestra opinión, no refleja de manera exitosa la realidad. Sería más correcto comparar la electronegabilidad de los elementos en la molécula. Después de todo, la electronegatividad es casi la misma que el grado de oxidación (caracteriza la calidad, solo un elemento separado).
Puede tomar la escala de electricidad y ponerlo en la fórmula para cada elemento. Y luego se verá de inmediato, qué elementos se administran electrones, y que se toman. Ese elemento cuya electronegatividad en el compuesto es el polo más alto negativo, da electrones. Y el que la electronegabilidad es el polo más pequeño - positivo, toma los electrones.
Si los artículos, admiten, 3 o 4 en la molécula, nada cambia. Todos también ponen la magnitud de la electronegabilidad y comparar.
Aunque no se debe olvidar que dibuje el modelo de la estructura de la molécula. De hecho, en cualquier compuesto, si no es simple, es decir, no consiste en un tipo de elementos, se asocian entre sí, en primer lugar, metales y no metales. Metales Seleccione los electrones en los no metales y se unen a ellos. Y en un elemento de no metal, los electrones 2 se pueden seleccionar al mismo tiempo o un número mayor de elementos con propiedades metálicas más pronunciadas. Así se produce la molécula compleja y compleja. Pero esto no significa que en tal molécula, los elementos metálicos vienen en una conexión sólida y entre sí. Tal vez se encuentren en los lados opuestos unos de otros. Si está cerca, atraerán. Pero la conexión sólida se forma solo si un elemento es más metálico que el otro. Asegúrese de hacer un elemento Seleccione los electrones, eliminados. De lo contrario, el elemento no sucederá, exención de fotones libres en la superficie. El campo de atracción no se manifestará bien, y no habrá conexión duradera. eso tema complejo - educación vínculos químicosY no lo contaremos en detalle en este artículo.
Creemos, estamos altamente encendidos el tema dedicado al análisis de los conceptos de "electronegacidad", "grado de oxidación", "oxidación" y "restauración", y proporcionó su atención mucha información curiosa.
Del libro gestionado los sueños El autor del mundo Elena.Restauración "Cuando nace un signo unificado de indi-appeam, esencia y la vida se divide en dos. A partir de este punto, si el mundo final no alcanza, la esencia y la vida nunca volverán a verse ". William, "Misterio de la flor de oro" después del Instituto.
Desde el libro el libro de secretos. Increíble obvio en la Tierra y en el extranjero. Autor Vyatkin arkady dmitrievichEl masoquismo como un grado extremo de vampirismo voluntario en este sentido, el masoquismo es similar a la telecomunicación. Los Mazochistas son personas que reciben sensaciones agradables de su propio sufrimiento físico y mental. En otras palabras, les gusta cuando golpean, regañan, se burlan.
De los vampiros del libro en Rusia. ¡Todo lo que necesitas saber sobre ellos! Autor Bauer AlexanderCómo determinar el grado de pérdida de sangre cuando el vampiro bebe sangre, luego bebe a la vez desde el medio litro a uno y medio litros de sangre. El cuerpo humano contiene solo cinco o seis litros de sangre, por lo que tal pérdida de sangre no es necesariamente peligrosa para la vida. Sin embargo, el vampiro puede
Del libro modelando el futuro en un sueño. El autor del mundo Elena.Restauración Después de la distribución del Instituto, trabajando como ingeniero en una compañía cerrada, me di cuenta de que no estaba en mi lugar, así que decidí cambiar la profesión y entré en la Escuela de improvisación de Jazz, y más tarde en la Escuela de Música para la oficina clásica. .
Desde el libro gobierna Golden Fengshui. 10 pasos simples para el éxito, el bienestar y la longevidad Autor Rudin Valentin LeonidovichEl grado de impacto negativo de los objetos externos la mayor influencia negativa de los objetos externos tiene, siendo inmediatamente antes de ingresar a la casa. Pero cuanto más se encuentran en un ángulo a la entrada, el más débil se convierte en su influencia. El objeto está directamente.
por el autor eduard curaPrimer grado: Cocinar. El sermón de Nagorny y el reino de Dios de Cristo comienza con el Idilio de Galilea y el anuncio del "Reino de Dios". Esta predicción nos indica a sus instrucciones populares. Al mismo tiempo, es una preparación para más elevada.
De la evolución divina del libro. De Esfinge a Cristo por el autor eduard curaSegundo grado de iniciación (limpieza). Maravillosa curación. La terapia cristiana en todos los misterios antiguos para la preparación moral e intelectual debería haber estado limpiando el alma, que debería revivir nuevos órganos en ella y darlo posteriormente la capacidad
Desde el libro un enigma de gran esfinge. Autor Barbaren GeorgesRestauración de la estatua La edad real de una gran esfinge se remonta al principio de la era de Adán. Al menos él es una pirámide contemporánea, el conjunto del cual él, como lo veremos, lo completamos. La imagen de un gran Sphynx ha sido sometido a siglos vencidos.
De la curación del libro del alma. 100 técnicas meditativas, ejercicios de curación y relajación. Autor Rajish bhagwan sriRestauración del ritmo ... Instale el mismo tiempo para ir a la cama: si todas las noches es once, significa que once. Este es el primero: obtener un momento determinado, y pronto el cuerpo podrá ingresar a este ritmo. No cambies esta vez, de lo contrario, elegirás el cuerpo. Cuerpo
por el autor Kuzmishin E. L.Grado de una recepción de estudiantes al título de estudiante. La decoración del albergue y los dominios y el techo del albergue deberían ser horneados azul y material blanco sin dorado. Sobre la cabeza del maestro experto se encuentra rodeado por un brillo de un triángulo con el nombre en su centro
Del libro de Caliosa y FranceSonería egipcia. por el autor Kuzmishin E. L.Recepción en el título de estudiante. La decoración de los alojamientos y los dominios y el techo del albergue deben colgarse de la materia azul y blanca sin daños. Sobre la cabeza del maestro experto se encuentra rodeado por un brillo de un triángulo con el nombre "Jehová", bordado en su centro
Del libro autobiografía yoga Autor Yogananda paramyansaCapítulo 23 Obtengo un título universitario: usted ignore las definiciones filosóficas del libro de texto, sin duda, contando con que algunas "intuiciones" sin redondeo lo mantendrán a través de todos los exámenes. Pero si no consulta con urgencia un método más científico, entonces tendré que
Desde el libro de la Cabalá. El mundo más alto. El comienzo del camino Autor Lightman Michael.7.5. El grado de conciencia del mal como se aclaró en el artículo "Torusting", Placer y Bliss están determinados por el grado de similitud del Creador de acuerdo con las propiedades, y el sufrimiento y la impaciencia, el grado de diferencias del Creador. De acuerdo con esto, el egoísmo es repugnante para nosotros e insoportablemente pintura,
Opción 1
1. Determine el grado de oxidación de átomos de elementos químicos en las siguientes conexiones: HNO₃, NO₂, H₃N, SO₂, N₂O.
2. Aprovechando la tabla periódica, coloque los siguientes elementos para reducir la electronegatividad: O, N, BE, B, LI, C. Determine dónde debe ubicarse el flúor y el sodio en esta fila. Explica la respuesta. 
3. ¿Cómo cambia el grado de oxidación del átomo de azufre cuando SO₂ para SO₃? Responder explica la respuesta.
Opcion 2.
1. Determine el grado de oxidación de átomos de elementos químicos en las siguientes conexiones: CO₂, H₃PO₄, SIH₄, P₂O₅, MG₂SI.
2. En la dirección de los átomos de los cuales se desplaza el elemento químico. parejas electrónicas, Moléculas de las siguientes conexiones: BF₃, PCL₃, CS₂, CCL₄, HBR? Dar una respuesta razonable.
3. Si el grado de oxidación de carbono cambia durante la formación ácido coalico H₂CO₃ Dióxido de carbono y agua? Responder explica la respuesta.
Opción 3.
1. Determine el grado de oxidación de átomos de elementos químicos en las siguientes conexiones: CL₂, Naclo, CaCl₂, HF, SO₃, CR₂O₇.
2. Usando sistema periódico Elementos químicos, coloque los siguientes elementos en el orden de aumentar su electronegabilidad: P, AL, CL, NA, S, MG. Encuentra un potasio y flúor en esta fila. Responder explica la respuesta. 
3. ¿Cómo cambia el grado de oxidación de carbono al quemar metano CH₄ con la formación de óxido de carbono (IV) y agua? Responder explica la respuesta.
Opción 4.
1. Determine el grado de oxidación de átomos de elementos químicos en las siguientes conexiones: H₂SO₄, SO₂, NO₂, BF₃, H₂S.
2. Hacia los átomos de los cuales elementos químicos Muestra pares electrónicas generales, en las moléculas de las siguientes conexiones: H₂O, PCL₃, H₃N, H₂S, CO₂? Dar una respuesta razonable.
3. Si los grados de oxidación de los átomos se cambian cuando se cambia el agua de sustancias simples - ¿Hidrógeno y oxígeno? Responder explica la respuesta.


