5. Ионная и металлическая связь. Водородная связь. Валентность
5.3. Водородная связь
К особому виду межмолекулярного взаимодействия относится водородная связь, которая бывает межмолекулярной и внутримолекулярной.
Межмолекулярная водородная связь - это связь между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы.
Внутримолекулярная водородная связь - это связь между положительно поляризованным атомом водорода и отрицательно заряженным другим атомом одной и той же молекулы.
В общем виде образование водородной связи можно представить схемой
где водородная связь, как это принято, показана тремя точками.
Атомы А и В могут быть любыми, но их электроотрицательность должна быть меньше, чем у атомов X и Y. Атомы X и Y - это атомы, электроотрицательность которых гораздо больше, чем у водорода. Как правило, это атомы О, F и N. Таким образом, могут образоваться водородные связи типа:
O–H⋅⋅⋅O (N, F); N–H⋅⋅⋅O (N, F); F–H⋅⋅⋅O (N, F).
Атомы X и Y могут быть одинаковыми (F–H δ+ ⋅⋅⋅F δ− –H) или разными (H 2 N–H⋅⋅⋅OH 2), поэтому водородная связь образуется как между одинаковыми, так и между разными молекулами. Например, межмолекулярная водородная связь образуется между молекулами: воды, карбоновых кислот (рис. 5.3, а , б ), спиртов, фтороводорода и аммиака, но не образуется между молекулами алканов, альдегидов, кетонов и бензола. Водородная связь образуется между молекулами аммиака и воды, воды и спирта, воды и альдегида (рис. 5.3, в ).
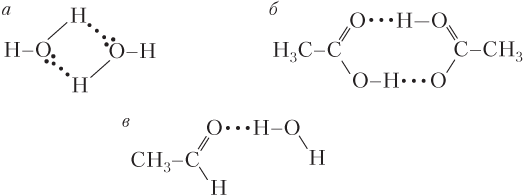
Рис. 5.3. Образование межмолекулярной водородной связи между молекулами:
А - воды; б - уксусной кислоты СН 3 СООН; в - ацетальдегида СН 3 СНО и воды
В случае внутримолекулярной водородной связи между собой связываются различные части одной и той же молекулы.
Примеры образования внутримолекулярной водородной связи показаны на рис. 5.4.

Рис. 5.4. Образование внутримолекулярной водородной связи в молекуле:
А - 2-гидробензальдегида; б - двухатомного спирта этиленгликоля; в - дигидроксибензола (двухатомного фенола); г - 2-аминофенола
Для образования внутримолекулярных водородных связей необходимо, чтобы функциональные группы, содержащие атомы H и X, находились рядом (на сравнительно небольшом расстоянии); в противном случае внутримолекулярная водородная связь не образуется. Например, внутримолекулярная водородная связь не образуется в молекулах, строение которых показано ниже (отметим, что бензольное кольцо плоское и не может изгибаться):

В случае данных молекул образуется межмолекулярная водородная связь.
Соединения с внутримолекулярной связью, как правило, менее растворимы, чем их изомеры; обладают более низкими температурами плавления и кипения; имеют меньшую вязкость в жидком состоянии, так как такие молекулы мало связаны с соседними молекулами. Например, среди трех изомерных нитрофенолов о -нитрофенол хуже растворяется в воде и имеет более низкую температуру кипения, так как только в этой молекуле присутствует внутримолекулярная водородная связь.

Органические кислоты, у которых кислород карбоксильной группы участвует в образовании внутримолекулярной водородной связи, являются более сильными кислотами, чем их изомеры. Водородная связь облегчает отрыв протона из-за перераспределения электронной плотности. Так, среди трех изомеров гидробензойных кислот наиболее сильной является салициловая (первая слева).

Внутримолекулярная водородная связь образуется в белках между группами NH и CO соседних витков спирали, обеспечивая тем самым устойчивость вторичной структуры белка:
Отметим, что водородная связь присутствует и в кислых солях.
Одна из составляющих при образовании водородной связи - электростатическое диполь-дипольное притяжение положительно заряженного атома водорода и отрицательно заряженного атома другой или той же самой молекулы: большая электроотрицательность атомов X и Y (F, О, N) обусловливает возникновение сравнительно больших по величине зарядов на атомах Н и Y и, соответственно, образование водородной связи. Кроме того, образованию водородной связи способствуют малые размеры атома Н, что позволяет атомам подходить достаточно близко. Другая составляющая водородной связи обеспечивается частичным образованием ковалентной связи по донорно-акцепторному механизму, так как атом Y обычно имеет неподеленные пары электронов, а на атоме Н из-за сильной поляризации электронной плотности под влиянием сильноэлектроотрицательного атома X частично освобождается 1s атомная орбиталь (рис. 5.5).
Рис. 5.5. Образование водородной связи между молекулами воды и аммиака по донорно-акцепторному механизму
Благодаря ковалентной составляющей водородная связь направленная и насыщаемая, что во многом определяет строение веществ в конденсированном состоянии. Энергия водородной связи значительно меньше энергии химической связи и составляет 5–40 кДж/моль. Особой прочностью отличаются водородные связи −H⋅⋅⋅F− с участием наиболее электроотрицательного атома фтора. Связь в ассоциатах (HF) 2 настолько прочная, что фтороводородная кислота практически полностью находится в димеризованном состоянии и способна образовывать кислые соли (см. 12.5).
Водородная связь в несколько раз сильнее обычного межмолекулярного взаимодействия и влияет на температуры кипения и плавления веществ, повышая эти константы. Например, чтобы вещество закипело, т.е. перешло из жидкого состояния в газообразное, необходимо разорвать связи между молекулами (но не в самих молекулах!). Понятно, что с повышением прочности межмолекулярных связей из-за образования водородных связей возрастает и температура кипения.
Классической иллюстрацией сказанному служит зависимость температур кипения от молярной массы для водородных соединений неметаллов IVA−VIII-групп (рис. 5.6). В прямо пропорциональную зависимость температуры кипения от массы молекул не укладываются вещества, между молекулами которых образуется водородная связь: вода, аммиак и фтороводород. Для соединений IVA-группы температура кипения с ростом молярной массы закономерно повышается, так как между молекулами водородных соединений элементов данной группы (CH 4 , SiH 4 , GeH 4 и SnH 4) водородные связи не образуются.

Рис. 5.6. Температуры кипения некоторых водородных соединений, элементов VIIA−IVА-групп
Образование водородной связи с молекулами воды повышает растворимость веществ. Например, растворимость этанола C 2 H 5 OH в воде гораздо выше изомерного ему диметилового эфира (CH 3) 2 O, так как только в случае спирта образуются водородные связи с водой.
В случае воды образование водородных связей объясняет не только ее аномально высокие температуры кипения и плавления, но и высокие теплоемкость и диэлектрическую проницаемость, а также аномальную зависимость плотности воды от температуры: плотность твердого льда меньше плотности жидкой воды, поэтому зимой водоемы не промерзают до дна. Благодаря высокой теплоемкости (вода долго нагревается и медленно остывает) вода активно участвует в формировании климата на Земле, перенося теплоту на очень большие расстояния. Из-за высокой диэлектической проницаемости и полярности молекул вода является хорошим ионизирующим растворителем (в воде вещества легко распадаются на ионы).
Пример 5.1. Как изменяется температура кипения в ряду веществ, формулы которых: H 2 , O 2 , Cl 2 ?
Решение. В этом ряду молярная масса веществ последовательно возрастает, поэтому температура кипения повышается.
Ответ : повышается.
Пример 5.2. Укажите ряд, в котором температура кипения веществ повышается:
1) O 3 , O 2 , H 2 O; 3) O 2 , O 3 , H 2 O;2) H 2 O, O 3 , O 2 ; 4) H 2 O, O 2 , O 3 .
Решение. Наибольшую температуру кипения из-за образования водородных связей имеет вода. В случае O 2 и O 3 выше t кип озона (молекулы O 3 имеют большую массу). Искомый ряд - ряд 3).
Ответ : 3).
Пример 5.3. Укажите названия веществ, в молекулах которых образуется внутримолекулярная водородная связь: а) фенол; б) 2-гидроксибензойная кислота; в) ацетальдегид; г) 2-нитрофенол.
Решение. Изобразим структурные формулы молекул указанных веществ:
а)  б)
б)  в) г)
в) г) 
Видим, что внутримолекулярная водородная связь образуется в молекулах 2-гидроксибензойной кислоты и 2-нитрофенола.
Ответ : б), г).
Наиболее известный пример соединения с водородной связью - это вода. Поскольку атом кислорода более электроотрицателен, чем связанные с ним два атома водорода (см. табл. 2.2), он оттягивает связывающие электроны от атомов водорода. Как мы уже знаем, в результате образования такой полярной ковалентной связи возникает диполь. Атом кислорода приобретает небольшой отрицательный заряд а каждый атом водорода - небольшой положительный заряд Этот положительный заряд атома водорода притягивается к неподеленной паре электронов на атоме кислорода соседней молекулы воды (рис. 2.16). Возникающая сила притяжения между атомом водорода и электроотрицательным атомом называется водородной связью. Хотя водородная связь намного слабее ковалентной, она обусловливает целый ряд аномальных свойств воды (см. ниже).
Водородная связь чаще всего образуется с участием атомов таких элементов, как кислород, фтор и азот. Атомы этих элементов имеют высокую электроотрицательность и характеризуются малыми размерами. Водородная связь гораздо слабее с атомами большего размера, как, например, с хлором или серой, хотя по электроотрицательности эти элементы сравнимы с азотом (см. табл. 2.2).
Водородные связи, показанные на рис. 2.17, являются примерами межмолекулярных водородных связей; такие связи возникают между двумя молекулами. Однако водородная связь может осуществляться и внутри одной молекулы (рис. 2.18). Такая связь называется внутримолекулярной водородной связью. Она распространена не столь сильно, как межмолекулярная водородная связь.

Рис. 2.16. Водородная связь в воде.

Рис. 2.17. Межмолекулярная водородная связь.

Рис. 2.18. Внутримолекулярная водородная связь.
Слабые и сильные водородные связи
В настоящее время существует мнение, что есть два типа водородных связей - слабые и сильные. Слабые и сильные водородные связи различаются по длине связи и по энергии связи:

Все водородные связи, показанные на рис. 2.16-2.18, являются примерами слабой или обычной водородной связи. Экспериментальные данные свидетельствуют о том, что сильные водородные связи существуют в следующих ионах:
а также в некоторых органических и неорганических соединениях.
Атом водорода, соединенный с атомом фтора, кислорода или азота (реже - хлора, серы или других неметаллов), может образовывать еще одну дополнительную связь. Это открытие, сделанное в восьмидесятых годах девятнадцатого столетия, связывают с именами русских химиков М.А. Ильинского и Н.Н. Бекетова . Было установлено, что некоторые водородсодержащие группы атомов часто образуют устойчивую химическую связь с электроотрицательными атомами, входящими в состав другой или той же самой молекулы. Такая химическая связь получила название водородной связи.
Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ... В (чертой обозначена ковалентная связь, тремя точками - водородная связь).
Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи. Она может быть описана с помощью метода молекулярных орбиталей как трехцентровая двухэлектронная связь.
Одним из признаков водородной связи может служить расстояние между атомом водорода и другим атомом, ее образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, в которых расстояние Н ... В больше, чем А−В. Однако в редких случаях (фтороводород, некоторые карбоновые кислоты) водородная связь является симметричной. Угол между атомами во фрагменте А−Н ... В обычно близок к 180 o . Наиболее сильные водородные связи образуются с участием атомов фтора. В симметричном ионе − энергия водородная связи равна 155 кДж/моль и сопоставима с энергией ковалентной связи. Энергия водородная связи между молекулами воды уже заметно меньше (25 кДж/моль).
Межмолекулярная и внутримолекулярная водородная связь
Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже - при участии атомов хлора, серы и других неметаллов. Прочные водородные связи образуются в таких жидких веществах, как вода, фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины. При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед).
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений (рис. 42). Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:
а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
Аномалии свойств, обусловленные наличием водородной связи
Наличием водородных связей обусловлены уникальные свойства многих веществ, в том числе воды. Трехатомная молекула Н 2 О образует четыре водородные связи. В их образовании принимают участие оба атома водорода, а атом кислорода, имеющий две неподеленные электронные пары, образует две водородные связи с атомами водорода соседних молекул воды.

Если бы не было водородных связей, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов
Температуры кипения халькогеноводородов
| H 2 Te | H 2 Se | H 2 S | H 2 O | |
| t кип, o С | −2 | −42 | −60 | 100 |
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению.
Водородные связи являются причиной и другого уникального свойства воды - при плавлении ее плотность возрастает. В структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода - из других молекул воды. В результате образуется очень рыхлая "ажурная" структура. Вот почему лед такой легкий.
При плавлении льда около 10% водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда. Дальнейшее нагревание, с одной стороны, должно вызывать увеличение объема воды. Это происходит со всеми веществами.
Но, с другой стороны, водородные связи продолжают разрушаться, а это должно приводить к уменьшению объема воды. В результате плотность воды изменяется неравномерно. Наибольшее значение (1,00 г/мл) она имеет при температуре 4 o С. Такова зимняя температура вблизи дна пресноводных водоемов, где скапливается вода с максимальной плотностью.
При замерзании вода расширяется и занимает больший объем. Плотность льда (0,92 г/мл) - меньше, чем плотность жидкой воды. Поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Наличие водородных связей влияет и на кислотные свойства многих веществ. Фтороводородная кислота, в отличие от других галогеноводородных кислот является слабой так как атомы водорода связаны сразу с двумя атомами фтора, что препятствует их отщеплению (по той же причине большинство карбоновых кислот являются слабыми). Благодаря особо прочным водородным связям фтороводородная кислота - единственная одноосновная кислота, способная образовывать кислые соли, например NaHF 2 .
1.2 Примеры соединений с водородной связью
Во многих случаях, когда имеется сильная связь между молекулами или разными группами одной и той же молекулы, эту связь можно приписать атомам водорода, проявляющим двухвалентный характер. Таковы, например, димеры алифатических кислот, ион дифторида и димер HF, структура которых приведена на рисунке 1.1 .

Рисунок 1.1 Некоторые примеры структур с водородной связью
Водород служит в качестве связующего атома в другом важном классе соединений – бороводородах. Простейшим членом этого семейства является диборан (В 2 Н 6). Однако бороводороды обычно не рассматривают в качестве соединений с водородной связью, так как их нельзя разбить на фрагменты, представляющие собой стабильные молекулы . Рассмотрим эти соединения лишь для того, чтобы сопоставить их с комплексами с водородной связью.
Бороводороды были названы электронодефицитными молекулами (термин электронодефицитный в применении к бороводородам не совсем оправдан, так как во всех случаях электронов достаточно для заполнения всех связывающих молекулярных орбиталей), так как они не имеют достаточно электронов для образования того количества двухэлектронных связей, которое, по-видимому, подразумевается их молекулярной геометрией. Диборан имеет восемь связей В–Н, но только четырнадцать валентных электронов. Расчеты на основе метода молекулярных орбиталей показывают, что концевые связи представляют собой нормальные двухэлектронные связи, а мостиковые связи следует описывать как трехцентровые двухэлектронные связи .
Описание на основе метода молекулярных орбиталей иона дифторида полностью отличается от описания диборана, поскольку для образования мостиковых связей здесь имеются четыре электрона. Равновесная конфигурация молекулы линейная, причем водород находится посредине отрезка F–F. Две наивысшие заполненные молекулярные орбитали образованы в основном 2pσ -орбиталями фтора п ls-орбиталями водорода с некоторой добавкой 2s-орбиталей фтора. Низшая из двух орбиталей имеет симметрию σ g и является связывающей для всех трех атомов. Более высокая орбиталь σ u (ее узел приходится на атом водорода) – разрыхляющая по отношению к атомам фтора. Однако атомы фтора достаточно удалены друг от друга, так что разрыхляющий эффект мал, и орбиталь σ u имеет отрицательную энергию (т. е. связывает электроны), что обусловлено большой электроотрицательностью атома фтора .
Можно преобразовать σ g - и σ u -орбитали в эквивалентные орбитали θ 1 = σ g + σ u и θ 2 = σ g – σ u , локализованные на двух связях F–Н, что демонстрирует отличие от мостиков в бороводородах, орбитали которых не могут быть локализованы на связях .
Ион дифторида не типичен для соединений с водородными связями в том отношении, что атом водорода расположен посредине между двумя тяжелыми атомами. Обычно энергии водородных связей намного меньше, чем для иона дифторида, а водород более тесно связан с одним из атомов, чем с другим, как в димере муравьиной кислоты (рис. 1.1). В действительности геометрия двух компонентов, составляющих комплекс, немного отличается от их геометрии в изолированных состояниях .
Таблица 1.1 Энергии димеризации некоторых газофазных димеров с водородной связью
| Димер | Энергия димеризации, кДж/моль -1 |
| 29±4 | |
| 22±6 | |
| 19±2 | |
| 9±1 | |
| 7±1 |




Обнаружено смещение кислотно-основного равновесия молекулярный комплекс ионная пара вправо при повышении полярности растворителя. Кроме указанных фиксируются и другие структурные и спектроскопические особенности водородных связей, которые используются, с одной стороны, для идентификации последних, а с другой – в расшифровке их электронной природы. Так как водородная связь возникает только в том...





Водородную связь от межмолекулярной. Если спектрально фиксируется образование Н-связей, а признаков ассоциации нет, это верное указание на внутримолекулярный характер водородной связи. Кроме того, межмолекулярная Н-связь (и ее спектральное проявление) исчезает при низкой концентрации вещества в нейтральном растворителе, тогда как внутримолекулярная Н-связь в этих условиях сохраняется. Водородные...
Длин химических связей молекулы растворителя, дипольный момент молекулы растворителя и вязкость, выражается следующим уравнением (2) Коэффициент множественной регрессии составляет КММР = 0,999. В табл. 2 представлены значения энергии водородных связей в различных растворителях, полученные по ур. (1) и (2), в сравнении с литературными данными. Таблица 2 Величины энергии водородных связей...


По их поведению в растворах на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы. Электролитическая диссоциация. ...
Водородная связь - это своеобразная химическая связь. Она возникает между молекулами, в состав которых входит водород и сильно электроотрицательный элемент. Такими элементами являются фтор, кислород, азот, хлор и др.
Природу водородной связи объясняли по-разному. Наибольшее распространение получило электростатическое взаимодействие.
Механизм водородной связи рассмотрим на примере молекулы воды. При образовании полярной ковалентной связи между атомами водорода и атомом кислорода электроны, первоначально принадлежащие атому водорода, сильно смещаются в сторону кислорода. В результате атом кислорода приобретает значительный эффективный отрицательный заряд, а ядро атома водорода с внешней по отношению к атому кислорода стороны почти лишается электронного облака. Между протоном атома водорода и отрицательно заряженным атомом кислорода соседней молекулы воды возникает электростатическое притяжение, что и приводит к образованию водородной связи.
Процесс образования водородной связи на примере двух молекул воды может быть представлен следующей схемой (точками обозначается водородная связь, а знаками σ + , σ – - эффективные заряды атомов):
. . σ+ . . σ–
: О – Н ∙ ∙ ∙ О – Н
׀ ׀
Более правильным следует считать, что в образовании водородной связи принимает участие и донорно-акцепторное взаимодействие. Ведь для этой связи характерны направленность в пространстве и насыщаемость. На это впервые указал Н. Д. Соколов, разработавший квантово-механическую теорию водородной связи.
Согласно донорно-акцепторной теории, водородная связь начинается с электростатического взаимодействия, в результате которого электронная пара атомов водорода еще больше смещается в сторону кислорода, благодаря чему атом водорода как бы «оголяется», другими словами s-орбнталь атома водорода «высвобождается» и становится способной принять неподеленную электронную пару атома кислорода другой молекулы. Поле протона велико и притяжение им электронной пары атома кислорода весьма эффективно, в то время других своих электронов около протона нет, поэтому отталкивание другой молекулы воды в области атома водорода сильно понижается.
Этот механизм объясняет, почему только водород способен образовывать водородную связь. У всякого другого атома при освобождении орбитали ядро не «оголяется» и внутренние оболочки обеспечивают отталкивание от электронных оболочек второй молекулы.
Рассмотренный механизм образования водородной связи требует, чтобы атом элемента, соединяясь с водородом, обладал высокой относительной электроотрицательностью и имел в наличии неподеленную электронную пару. Только при этом условии электронное облако атома водорода достаточно сильно сместится в сторону атома партнера. Таким образом, химическая связь, образованная положительно поляризованным водородом молекулы А-Н (или полярной группы-А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью.
Образование водородной связи обусловлено тем, что в полярных молекулах А-Н или полярных группах -А-Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностьюи очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Электростатическая модель образования водородных связей верна только в первом приближении, поскольку энергетически дополнительное связывание атома водорода должно иметь химическую природу. Метод валентных связей не может объяснить образование дополнительной связи атома Н, так как атом водорода одновалентен. Метод молекулярных орбиталей в его многоцентровом варианте дает следующее объяснение образования водородной связи. При сближении атома Н, ковалентно связанного с атомом электроотрицательного элемента А δ- - Н δ+ , с другим атомом также электроотрицательного элемента В δ- возникает трехцентровая связывающая молекулярная орбиталь, пребывание в которой электронной пары атома В более выгодно, чем на атомной орбитали этого же атома.
Обычно водородную связь обозначают точками и этим указывают, что она слабее ковалентной связи (примерно в 15-20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димеров уксусной кислоты можно представить схемой агрегаций молекул за счет водородных связей:
1.Образование зигзагообразных цепей в жидком фтороводороде HF:
2. Образование гидрата аммиака NН 3 ∙ Н 2 О при растворении аммиака в воде:
Н – N ∙ ∙ ∙ H – O
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Основные законы и понятия химии
Раздел химии, рассматривающий количественный состав веществ и количественные соотношения (массовые, объемные) между реагирующими веществами, называется стехиометрией. В соответствии с этим,
Химическая символика
Современные символы химических элементов были введены в 1813 г. Берцелиусом. Элементы обозначаются начальными буквами их латинских названий. Например, кислород (Oxygenium) обозначается буквой О, се
Латинские корни некоторых элементов
Порядковый номер в таблице периодической системы
Символ
Русское
название
Латинский корень
Групповые названия элементов
Название группы элементов
Элементы группы
Благородные газы
He, Ne, Ar, Kr, Xe, Rn
Галогены
Названия наиболее часто употребляемых кислот и кислотных остатков
Формулы кислоты
Название кислоты
Формула
кислотного
остатка
Название кислотного остатка
Кислородные кислоты
Получение кислот
1 . Взаимодействие кислотных оксидов (большинства) с водой:
SO3 + Н2О=H2SO4;
N2O5 + Н2
Номенклатура неорганических соединений (по правилам ИЮПАК)
ИЮПАК – международный союз теоретической и прикладной химии. Правила ИЮПАК 1970 г. являются международной моделью, по которой создаются номенклатурные правила для химических соединений на языке соо
Первые модели атома
В 1897 г. Дж. Томсон (Англия) открыл электрон, а в 1909г. Р. Малликен определил его заряд, который равен 1,6 · 10-19 Кл. Масса электрона составляет 9,11 · 10-28 г. В
Атомные спектры
При нагреве вещество испускает лучи (излучение). Если излучение имеет одну длину волны, то оно называется монохроматическим. В большинстве же случаев излучение характеризуется неско
Кванты и модель Бора
В 1900 г. М. Планк (Германия) высказал предположение, что вещества поглощают и испускают энергию дискретными порциями, названными им квантами. Энергия кванта Е пропорциональна частоте излучения (ко
Двойственная природа электрона
В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную (корпускулярно-волновую
Энергетические подуровни
Орбитальное квантовое число l
Форма электронного облака в подуровне
Изменение энергии элект-ронов в преде-лах уровня
Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
Квантовый
Магнитное квантовое число ml
Число кванто-вых состояний (орбиталей)
Максимальное число электронов
Изотопы водорода
Изотоп
Заряд ядра (порядковый номер)
Число элект-ронов
Атомная масса
Число нейтронов
N=A-Z
Протий
Периодическая система элементов Д.И. Менделеева и электронная структура атомов
Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов. У каждого последующего элемента периодической системы на один электрон больше, чем у предыдущ
Электронные конфигурации элементов первых двух периодов
Атом-ный номер
Элемент
Электрон-ные кон-фигурации
Атом-ный номер
Элемент
Электрон-ные кон-фигурации
Электронные конфигурации элементов
Пе-риод
Поряд-ковый номер
Эле-мент
Элект-ронная конфи-гурация
Пе-риод
Поряд-ковый номер
Эле-мент
Периодические свойства элементов
Так как электронное строение элементов изменяется периодически, то соответственно периодически изменяются и свойства элементов, определяемые их электронным строением, такие как энергия ионизации,
Электроотрицательность элементов по Полингу
Н
2,1
&
Степени окисления мышьяка, селена, брома
Элемент
Степень окисления
Соединения
высшая
низшая
Сокращенные и полные уравнения ядерных реакций
Сокращенные уравнения
Полные уравнения
27Al(p,
Определение химической связи
Свойства веществ зависят от их состава, строения, от типа химической связи между атомами в веществе. Химическая связь имеет электрическую природу. Под химической связью понимают вид
Ионная связь
При образовании любой молекулы, атомы этой молекулы «связываются» друг с другом. Причина образования молекул состоит в том, что между атомами в молекуле действуют электростатические силы. Образова
Ковалентная связь
Химическая связь, осуществляемая за счет перекрывания электронных облаков взаимодействующих атомов, называется ковалентной связью.
4.3.1. Неполярная ковале
Метод валентных связей (МВС, ВС)
Для глубокого понимания сущности ковалентной связи, характера распределения электронной плотности в молекуле, принципов построения молекул простых и сложных веществ необходим метод валентных связей
Метод молекулярных орбиталей (ММО, МО)
Хронологически метод МО появился позже метода ВС, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом ВС. Укажем некоторые из них.
Как
Основные положения ММО, МО.
1. В молекуле все электроны являются общими. Сама молекула - это единое целое, совокупность ядер и электронов.
2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно
Гибридизация орбиталей и пространственная конфигурация молекул
Тип молекулы
Исходные орбитали атома А
Тип гибридизации
Число гиб-ридных ор-биталей атома А
Пр
Металлическая связь
Само название говорит, что речь пойдет о внутренней структуре металлов. Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов. Так, по одному электрону со
Взаимодействия между молекулами
При сближении молекул появляется притяжение, что обусловливает возникновение конденсированного состояния вещества. К основным видам взаимодействия молекул следует отнести вандерваальсовы силы, во
Вклад отдельных составляющих в энергию межмолекулярного взаимодействия
Ве-щест-во
Элект-ричес-кий момент диполя, D
Поля-ризуе-мость, м3∙1030
Энергия взаимодействия, кДж/м
Общие понятия
При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция. Состояние системы характеризуется термодинами-ческими параметрами (р, Т, с и др.)
Внутренняя энергия. Первый закон термодинамики
При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощение
Энтальпия системы. Тепловые эффекты химических реакций
Теплота Q и работа A функциями состояния не являются, ибо они служат формами передачи энергии и связаны с процессом, а не с состоянием системы. При химических реакциях А - это работа против внешнег
Термохимические расчеты
Термохимические расчеты основаны на законе Гесса, позволяющее рассчитать энтальпию химической реакции: тепловой эффект реакции зависит только от природы и физического состояния исходных веществ
Стандартные теплоты (энтальпии) образования
некоторых веществ
Вещест-во
Химическое сродство. Энтропия химических реакций. Энергия Гиббса
Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты.
Реакция, идущая при данной температуре с выделением теплоты, при другой температу
Второй и третий законы термодинамики
Для систем, которые не обмениваются с окружающей средой ни энергией, ни веществом (изолированные системы), второй закон термодинамики имеет следующую формулировку: в изолированных системах само
Понятие о скорости химических реакций
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (в случае гомогенных реакций) или на единице поверхности раздела фаз (в
Зависимость скорости реакции от концентрации реагентов
Чтобы атом и молекулы смогли вступить в реакцию, необходимо их столкновение друг с другом, так как силы химического взаимодействия действуют только на очень малом расстоянии. Чем больше молекул реа
Влияние температуры на скорость реакции
Зависимость скорости реакции от температуры определя-ется правилом Вант-Гоффа, согласно которому при повыше-нии температуры на каждые 10 градусов скорость большин-ства реакций увеличивается в 2-
Энергия активации
Быстрое изменение скорости реакции с изменением температуры объясняет теория активации. Почему нагревание вызывает столь значительное ускорение химических превращений? Для ответа на этот вопрос нуж
Понятие о катализе и катализаторах
Катализом называется изменение скорости химических реакций в присутствии веществ – катализаторов. Катализаторы – это вещества, изменяющие скорость реакции за счет участия в промежуточном хим
Химическое равновесие. Принцип Ле Шателье
Реакции, которые протекают в одном направлении и идут до конца, называются необратимыми. Их не так много. Большинство реакций являются обратимыми, т.е. они протекают в противоположных направ
Способы выражения концентрации растворов
Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Различают массовую, молярную (мольно-объемную), мо
Коллигативные свойства растворов
Коллигативными являются свойства растворов, которые зависят от концентрации и практически не зависят от природы растворенных веществ. Они также называются общими (коллективными). Т
Растворы электролитов
Примерами растворов электролитов могут служить растворы щелочей, солей и неорганических кислот в воде, растворы ряда солей и жидком аммиаке и некоторых органических растворителях, например ацетонит
В растворах при 298 К
Концентрация, моль/1000г Н2О
Коэффициент активности для электролитов
NaCl
KCl
NaOH
KOH
Гидролиз солей
Химическое обменное взаимодействие ионов растворен-ной соли с водой, приводящее к образованию слабодисcоци-ирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основн
Константы и степени диссоциации некоторых слабых электролитов
Электролиты
Формула
Численные значе-ния констант диссоциации
Степень диссо-циации в 0,1 н. растворе, %
Азотистая кислот
Процессы
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ.
Валентности и степени окисления атомов в некоторых соединениях
Моле-кула
Ион-ность связи, %
Атом
Кова-лент-ность
Электро-валент-ность
Валент-ность:
v = ve
Окислительно-восстановительные реакции
Рассмотрим основные положения теории окислительно-восстановительных реакций.
1. Окислением называют процесс отдачи электронов атомом, молекулой или ионом. Степень окисления при этом
Важнейшие восстановители и окислители
Восстановители
Окислители
Металлы, водород, уголь
Оксид углерода (II) СО
Сероводород H2S, сульфид натрия Na2S, оксид се
Составление уравнений окислительно-восстановительных реакций
Для составления уравнений окислительно-восстанови-тельных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
Определение комплексных соединений
Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения обычные, или соединения первого по
Лиганды
К числу лигандов относятся простые анионы, такие как F-, СI-, Вr-, I-, S2-, сложные анионы, например CN– , NCS – , NO
Номенклатура комплексных соединений
Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом с указани
Диссоциация комплексных соединений
Комплексные соединения - неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует внешняя сфера комплекса, например: , ,"de":["En2hkTeICrc","En2hkTeICrc","En2hkTeICrc","En2hkTeICrc","rzrq7riuUSE"],"es":["C76wGduAQP8","C76wGduAQP8","WU4xT8ecrSE","oksYIKipDD0","C76wGduAQP8","2_KTmmW2wpM","ImVKdZx09AA"],"pt":["ozZ806dN3Rc","5r4KUPUjgkA","aQG7yywU1r8","aQG7yywU1r8"],"fr":["rDDvp8NXnP8","gKZE6yp4fHw"],"it":["Ck9n2PWuar8","kynaWqJmsA8"],"cs":["ZEf0zmwY9cU"],"pl":["dzKyViGlBpM","dzKyViGlBpM","dzKyViGlBpM"],"ro":["Nj1zG9UN7zQ","Nj1zG9UN7zQ"],"el":["X0H70YSWnrE"]}


