Cтраница 1
Атомная связь рассматривается с точки зрения электронной зонной структуры. Такой подход, хотя он и сложнее, чем использованный в опубликованных ранее монографиях, необходим для более глубокого понимания проблемы. Хотя предлагаемые зонные структуры все еще спорны, они нашли экспериментальное подтверждение; следовательно, сопоставление определенных свойств с различными зонными моделями может способствовать созданию фактической картины связей в этих соединениях.
Атомная связь возникает между атомами за счет обобществления отдельных электронов, находящихся во внешних оболочках этих атомов. В данном случае между двумя атомами образуются как бы мостики из пар электронов, принадлежащих одновременно обоим атомам и связывающих их. Атомная связь характеризуется более или менее значительной электронной плотностью на всем протяжении между атомами.
Атомная связь, называемая ковалентной, также обусловлена образованием восьмиэлектронных оболочек, но не за счет потери или приобретения электронов в оболочке атома, а за счет совместного использования их двумя соседними атомами.
Атомная связь возникает между одинаковыми атомами в результате особого квантовомеханического эффекта, называемого обменным эффектом. Обменные силы возникают при кулоновском взаимодействии между атомами, в результате обмена тождественных электронов. Важнейшей особенностью обменных сил является их резкая зависимость от направления спинов электронов, осуществляющих связь между взаимодействующими атомами. Связь будет сильной только в том случае, если спины антипараллельны. Второй важнейшей особенностью обменных сил является то, что они обладают свойством насыщения. Это означает, что они осуществляются лишь парой электронов. Добавление третьего электрона не приводит к увеличению связи, так как в этом случае два электрона будут иметь параллельные спины. В силу этого атомная связь называется парно-электронной связью.
Атомная связь осуществляется, например, в кристаллах алмаза и кремния. В таких кристаллах невозможно выделить отдельные молекулы: весь кристалл представляет гигантскую молекулу. Алмаз построен из атомов углерода с 5р3 - гибридными орбиталями.
Атомная связь, не являющаяся чистой ковалентной, характеризуется по методу молекулярных орбит тем же приведенным выше уравнением, однако с той существенной разницей, что Д уже не равна единице.
Атомная связь характеризуется наличием у двух связанных атомов общей пары электронов или нескольких о бщих пар электронов.
Атомная связь возникает между атомами кристаллической решетки в результате особого квантовомеханического эффекта, называемого обменным эффектом. Обменные силы являются результатом взаимодействия атомов, которое приводит к обобщению их электронов, к обмену электронами.
Атомная связь образуется за счет особых валентных сил, физическая природа которых была раскрыта квантовой механикой. При образовании атомной связи, например между двумя атомами водорода в молекуле Н2, не происходит передачи электрона. Атомные связи, иначе называемые г о м е о п о л я р н ы м и, могут образовываться также между атомами разных элементов.
Атомная связь, ионная связь и металлическая связь являются видами химической связи. Между этими граничными формами химической связи имеются переходные формы. С помощью таблицы электроотрицательности можно (за немногими исключениями) определить, преобладает ли в связи между двумя элементами главной подгруппы атомная связь или ионное взаимодействие.
Атомная связь имеется не только в молекулах простых веществ, но и в молекулах соединений металлоидов друг с другом.
Типичная ковалентная атомная связь образуется между атомами одного и того же элемента или атомами элементов, близких по своим химическим свойствам, например при соединении неметаллов одной и той же группы периодической системы. Когда химическая связь образована между атомами одного и того же элемента, общая электронная пара с одинаковой силой притягивается ядрами обоих атомов: она симметрично расположена по отношению к обоим ядрам. В этом случае общее электронное облако связи распределено равномерно в поле обоих ядер. Ковалентная связь, осуществляемая парой электронов, симметрично расположенной в поле обоих ядер, получила название неполярной.
При взаимодействии атомов между ними может возникать химическая связь, приводящая к образованию устойчивой многоатомной системы: молекулы, молекулярного иона, кристалла. Условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих атомов. Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла.
3.1. Теория химического строения
Крупным шагом в развитии представлений о строении молекул явилась теория химического строения, выдвинутая в 1861 г. выдающимся русским химиком А. М. Бутлеровым.
Основу теории, разработанной А. М. Бутлеровым, составляют следующие положения:
¨ Атомы в молекулах соединены друг с другом в определенной последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
¨ Соединение атомов происходит в соответствии с их валентностью.
¨ Свойства веществ зависят не только от их состава, но и от их «химического строения», т. е. от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
Таким образом, согласно теории Бутлерова свойства веществ определяются не только их качественным и количественным составом, но и внутренней структурой молекул, определенным порядком соединения между собой атомов, образующих молекулу. Эту внутреннюю структуру Бутлеров называл «химическим строением». Особенно важной была идея Бутлерова о том, что атомы, соединяясь в определенной последовательности в соответствии с их валентностью, взаимно влияют друг на друга таким образом, что частично изменяется их собственная природа, их «химическое содержание». Так, свойства атома водорода существенно меняются в зависимости от того, соединен ли он с атомом хлора (в молекуле НСl ), кислорода (в молекуле H 2 O ) или азота (в молекуле N Н 3).
Теория Бутлерова дает возможность изображать строение молекул в виде структурных формул, в которых указана последовательность соединения атомов друг с другом, а каждая черточка, соединяющая атомы, обозначает единицу валентности. Так, строение молекул хлористого водорода (НСl ), хлорноватистой (НСlO ) и хлорноватой (НClO 3) кислот выражается следующими структурными формулами:
Эти формулы прежде всего показывают, что только в молекуле НСl атом водорода непосредственно связан с атомом хлора, тогда как в молекулах НСlO и НClO 3 он соединен не с хлором, а с атомом кислорода. Кроме того, структурная формула хлорноватой кислоты указывает на неравноценность атомов кислорода; в ее молекуле каждый из двух атомов кислорода соединен с атомом хлора двумя валентными связями, а третий связан одновременно с атомами хлора и водорода.
Позволяют понять причину различий в некоторых свойствах ортофосфорной (Н 3 РО 4), фосфористой (Н 3 РО 3) и фосфорноватистой (Н 3 РО 2) кислот. Молекулы каждой из этих кислот содержат по три атома водорода. Приведем их структурные формулы:


Как видно, в молекуле ортофосфорной кислоты каждый атом водорода соединен с атомом кислорода. Все эти атомы водорода способны замещаться атомами металлов: поэтому Н 3 РO 4 трехосновна. В молекуле фосфористой кислоты только два атома водорода непосредственно связаны с атомами кислорода и способны замещаться атомами металлов: эта кислота двухосновна. В молекуле же фосфорноватистой кислоты с атомом кислорода связан лишь один атом водорода, что и обусловливает ее одноосновность. Изображение химического строения молекул с помощью структурных формул особенно важно при изучении органических веществ.
Структурные формулы отражают лишь последовательность соединения атомов друг с другом, а не взаимное расположение атомов в пространстве. Изображение химического строения с помощью структурных формул допустимо только для веществ, состоящих из молекул. Между тем многие вещества состоят не из молекул, а из атомов (например карбид кремния SiC ) или имеют ионное строение (например хлорид натрия NaCl ). Структура подобных веществ определяется типом их кристаллической решетки и будет подробнее рассмотрена в гл. 6.
![]()
3.2. Ковалентная связь. Метод валентных связей
Квантово-механическое описание строения молекул получают, как и в случае многоэлектронных атомов, лишь на основе приближенных решений уравнения Шредингера. Впервые подобный приближенный расчет был произведен в 1927 г. В. Гейтлером и Ф. Лондоном для молекулы водорода. Они сначала рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга. При этом условии можно учитывать только взаимодействие каждого электрона со «своим» ядром, а всеми остальными взаимодействиями (взаимным отталкиванием ядер, притяжением каждого электрона к «чужому» ядру, взаимодействием между электронами) можно пренебречь. Тогда оказывается возможным выразить зависимость волновой функции рассматриваемой системы от координат и тем самым определить плотность общего электронного облака в любой точке пространства. Далее Гейтлер и Лондон предположили, что найденная ими зависимость волновой функции от координат сохраняется и при сближении атомов водорода. При этом, однако, необходимо уже учитывать и те взаимодействия (между ядрами, между электронами и т. д.), которыми при значительном удалении атомов друг от друга можно было пренебрегать. Эти дополнительные взаимодействия рассматриваются как некоторые поправки («возмущения») к исходному состоянию электронов в свободных атомах водорода. В результате Гейтлер и Лондон получили уравнения, позволяющие найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. При этом оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов (рис. 3.1, кривая а) сближение атомов приводит к непрерывному возрастанию энергии системы. В этом случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически невыгодным и химическая связь между атомами не возникает. При противоположно направленных спинах (рис. 3.1, кривая б) сближение атомов до некоторого расстояния r 0 сопровождается уменьшением энергии системы. При r = r 0 система обладает наименьшей потенциальной энергией, т. е. находится в наиболее устойчивом состоянии; дальнейшее сближение атомов вновь приводит к возрастанию энергии. Но это и означает, что в случае противоположно направленных спинов атомных электронов образуется молекула Н 2 - устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов (рис. 3.2). Вследствие такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков. Это притяжение преобладает над взаимным отталкиванием одноименно заряженных электронов, так что в результате образуется устойчивая молекула.

Рис. 3.1. Энергия системы, состоящей из двух атомов водорода

Рис. 3.2. Схема перекрывания атомных электронных облаков в молекуле водорода
Полученные Гейтлером и Лондоном расчетные значения межъядерного расстояния и энергии связи в молекуле водорода оказались близки к экспериментально найденным величинам. Это означало, что приближения, использованные Гейтлером и Лондоном при решении уравнения Шредингера, не вносят существенных ошибок и могут считаться оправданными. Таким образом, исследование Гейтлера и Лондона позволяло сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам. Процесс «спаривания» электронов при образовании молекулы водорода может быть изображен следующей схемой:

Волнистые линии на схеме показывают, что в молекуле водорода каждый электрон занимает место в квантовых ячейках обоих атомов, т. е. движется в силовом поле, образованном двумя силовыми центрами - ядрами атомов водорода. Такая двухэлектронная двухцентровая связь называется ковалентной связью.
Представления о механизме образования химической связи, развитые Гейтлером и Лондоном на примере молекулы облаков в молекуле водорода, были распространены и на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). Метод ВС дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул.
В основе метода ВС лежат следующие положения:
¨ Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
¨ Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
При оценке степени перекрывания электронных облаков следует учитывать знаки волновых функций электронов. Некоторые возможные варианты перекрывания электронных облаков с указанием знаков соответствующих волновых функций изображены на рис. 3.3.
 |
|||
| а | б | в | г |
Рис. 3.3. Схема перекрывания электронных облаков: а, б – положительное перекрывание; в – отрицательное перекрывание; г - суммарное перекрывание, равное нулю
Схематическое описание ковалентных связей в химических соединениях при помощи формул, в которых валентные электроны изображаются точками, было предложено в 1916 г. Дж. Льюисом. И хотя современное толкование химической связи основывается на гораздо более глубоких представлениях, электронно-точечные формулы по-прежнему остаются удобными обозначениями. Электроны, находящиеся во внешнем электронном слое, обозначают точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек. Применяя эти обозначения, образование молекулы водорода можно представить следующим образом: Н + Н → Н:Н
Эта схема показывает, что при соединении двух атомов водорода в молекулу каждый из атомов приобретает устойчивую двухлектронную оболочку.
Два атома фтора в молекуле F 2 обобществляют одну пару электронов, в результате чего каждый атом F приобретает электронную структуру Ne :
 или
или
Необобществленные пары электронов, имеющиеся у атомов F , называют неподеленными парами; они представляют собой электроны со спаренными спинами, заполняющие орбитали и не принимающие участия в образовании связей.
На примере Н 2 и F 2 можно понять, что происходит во многих молекулах, где электронные пары образуют связи, в результате чего каждый атом приобретает замкнутую электронную оболочку. Для построения замкнутой электронной оболочки атому водорода требуются два электрона, которые заполнят его валентную 1s -орбиталь. Каждому атому элемента второго периода требуется для создания замкнутой электронной оболочки восемь электронов (восьмерка-октет), потому что на 2s - и 2р -орбиталях размещается до восьми электронов (2s 2 2p 6 ). Это требование получило название правила октета. В примере с молекулой F 2 каждый атом F после образования связи оказывается окруженным восемью электронами.
Если теперь построить молекулу О 2 таким же способом, как и F 2 , то вокруг каждого атома кислорода окажется только по семь электронов, причем один из них - неспаренный:
 или
или
Из этого затруднительного положения можно выйти, предположив, что атомы кислорода обобществляют две пары электронов:
Таким образом, между двумя атомами кислорода в молекуле О 2 имеется двойная связь. Чтобы каждый атом азота в молекуле N 2 приобрел электронную конфигурацию благородного газа, должна осуществляться тройная связь:
![]() или
или
Строение молекул некоторых сложных веществ - аммиака, воды, диоксида углерода и метана - можно изобразить схемами:

В молекуле аммиака каждый из трех атомов водорода связан с атомом азота парой общих электронов (один электрон от атома водорода, другой - от атома азота). Из приведенных схем видно, что каждая пара электронов, связывающих два атома, соответствует одной черточке, изображающей валентную связь в структурных формулах:
Число таких общих электронных пар, связывающих атом данного элемента с другими атомами, или, иначе говоря, число образуемых атомом ковалентных связей, называется ковалентностью элемента в соответствующем соединении.
Существуют молекулы и ионы, для которых можно записать больше одной удовлетворительной льюисовой структуры. Например, нитрит-ион NO 2 - можно описать одной из двух следующих структур:
 или
или 
Каждая из этих структур подчиняется правилу октета. Если бы «правильной» была только одна из этих двух структур, то в нитрит-ионе оказались бы неодинаковые связи азот-кислород: одна простая и одна двойная. Двойные связи должны быть короче простых связей между теми же атомами, но структурные исследования NO 2 показывают, что обе связи азот- кислород неразличимы.
Рассмотрение NO 2 и многих других молекул и ионов показывает, что используемая нами простая схема подсчета электронов и их отнесения к валентным оболочкам атомов в качестве связывающих или неподеленных пар не вполне удовлетворительна. Эту простую модель можно легко видоизменить таким образом, чтобы она охватывала многие более сложные случаи. В примере с NO 2 - суть проблемы заключается в том, что этот ион в действительности более симметричен, чем каждая из двух записанных для него выше льюисовых электронных структур. И если наложить друг на друга изображения этих структур, можно получить новую структуру, обладающую такой же симметрией, что и сама молекула. Метод наложения структур аналогичен такому способу записи структур:

Такая структура означает следующее: NO 2 - является симметричным ионом и каждая из его связей азот-кислород имеет частично двоесвязный характер. Для некоторых целей такая структура дает достаточную информацию. Однако подсчет числа электронов в подобных структурах требует использования специальных обозначений. Но гораздо чаще вместо изображения наложенных друг на друга эквивалентных льюисовых структур записывают две или большее число таких структур (называемых резонансными структурами ) и соединяют их символом ↔, который означает наложение указанных структур и дает правильное описание молекулы. Применительно к NO 2 - такая запись выглядит следующим образом:
Двусторонняя стрелка не означает, что молекула или ион совершает беспрерывные переходы между двумя структурами. Она лишь говорит о том, что электронная формула NO 2 - представляет собой нечто среднее между двумя резонансными структурами - их гибрид. Если для молекулы или иона можно записать две или несколько резонансных структур, электронная формула такой частицы рассматривается как резонансный гибрид этих структур.
Для молекулы бензола С 6 Н 6 , имеющей шесть атомов углерода, которые соединены в кольцо, также можно записать две одинаково удовлетворительные структуры:

Обе резонансные структуры показывают, что кольцо должно быть образовано чередующимися простыми и двойными связями. Однако структурные исследования обнаруживают, что все углерод-углеродные связи имеют одинаковую длину, как и следует ожидать для резонансного гибрида двух структур. Полную симметрию молекулы бензола можно изобразить при помощи одной структуры со специальным пунктирным обозначением:
3.3. Способы образования ковалентной связи
Общая электронная пара, осуществляющая ковалентную связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных взаимодействующих атомах. Это происходит, например, при образовании таких молекул, как Н 2 , НС1, Cl 2 . Здесь каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара - возникает ковалентная связь. В невозбужденном атоме азота имеются три неспаренных электрона:

Следовательно, за счет неспаренных электронов атом азота может участвовать в образовании трех ковалентных связей. Это и происходит, например, в молекулах N 2 или N Н 3 , в которых ковалентность азота равна 3. Однако число ковалентных связей может быть и больше числа имеющихся у невозбужденного атома неспаренных электронов. Так, в нормальном состоянии внешний электронный слой атома углерода имеет структуру, которая изображается схемой:

За счет имеющихся неспаренных электронов атом углерода может образовать две ковалентные связи. Между тем для углерода характерны соединения, в которых каждый его атом связан с соседними атомами четырьмя ковалентными связями. Это оказывается возможным благодаря тому, что при затрате некоторой энергии можно один из имеющихся в атоме 2s -электронов перевести на подуровень 2р ; в результате атом переходит в возбужденное состояние, а число неспаренных электронов возрастает. Теперь во внешнем электронном слое атома углерода находятся четыре неспаренных электрона. Если возбуждение атома, приводящее к увеличению числа неспаренных электронов, связано с очень большими затратами энергии, то эти затраты не компенсируются энергией образования новых связей; тогда этот процесс в целом оказывается энергетически невыгодным. Так, атомы кислорода и фтора не имеют свободных орбиталей во внешнем электронном слое:

Здесь возрастание числа неспаренных электронов возможно только путем перевода одного из электронов на следующий энергетический уровень, т. е. в состояние 3s . Однако такой переход сопряжен с очень большой затратой энергии, которая не покрывается энергией, выделяющейся при возникновении новых связей. Поэтому за счет неспаренных электронов атом кислорода может образовать не больше двух ковалентных связей, а атом фтора - только одну.
Во многих случаях ковалентные связи возникают и за счет спаренных электронов, имеющихся во внешнем электронном слое атома. Рассмотрим, например, электронную структуру молекулы аммиака:
Здесь точками обозначены электроны, первоначально принадлежавшие атому азота, а крестиками - принадлежавшие атомам водорода. Из восьми внешних электронов атома азота шесть образуют три ковалентные связи и являются общими для атома азота и атомов водорода. Но два электрона принадлежат только азоту и образуют неподеленную электронную пару. Такая пара электронов тоже может участвовать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое этого атома есть свободная орбиталь. Незаполненная ls -орбиталь имеется, например, у иона водорода Н + , вообще лишенного электронов:
Поэтому при взаимодействии молекулы NH 3 с ионом водорода между ними возникает ковалентная связь; неподеленная пара электронов атома азота становится общей для двух атомов, в результате чего образуется ион аммония NH 4 + :

Здесь ковалентная связь возникла за счет пары электронов, первоначально принадлежавшей одному атому (донору электронной пары), и свободной орбитали другого атома (акцептора электронной пары).
Такой способ образования ковалентной связи называется донорно-акцепторным . В рассмотренном примере донором электронной пары служит атом азота, а акцептором - атом водорода.
3.4. Направленность ковалентной связи
Свойства молекулы, ее способность вступать в химическое взаимодействие с другими молекулами зависят не только от прочности химических связей в молекуле, но в значительной мере и от ее пространственного строения. Раздел химии, изучающий геометрическую структуру молекул, их пространственное строение, называется стереохимией. Выше уже говорилось, что образование ковалентной связи является результатом перекрывания валентных электронных облаков взаимодействующих атомов. Но такое перекрывание возможно только при определенной взаимной ориентации электронных облаков; при этом область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью.
Так, в молекуле водорода перекрывание атомных s -электронных облаков происходит вблизи прямой, соединяющей ядра взаимодействующих атомов. Образованная подобным образом ковалентная связь называется σ-связью (сигма-связь ).
В образовании σ-связи могут принимать участие и р -электронные облака, ориентированные вдоль оси связи. Так, в молекуле HF (рис. 3.4, а) ковалентная σ-связь возникает вследствие перекрывания 1s -электронного облака атома водорода и 2p -электронного облака атома фтора. Химическая связь в молекуле F 2 (рис. 3.4, б) тоже σ-связь; она образована 2р -электронными облаками двух атомов фтора.
При взаимодействии p -электронных облаков, ориентированных перпендикулярно оси связи (рис. 3.5), образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется π-c вязь ю.
|
|
|
| а | б |
Рис. 3.4. Схемы перекрывания электронных облаков при образовании молекул: а – HF , б – F 2

Рис. 3.5. Схемы перекрывания p -электронных облаков при образовании π-c вязи
Рассмотрим образование молекулы азота N 2 . Каждый атом азота обладает тремя неспаренными 2p -электронами, электронные облака которых ориентированы в трех взаимно перпендикулярных направлениях.
На рис. 3.6 изображено перекрывание р -электронных облаков в молекуле N 2 (для удобства изображения перекрывание р х -, р у - и р z -облаков показано раздельно). Атомы азота связаны в молекуле N 2 тремя ковалентными связями. Но эти связи неравноценны: одна из них σ-связь, а две другие π-связи. Вывод о неравноценности связей в молекуле азота подтверждается тем, что энергия их разрыва различна.

Рис. 3.6. Схемы перекрывания 2p -электронных облаков в молекуле N 2: а – σ-c вязь, б,в - π-c вязи
Представление о направленности ковалентных связей позволяет объяснить взаимное расположение атомов в многоатомных молекулах. Так, при образовании молекулы воды электронные облака двух неспаренных 2p -электронов атома кислорода перекрываются с 1s -электронными облаками двух атомов водорода; схема этого перекрывания изображена на рис. 3.7, а. Поскольку р -электронные облака атома кислорода ориентированы во взаимно перпендикулярных направлениях, то молекула Н 2 О имеет, как показано на рис. 3.7, а, угловое строение, причем можно ожидать, что угол между связями О-Н будет составлять 90°.
Молекула NH 3 , образующаяся при взаимодействии трех р -электронов атома азота с s -электронами трех атомов водорода (рис. 3.7, б), имеет структуру пирамиды, в вершине которой находится атом азота, а в вершинах основания - атомы водорода. И в этом случае можно ожидать, что углы между связями N-Н будут равны 90°.
Эти выводы о взаимном расположении атомов в молекулах NH 3 и Н 2 О соответствуют действительности. Однако углы между связями (валентные углы) отличаются от 90°: в молекуле воды угол НОН составляет 104,5°, а в молекуле аммиака угол HNH равен 107,3°. Для объяснения отличия валентных углов в молекулах от 90° следует принять во внимание, что устойчивому состоянию молекулы отвечают такая ее геометрическая структура и такое пространственное расположение электронных облаков внешних оболочек атомов, которым отвечает наименьшая потенциальная энергия молекулы.


Рис. 3.7. Схемы образования химических связей в молекулах: а – воды, б – аммиака
![]()
Это приводит к тому, что при образовании молекулы формы и взаимное расположение атомных электронных облаков изменяются по сравнению с их формами и взаимным расположением в свободных атомах. В результате достигается более полное перекрывание валентных электронных облаков и, следовательно, образование более прочных ковалентных связей. В рамках метода валентных связей такая перестройка электронной структуры атома рассматривается на основе представления о гибридизации атомных орбиталей.
3.5. Гибридизация атомных электронных орбиталей
Метод гибридизации атомных орбиталей исходит из предположения, что при образовании молекулы вместо исходных атомных s ; p - и d -электронных облаков образуются такие равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии. Но более полное перекрывание валентных электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии. Если этот выигрыш энергии достаточен, чтобы с избытком скомпенсировать затраты энергии на деформацию исходных атомных электронных облаков, такая гибридизация приводит в конечном счете к уменьшению потенциальной энергии образующейся молекулы и, следовательно, к повышению ее устойчивости.
Рассмотрим в качестве примера гибридизации образование молекулы фторида бериллия BeF 2 . Каждый атом фтора, входящий в состав этой молекулы, обладает одним неспаренным электроном, который и участвует в образовании ковалентной связи:

Атом бериллия в невозбужденном состоянии (1s 2 2s 2 ) неспаренных электронов не имеет. Поэтому для участия в образовании химических связей атом бериллия должен перейти в возбужденное состояние (1s 2 2s 1 2p 1 ):

Образовавшийся возбужденный атом Be * обладает двумя неспаренными электронами: электронное облако одного из них соответствует состоянию 2s , другого - 2р . При перекрывании этих электронных облаков с р -электронными облаками двух атомов фтора могут образоваться ковалентные связи (рис. 3.8). Однако, как уже было сказано, при затрате некоторой энергии вместо исходных s- и р -орбиталей атома бериллия могут образоваться две равноценные гибридные орбитали (sp - орбитали). Форма и расположение этих орбиталей показаны на рис. 3.9, из которого видно, что гибридные sp -орбитали вытянуты в противоположных направлениях.

Рис. 3.8. Схема перекрывания 2p -электронных облаков фтора с 2s - и 2p -электронными облаками атома бериллия

Рис. 3.9. Форма и взаимное расположение гибридных sp -электронных облаков атома бериллия
Перекрывание гибридных sp -электронных облаков атома бериллия с р-электронными облаками атомов фтора изображено на рис. 3.10. Благодаря вытянутой форме гибридных орбиталей, достигается более полное перекрывание взаимодействующих электронных облаков, а значит, образуются более прочные химические связи.

Рис. 3.10. Схема образования химических связей в молекуле BeF 2
![]()
Рассмотренный случай гибридизации одной s - и одной р -орбитали, приводящий к образованию двух sp -орбиталей, называется sp -гибридизацией. Как показывает рис. 3.9, sp -орбитали ориентированы в противоположных направлениях, что приводит к линейному строению молекулы.
![]()
Возможны и другие случаи гибридизации атомных орбиталей, однако число образующихся гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации. Так, при гибридизации одной s - и двух р- орбиталей образуются три равноценные sp 2 -орбитали. В этом случае гибридные электронные облака располагаются в направлениях, лежащих в одной плоскости и ориентированных под углами 120° друг к другу (рис. 3.11). Очевидно, что этому типу гибридизации соответствует образование плоской треугольной молекулы.

Рис. 3.11. Взаимное расположение гибридных sp 2 -электронных облаков
Примером молекулы, в которой осуществляется sp 2 -гибридизация, может служить молекула фторида бора ВF 3 .
Если в гибридизации участвуют одна s - и три р -орбитали (sp 3 -гибридизация), то в результате образуются четыре гибридные s р З -орбитали, вытянутые в направлениях к вершинам тетраэдра, т. е. ориентированные под углами 109°28" друг к другу (рис. 3.12).

Рис. 3.12. Взаимное расположение гибридных sp 3 -электронных облаков
Такая гибридизация осуществляется, например, в возбужденном атоме углерода при образовании молекулы метана СН 4 . Поэтому молекула метана имеет форму тетраэдра, причем все четыре связи С-Н в этой молекуле равноценны:
![]()
Вернемся к рассмотрению структуры молекулы воды. При её образовании происходит sp 3 - гибридизация атомных орбиталей кислорода. Именно поэтому валентный угол НОН в молекуле воды (104,5°) близок не к 90°, а к тетраэдрическому углу (109,5°).
3.6. Вопросы и задания
3.6.1. Какую структурную формулу вы предложите соединению HCNS: H-C=N=S, H-S-C=N, H-N=C=S, или другую?
3.6.2. Приведите структурные формулы 4-нитрофенола и гидросульфата аммония. Укажите характер химических связей в каждом из соединений, валентности и степени окисления элементов.
3.6.3. Напишите графические формулы следующих молекул: а) Н 2 ; б) Na 2 ; в) N 2 ; г) О 2 ; д) С1 2 ; е) С 2 ; ж) В 2 ; з) S 6 ; и) Р 4 ; к) Н 2 О; л) H 2 O 2 ; м) NH 3 ; н) N 2 H 4 ; о) N 2 F 2 ; п) HCN ; р) (СN ) 2 ; с) НВO 2 ; т) В 2 О 2 ; у) HNO 3 ; ф) HN 3 ; х) N 2 O ; ц) СО; ч) Ni (CO ) 4 ; ш) HCNS ; щ) N О 2.
3.6.4. В молекулах СН 4 , N Н 3 и H 2 О валентные орбитали атомов С, N и О находятся в состоянии sp 3 -гибридизации, однако углы между связями не равны: в CH 4 - 109°, в NH 3 - 107° и в Н 2 О - 105°. Как это объяснить?
3.6.5. Углы между связями у гидридов элементов V группы изменяются в такой последовательности: в NH 3 - 107,3°; в РН 3 - 93,3°; в Аs Н 3 - 91,8°; в Sb Н 3 - 91,3°. Как объяснить резкое различие значений углов у молекул N Н 3 и РН 3 ? Чем объясняется уменьшение углов при переходе вниз по подгруппе элементов?
3.6.6. Опишите пространственное строение следующих молекул: AlCl 3 , PH 3 , H 2 O .
3.6.7. Укажите существенные признаки сходства и различия в строении молекул: N 2 , CO и BF .
3.6.8. Молекула H N 3 линейна. Каково состояние гибридизации орбиталей атома азота в этой молекуле? Какова конфигурация молекулы азида аммония (NH 4)N 3 ?
3.6.9. Сравните характеристики молекулы воды и иона Н 2 O + :
|
Вещество |
Ð НОН, град |
ℓ O -H , нм |
|
Н 2 O |
||
|
H 2 O + |
Объясните, почему отрыв электрона приводит к некоторым изменениям в строении молекулы воды.
3.6.10. Молекула TiF 4 имеет тетраэдрическую структуру. Предскажите тип гибридизации валентных орбиталей титана.
3.6.11. Молекула хлорида бора ВСl 3 имеет плоскую структуру, а хлорида азота N Сl 3 - пирамидальную. Чем объясняется такое различие?
3.6.12. Какую форму могут иметь трехатомные молекулы типа АВ 2 ? Рассмотрите на примерах молекул BeCl 2 , ZnBr 2 , CO 2 , H 2 O .
3.6.13. Молекула NF 3 представляет собой тригональную пирамиду с атомом азота в вершине, угол F -N -F = 103º. Каково состояние гибридизации орбиталей атома азота?
3.6.14. Каковы причины того, что молекула BeF 2 линейна, а молекула MgF 2 нелинейна?
3.6.15. В молекуле Р 4 атомы фосфора расположены в вершинах правильного тетраэдра. Каково состояние гибридизации орбиталей фосфора?
3.6.16. Какова гибридизация валентных орбиталей в ионе I 3- , если он линеен?
3.6.17. Молекулы CHal 4 имеют форму тетраэдра, C ОHal 2 и CSHal 2 - треугольника, а CO 2 , COS и CS 2 - линейные молекулы. Каково состояние гибридизации орбиталей атома углерода в этих молекулах?
3.6.18. Укажите общие признаки, присущие молекулам и ионам CH 4 , NH 3 , H 2 O , NH 4 + , H 3 O + .
3.6.19. Молекула никотина, стимулирующего вещества, содержащегося в табаке, имеет такую структуру:

Укажите, сколько атомов углерода в этой молекуле имеет гибридизацию типа sp , sp 2 и sp 3 . Проделайте то же самое для атомов азота. (Отметим, что в соответствии с общепринятой практикой записи структурных формул молекул на атомах азота не указаны неподеленные пары).
Реферат на тему:
Ковалентная связь
План:
-
Введение
- 1 Образование связи
- 2 Виды ковалентной связи
- 3 σ-связь и π-связь
- 4 Примеры веществ с ковалентной связью Литература
Введение
Ковалентная связь на примере молекулы метана: законченный внешний энергетический уровень у водорода (H) - 2 электрона, а у углерода (C) - 8 электронов.
Ковалентная связь (атомная связь, гомеополярная связь) - химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой .
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
1. Образование связи
Простая ковалентная связь образуется из двух неспаренных валентных электронов, по одному от каждого атома:
A· + ·В → А: В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет не чем иным, как энергией связи).
Заполнение электронами атомных (по краям) и молекулярных (в центре) орбиталей в молекуле H 2 . Вертикальная ось соответствует энергетическому уровню, электроны обозначены стрелками, отражающими их спины.
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО . Обобществленные электроны располагаются на более низкой по энергии связывающей МО.
2. Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь . Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
- Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью . Такую связь имеют простые вещества, например: О 2 , N 2 , Cl 2 . Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы электроотрицательность которых имеет равное значение, например в молекуле PH 3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
- Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью .
2. Донорно-акцепторная связь . Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов - донор . Второй из атомов, участвующий в образовании связи, называется акцептором . В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь .Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами - в анион-радикал (отрицательно заряженная частица с неспаренным электроном). 2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
3. σ-связь и π-связь
Сигма (σ)-, пи (π )-связи - приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании π -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
В молекуле этилена С 2 Н 4 имеется двойная связь СН 2 =СН 2 , его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π -связью.
В линейной молекуле ацетилена
Н-С≡С-Н (Н: С::: С: Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две π -связи между этими же атомами углерода. Две π -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
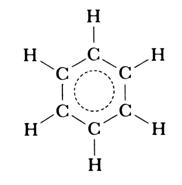
Все шесть атомов углерода циклической молекулы бензола С 6 H 6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвертых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π -связи, а единая π -электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
4. Примеры веществ с ковалентной связью
Простой ковалентной связью соединены атомы в молекулах простых газов (Н 2 , Сl 2 и др.) и соединений (Н 2 О, NH 3 , CH 4 , СО 2 , НСl и др.). Соединения с донорно-акцепторной связью - катион аммония NH 4 + , тетрафторборат aнион BF 4 − и др. Соединения с семиполярной связью - закись азота N 2 O, O − -PCl 3 + .



