ЛЕКЦИЯ № 26
А М И Н О К И С Л О Т Ы
Номенклатура
амино-


Классификация аминокислот
незаменимыми. К ним относятся (
Моноаминомонокарбоновые.
2.Гидроксилсодержащие:
| Название | Условное обозначение | ||
| Тривиальное | Cистематическое | ||
| Серин | Сер Ser | ||
| Треонин | Тре Thr | ||
 | Тирозин | Тир Tyr |
Стереоизомерия аминокислот



Во-первых
Во-вторых,
В-третьих,
В-четвертых, K a K b K a K b внутренней солью.

K a

а константа основности (K b



Амфотерность аминокислот
Наличие в молекуле аминокислоты функциональных групп кислотного и основного характера обусловливает амфотерность аминокислот. Подобно любому амфотерному соединению, аминокислоты образуют соли как при действии кислоты, так и при действии щелочи.

Аминокислоты, будучи гетерофункциональными соединениями, должны проявлять свойства как одной, так и другой функциональной группы.
Образование хлорангидридов.
Эту реакцию часто называют реакцией «активации» карбоксильной группы. Хлорангидриды α-аминокислот получают действием на аминокислоты тионилхлорида (SOCl 2) или хлорида фосфора (V) (PCl 5). Полученные хлорангидриды неустойчивы и существуют только в виде солей:
Поэтому реакцию обычно проводят, предварительно защитив аминогруппу ацилированием.
Образование амидов аминокислот.
Такие амиды получают действием аммиака или первичных аминов на хлорангидриды с защищённой аминогруппой. В случае использования реакции с аминами получают замещённые по азоту амиды аминокислот:
Реакции аминогруппы
Реакция ацилирования. Образование N-замещённых амидов.
N-замещенные амиды часто рассматривают как N-ацильные производные. Эта реакция была отмечена ранее как реакция защиты аминогруппы. Её можно рассматривать как процесс ацилирования аминогруппы хлорангидридами или ангидридами кислот:

Реакция протекает лучше в щелочной среде. Примером может служить получение N-бензоилаланина в присутствии водного раствора гидроксида натрия. Этот метод получения N-ацильных производных называют ацилированием по Шоттен-Бауману:

Щёлочь необходима для связывания выделяющегося хлороводорода, т.к. в кислой среде N-ацильные производные легко гидролизуются, освобождая исходную аминокислоту:
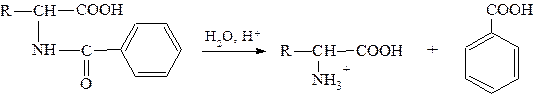
Это общепринятый способ удаления защитной группы. Однако в некоторых случаях невозможно удалять защитную группу гидролизом в кислой среде. Например, при гидролизе пептидов будет разрушаться пептидная связь. В этих случаях защиту проводят такими реагентами, удаление которых можно провести не гидролизом, а каким-либо другим методом. Например, аминогруппу можно защищать реакцией с карбобензоксихлоридом (бензиловый эфир хлормуравьиной кислоты). Карбобензоксигруппа удаляется затем каталитическим гидрогенолизом:

Алкилирование аминокислот.
Аминокислоты можно алкилировать по аминогруппе галоидными алкилами (обычно иодистыми алкилами). Например, алкилированием глицина можно получить метиламиноуксусную кислоту - саркозин, которая в связанном виде содержится в некоторых белках.

При избытке иодистого метила образуется четвертичная аммонийная соль:
Взаимодейстивие с динитрофторбензолом (ДНФБ).
Важной реакцией α-аминогруппы является её реакция с
2,4-динитрофторбензолом (ДНФБ) в слабощелочном растворе, которую впервые использовал Фредерик Сенгер для количественного введения метки в аминогруппы аминокислот и пептидов. Эта реакция протекает по механизму нуклеофильного замещения.
Продукт реакции окрашен в интенсивно желтый цвет. Эта реакция представляет исключительную ценность для идентификации N-концевых аминокислот полипептидных цепей.
Все вышеперечисленные реакции аминогруппы аминокислот можно представить следующей схемой:

Реакции аминокислот in vivo
Простые аминокислоты, как и многие другие простые «биологические молекулы», не накапливаются в клетке: как правило, их избыток разрушается при помощи реакций, которые снабжают живую систему энергией. Три основные реакции, катализируемые ферментами, благодаря которым осуществляется превращение аминокислот в клетке, это реакции дезаминирования, переаминирования и декарбоксилирования.
Дезаминирование аминокислот
В организме дезаминирование может осуществляться как неокислительным, так и окислительным путём.
Неокислительное дезаминирование встречается, в основном, у бактерий и грибов. Например, превращение аспарагиновой кислоты в фумаровую под действием фермента аспартазы.

Окислительное дезаминирование - протекает при участии фермента оксидазы. Для того чтобы полностью прошла реакция окислительного дезаминирования, фермент, катализирующий эту реакцию, нуждается в окислительном (дегидрирующем) агенте. Обычно акцептором водорода в таких системах служит ФАД (флавинадениндинуклеотид), который затем переходит в восстановленную форму, сокращённо обозначаемую ФАД-Н 2 .
Окислительное дезаминирование осуществляется через стадию образования промежуточного имина.
Рассмотрим процесс превращения аланина в пировиноградную кислоту.
Реакции дезаминирования позволяют организму удалять избыток аминокислот, однако при этом повышается концентрация нежелательных азотистых веществ. Высокие концентрации аммиака и его производных токсичны для организма, который поэтому стремится освободиться от них, выделяя лишний азот в виде мочевины или мочевой кислоты.

Мочевая кислота образуется в организме взрослого человека в качестве побочного продукта. Высокое содержание мочевой кислоты приводит к мочекаменной болезни. Мочевая кислота в виде кристаллов мононатриевой соли образует камни в почках и в мочевом пузыре. Соли мочевой кислоты в суставах вызывают болезненные симптомы подагры - очень широко распространенного заболевания человека. Содержание мочевой кислоты и её солей в организме человека может представлять интерес с точки зрения эволюционной теории, поскольку большинство животных полностью разлагают мочевую кислоту до её выделения из организма. Было высказано предположение о том, что присутствие мочевой кислоты в организме человека предоставляет людям некоторое эволюционное преимущество. Эта гипотеза ещё не доказана, но она может быть интересным связующим звеном между биохимическими свойствами вещества и поведением живых организмов.
Альдольное расщепление.
Реакция протекает с α-аминокислотами, содержащими гидроксильную группу в β-положении углеводородного радикала.
Рассмотрим, например, реакцию расщепления серина, в результате которой образуются глицин и формальдегид.

В результате этой реакции расщепляется С-С связь между α- и
β-углеродными атомами. Образующийся формальдегид не выделяется, а связывается с другим коферментом - тетрагидрофолиевой кислотой и в качестве одноуглеродного фрагмента участвует далее в синтезе многих важных соединений.
ПЕПТИДЫ
Полипептиды образуются в результате реакции конденсации, протекающей между аминогруппой одной кислоты и карбоксильной группой другой:

Пептид, образованный двумя аминокислотами, называется дипептид, тремя - трипептид и.т.д. Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами. Часто в названии таких молекул указывают число аминокислот, входящих в состав данного олигопетида: дипептид, трипептид, тетрапептид, октапептид и.т.д.
Поэтому более удачным следует считать различие, проводимое на уровне структуры полимера, более сложном, чем простая аминокислотная последовательность и количественный состав пептида. Полипептиды представляют собой линейные, довольно гибкие молекулы, а длинные цепи белков свернуты в клубок или иную структуру. Многие белки могут иметь в своем составе группы небелкового характера (простетические группы), связанные с полиамидной цепью.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот. Например, тетрапептиды сер-гис-про-ала и ала-гис-про-сер - это два разных пептида, несмотря на то, что они имеют одинаковый качественный и количественный состав.
Hоменклатура пептидов
При названии полипептида к названию всех аминокислотных остатков, кроме последнего, добавляют суффикс -ил , концевая аминокислота имеет окончание -ин . Например, пептид мет-асп-вал-про имеет полное название метионил аспарагил валил пролин.
ЛЕКЦИЯ № 26
А М И Н О К И С Л О Т Ы
Аминокислотами называют бифункциональные производные углеводородов, которые содержат карбоксильную группу -COOH и аминогруппу -NH 2 .
Номенклатура
По систематической номенклатуре аминокислоты называют, по соответствующей карбоновой кислоте добавляя приставку амино- . Положение аминогруппы в углеродной цепи указывают цифрой:
Подробнее номенклатурные правила для названий аминокислот изложены в пособии Левина И.Ю., Берлянд А.С. «Номенклатура, классификация и электронное строение химических связей в органических соединениях», раздел 4.3.
В зависимости от положения аминогруппы по отношению к карбоксильной группе различают α, β, γ и так далее аминокислоты:

 Все природные аминокислоты содержат аминогруппу только в
Все природные аминокислоты содержат аминогруппу только в
α-положении и имеют общую формулу:
Помимо систематической, для природных аминокислот широко распространена тривиальная номенклатура (аланин, валин, лизин и т.д.). Иногда запись аминокислот осуществляют, используя трёх- буквенные сокращения (Ala, Val , Lys и др.).
Классификация аминокислот
В настоящее время единой классификации аминокислот не существует.
Аминокислоты делят на природные (содержатся в растительных и животных организмах) и синтетические – получены искусственным путем.
Организм синтезирует аминокислоты главным образом из пищевых белков. Но есть целая группа аминокислот, которых организм сам синтезировать не может. Эти аминокислоты называют незаменимыми. К ним относятся (валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин и триптофан) Такие аминокислоты должны поступать в организм извне.
В настоящее время известно свыше 150 аминокислот, но только 20 из них входят в состав белков.
По природе радикала аминокислоты делят на:
Моноаминомонокарбоновые.
2.Гидроксилсодержащие:
| Строение радикала кислоты -R | Название | Условное обозначение | |
| Тривиальное | Cистематическое | ||
| Серин | 2-амино-3-гидрокси-пропановая | Сер Ser | |
| Треонин | 2-амино-3-гидрокси-бутановая | Тре Thr | |
 | Тирозин | 2-амино-3-(4-гидро-ксифенил)пропановая | Тир Tyr |
Аминокислоты, содержащие в радикале дополнительную аминогруппу или гуанидильный остаток.
5. Аминокислоты, которые содержат в радикале дополнительную карбоксильную или амидную группы:
6. Ароматические и гетероциклические аминокислоты:
Современная рациональная классификация основана на полярности радикалов. Полярность радикала во многом определяет такое важное свойство аминокислот как растворимость в воде и в других полярных растворителях. Полярные группы радикала (-COOH, -NH 2 , -OH и др.) притягивают воду и тем самым повышают растворимость аминокислот в воде, неполярные радикалы, наоборот, отталкивают воду и снижают растворимость аминокислот в воде.
Стереоизомерия аминокислот
Все природные α-аминокислоты, кроме глицина (NH 2 - CH 2 - COOH), имеют асимметрический атом углерода (α-углеродный атом), а некоторые из них даже два хиральных центра, например, треонин. Таким образом, все аминокислоты могут существовать в виде пары несовместимых зеркальных антиподов (энантиомеров).
За исходное соединение, с которым принято сравнивать строение
α-аминокислот, условно принимают D- и L-молочные кислоты, конфигурации которых, в свою очередь, установлены по D- и L-глицериновым альдегидам.


Все превращения, которые осуществляются в этих рядах при переходе от глицеринового альдегида к α-аминокислоте, выполняются в соответствии с главным требованием - они не создают новых и не разрывают старых связей у асимметрического центра.
Для определения конфигурации α-аминокислоты в качестве эталона часто используют серин (иногда аланин). Конфигурации их так же выведены из D- и L-глицериновых альдегидов:

Природные аминокислоты, входящие в состав белков, относятся к L-ряду.
D-формы аминокислот встречаются сравнительно редко, они синтезируются только микроорганизмами и называются «неприродными» аминокислотами. Животными организмами D-аминокислоты не усваиваются. Интересно отметить действие D- и L-аминокислот на вкусовые рецепторы: большинство аминокислот L-ряда имеют сладкий вкус, а аминокислоты D-ряда - горькие или безвкусные.
Без участия ферментов самопроизвольный переход L-изомеров в D-изомеры с образованием эквимолярной смеси (рацемическая смесь) осуществляется в течение достаточно длительного промежутка времени.
Рацемизация каждой L-кислоты при данной температуре идет с определенной скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, например, в твердой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст человека или животного.
Физические свойства аминокислот
Хотя аминокислоты обычно изображают как соединения, содержащие амино- и карбоксильную группы (H 2 N - CHR - COOH), некоторые их свойства, как физические, так и химические, не согласуются с этой структурой. Присутствие в молекуле у одного атома углерода двух функциональных групп приводит к появлению ряда специфических свойств.
Во-первых , в противоположность аминам и карбоновым кислотам аминокислоты представляют собой нелетучие кристаллические вещества, плавящиеся с разложением при близких и довольно высоких температурах, поэтому идентификации аминокислот по температурам плавления достаточно затруднительна.
Во-вторых, аминокислоты очень плохо растворимы в неполярных растворителях типа петролейного эфира, диэтилового эфира, бензола и хорошо растворимы в воде.
В-третьих, в водных растворах аминокислоты имеют высокие дипольные моменты.
В-четвертых, константы кислотности и основности для групп СООН и NH 2 необычайно малы. Так, для глицина константа кислотности K a = 1,6×10 - 10 , а константа основности K b = 2,5×10 - 12 ; в то время как для большинства карбоновых кислот K a » 10 - 5 а для алифатических аминов K b » 10 - 4 .Все эти свойства вполне объяснимы,если принять во внимание тот факт, что аминокислоты существуют в виде диполярного иона, который образуется за счет отщепления протона от карбоксильной группы и присоединения его к аминогруппе. Диполярный ион часто называют внутренней солью.

Кислотно-основные свойства также становятся понятными, если учесть, что измеряемая K a в действительности относится к кислотности иона RNH 3 + :

а константа основности (K b ) в действительности относится к основности карбоксилат-иона.

При подщелачивании раствора аминокислоты диполярный ион I превращается в анион II, так как более сильное основание (гидроксильный ион) отрывает протон от иона аммония и образуется более слабое основание - амин.

Если подкислить раствор аминокислоты, ион I превратится в катион III, так как более сильная кислота Н 3 О + отдает протон карбоксилат-иону и образуется более слабая кислота:

Необходимо отметить, что ионы II и Ш, содержащие свободную аминогруппу или свободную карбоксильную группу, находятся в равновесии с диполярным ионом:
Однако следует иметь в виду, что в данном равновесии участвует также определенное (хотя и небольшое) количество незаряженных молекул аминокислот.
Строение и свойства аминогруппы.
Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е. являются амфотерными соединениями. В аминокислотах как гетерофункциональных соединениях можно выделить следующие реакционные центры: карбоксильная группа (электрофильный), аминогруппа (нуклеофильный) и радикал.
Вопрос 2. Аминокислоты: строение, изомерия и классификация.
Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группа –СООН и аминогруппа –NH 2 .
Другими словами, аминокислоты – органические кислоты, молекулы которых содержат одну или несколько аминогрупп (NH 2 –группы). Являются основными структурными элементами белков. Аминокислоты – строительные блоки, из которых строятся белковые структуры, мышечные волокна, например. Организм использует их для собственного роста, восстановления, укрепления и выработки различных гормонов, антител и ферментов. Помимо 20 наиболее распространенных аминокислот, входящих в состав белков, известно свыше 150 других, которые встречаются в различных клетках и тканях либо в свободном, либо в связанном виде, но никогда не встречаются в составе белков.
Аминокислоты подразделяются на незаменимые (валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин, гистидин). Незаменимые аминокислоты не синтезируются в организме человека, но необходимы для нормальной жизнедеятельности. Они должны поступать в организм с пищей. При недостатке незаменимых аминокислот задерживается рост и развитие организма. Оптимальное содержание незаменимых аминокислот в пищевом белке зависит от возраста, пола и профессии человека, а также от других причин. Белки пищи в организме человека расщепляются до аминокислот.
Таблица 1
α-Аминокислоты общей формулы ![]()
| Аминокислота | Обозначение | -R | Молекулярная формула |
| Глицин | Gly(G) | -H | C 2 H 5 NO 2 |
| Аланин | Ala(A) | -CH 3 | C 3 H 7 NO 2 |
| Валин | Val(V) | -CH(CH 3) 2 | C 5 H 11 NO 2 |
| Лейцин | Leu(L) | -CH 2 -CH(CH 3) 2 | C 6 H 13 NO 2 |
| Изолейцин | Ile(I) | -CH(CH 3)-C 2 H 5 | C 7 H 15 NO 2 |
| Цистеин | Cys(C) | -CH 2 -SH | C 3 H 7 SNO 2 |
| Метионин | Met(M) | -CH 2 -CH 2 -S-CH 3 | C 5 H 11 SNO 2 |
| Серин | Ser(S) | -CH 2 -OH | C 3 H 7 NO 3 |
| Треонин | Thr(t) | -CH(OH)-CH 3 | C 4 H 9 NO 3 |
| Фенилаланин | Phe(F) | -CH 2 -C 6 H 5 | C 9 H 11 NO 2 |
| Тирозин | Tyr(Y) |  | C 9 H 11 NO 3 |
| Триптофан | Trp(W) | | C 11 H 12 N 2 O 2 |
| Аспарагиновая кислота | Asp(D) | -CH 2 COOH | C 4 H 7 NO 4 |
| Глутаминовая кислота | Glu(E) | -CH 2 -CH 2 -COOH | C 5 H 9 NO 4 |
| Аспарагин | Asn(N) | -CH 2 -CO-NH 2 | C 4 H 8 N 2 O 3 |
| Глутамин | Gln(Q) | -CH 2 -CH 2 -CO-NH 2 | C 5 H 10 N 2 O 3 |
| Гистидин | His(H) | C 6 H 9 N 3 O 2 | |
| Лизин | Lys(K) | -(CH 2) 4 -NH 2 | C 6 H 14 N 2 O 2 |
| Аргинин Пролин | Arg(R) Pro |   | С 5 Н 9 NO 2 |
Определенная часть аминокислот, в свою очередь, расщепляется до органических кетокислот, из которых в организме вновь синтезируются новые аминокислоты, а затем белки. Отдельно стоят так называемые две "полузаменимые" аминокислоты: цистин (цистеин) и тирозин. Отличаются они от остальных тем, что организм может использовать их вместо, соответственно, метионина и фенилаланина для производства белка. Остальные 13 аминокислот синтезируются в организме человека в реакциях трансаминирования. Эти аминокислоты – «заменимые» – аланин, аргинин, аспарагин/аспарагиновая кислота, карнитин, цистеин, цистин, глутаминовая кислота, глутамин, глицин, гидроксипролин, пролин, серин, тирозин.
Аминокислоты всасываются из желудочно-кишечного тракта и с кровью поступают во все органы и ткани, где используются для синтеза белков и подвергаются различным превращениям. В крови поддерживается постоянная концентрация аминокислот. Из организма выделяется около 1 г азота аминокислот в сутки. В мышцах, ткани головного мозга и печени содержание свободных аминокислот во много раз выше, чем в крови, и менее постоянно. Концентрация аминокислот в крови позволяет судить о функциональном состоянии печени и почек. Содержание аминокислот в крови может заметно нарастать при нарушениях функции почек, лихорадочных состояниях, заболеваниях, связанных с повышенным содержанием белка.
Значение аминокислот не ограничивается их ролью в синтезе тканевых белков. Каждая из них выполняет в организме свои особые функции, направленные на поддержание гомеостаза организма.
Валин. Oдин из главных компонентов в росте и синтезе тканей тела. Основной источник – животные продукты. Опыты на лабораторных крысах показали, что валин повышает мышечную координацию и понижает чувствительность организма к боли, холоду и жаре.
Гистидин. Cпособствует росту и восстановлению тканей. В большом количестве содержится в гемоглобине; используется при лечении ревматоидных артритов, аллергий, язв и анемии. Недостаток гистидина может вызвать ослабление слуха.
Изолейцин . Поставляется всеми продуктами, содержащими полноценный белок – мясом, птицей, рыбой, яйцами, молочными продуктами.
Лейцин. Поставляется всеми продуктами, содержащими полноценный белок – мясом, птицей, рыбой, яйцами, молочными продуктами. Необходим не только для синтеза протеина организмом, но и для укрепления иммунной системы.
Лизин. Обеспечивает должное усвоение кальция; участвует в образовании коллагена (из которого затем формируются хрящи и соединительные ткани); активно участвует в выработке антител, гормонов и ферментов. Недавние исследования показали, что лизин, улучшая общий баланс питательных веществ, может быть полезен при борьбе с герпесом. Недостаток может выражаться в усталости, неспособности к концентрации, раздражительности, повреждению сосудов глаз, потере волос, анемии и проблем в репродуктивной сфере.
Метионин. Важен в метаболизме жиров и белков, организм использует ее также для производства цистеина. Является основным поставщиком сульфура, который предотвращает расстройства в формировании волос, кожи и ногтей; способствует понижению уровня холестерина, усиливая выработку лецитина печенью; понижает уровень жиров в печени, защищает почки; участвует в выводе тяжелых металлов из организма; регулирует образование аммиака и очищает от него мочу, что понижает нагрузку на мочевой пузырь; воздействует на луковицы волос и поддерживает рост волос.
Треонин . Важная составляющая в синтезе пуринов, которые, в свою очередь, разлагают мочевину, побочный продукт синтеза белка. Важная составляющая коллагена, эластина и протеина эмали; участвует в борьбе с отложением жира в печени; поддерживает более ровную работу пищеварительного и кишечного трактов; принимает общее участие в процессах метаболизма и усвоения.
Триптофан. Является первичным по отношению к ниацину (витамину В) и серотонину, который, участвуя в мозговых процессах, управляет аппетитом, сном, настроением и болевым порогом. Естественный релаксант, помогает бороться с бессонницей, вызывая нормальный сон; помогает бороться с состоянием беспокойства и депрессии; помогает при лечении головных болей при мигренях; укрепляет иммунную систему; уменьшает риск спазмов артерий и сердечной мышцы; вместе с лизином борется за понижение уровня холестерина.
Фенилаланин. Используется организмом для производства тирозина и трех важных гормонов – эпинэрфина, норэпинэрфина и тироксина. Используется головным мозгом для производства норэпинэрфина, вещества, которое передает сигналы от нервных клеток к головному мозгу; поддерживает нас в состоянии бодрствования и восприимчивости; уменьшает чувство голода; работает как антидепрессант и помогает улучшить работу памяти.
Тирозин. Используется организмом вместо фенилаланина при синтезе белка. Источники – молоко, мясо, рыба. Мозг использует тирозин при выработке норэпинэрфина, повышающего ментальный тонус. Многообещающие результаты показали попытки использовать тирозин как средство борьбы с усталостью и стрессами.
Цистин (цистеин). Если в рационе достаточное количество цистина, организм может использовать его вместо метионина для производства белка. Хорошие источники цистина – мясо, рыба, соя, овес и пшеница. Цистин используют в пищевой промышленности как антиоксидант для сохранения витамина С в готовых продуктах.
Аланин. Заменимая аминокислота. Является важным источником энергии для мышечных тканей, головного мозга и центральной нервной системы; укрепляет иммунную систему путем выработки антител; активно участвует в метаболизме сахаров и органических кислот.
Аргинин. Заменимая аминокислота. L-Аргинин вызывает замедление развития опухолей и раковых образований. Очищает печень. Помогает выделению гормона роста, укрепляет иммунную систему, способствует выработке спермы и полезна при лечении расстройств и травм почек. Необходим для синтеза протеина и оптимального роста. Наличие L-Аргинина в организме способствует приросту мышечной массы и снижению жировых запасов организма. Также полезен при расстройствах печени, таких, как цирроз печени, например. Не рекомендуется к приему беременными и кормящими женщинами.
Аспарагин. Заменимая аминокислота. Аспарагиновая кислота активно участвует в выводе аммиака, вредного для центральной нервной системы. Недавние исследования показали, что аспарагиновая кислота может повышать сопротивляемость усталости.
Глутамин . Заменимая аминокислота. Важен для нормализации уровня сахара, повышении работоспособности мозга, при лечении импотенции, при лечении алкоголизма, помогает бороться с усталостью, мозговыми расстройствами – эпилепсией, шизофренией и просто заторможенностью, нужен при лечении язвы желудка, и формирование здорового пищеварительного тракта.
Глутаминовая кислота считается естественным "топливом" для головного мозга, улучшает умственные способности, способствует ускорению лечения язв, повышает сопротивляемость усталости.
Глицин . Активно участвует в обеспечении кислородом процесса образования новых клеток. Является важным участником выработки гормонов, ответственных за усиление иммунной системы.
Пролин. Заменимая аминокислота. Предельно важен для правильного функционирования связок и суставов; также участвует в поддержании работоспособности и укреплении сердечной мышцы.
Серин. Заменимая аминокислота. Участвует в запасании печенью и мышцами гликогена; активно участвует в усилении иммунной системы, обеспечивая ее антителами; формирует жировые "чехлы" вокруг нервных волокон.
Лишение всех аминокислот приводит к совершенной потере белка организмом, истощению, полной потере энергии, потере веса, анемии, разрушению мышц, в самом тяжелом случае – к смерти.
§ 1 Классификация аминокислот
Простейший представитель – аминоуксусная кислота H 2 N-CH 2 -COOH (глицин )

Аминокислоты классифицируют по нескольким признакам.
- В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-,β-,γ-,δ и т. д.

В природе встречаются и β-аминокислоты, RCH(NH 2)CH 2 COOH, например β-аланин CH 2 NH 2 CH 2 COOH, входящий в состав пантотеновой кислоты.
- По характеру углеводородного радикала. В зависимости от строения радикала аминокислоты могут быть алифатическими и циклическими , из которых только одна (пролин) не является ароматической. Две аминокислоты – тирозин и фенилаланин – являются карбоциклическими и две (гистидин и триптофан) – гетероциклические. Приведенные выше аминокислоты относятся к жирному ряду. Примером ароматической аминокислоты может служить пара-аминобензойная кислота:
 п-аминобензойная кислота
п-аминобензойная кислота
Гетероциклический фрагмент в строении имеют следующие аминокислоты: гистидин, пролин, гидроксипролин, триптофан.

Гистидин
3.По количеству карбоксильных и аминогрупп в составе аминокислот различают дикарбоновые аминокислоты (кислого характера ), т.к. они содержат две карбоксильные группы, и диаминомонокарбоновые аминокислоты (основного характера ), в состав которых входит большее количество аминогрупп.
Моноаминомонокарбоновые кислоты:
Глицин – NH 2 CH 2 COOH
Аланин – CH 3 CH (NH 2) COOH
Цистеин – CH 2 (SH)CH(NH 2)COOH
Метионин – CH 2 (SCH 3) CH 2 CH (NH 2) COOH
Валин – (СН 3) 2 СНСН(NН 2)СООН и др.
Моноаминодикарбоновые кислоты:
Аспарагиновая – HOOC CH 2 CH (NH 2) COOH
Глутаминовая – HOOC (CH 2) 2 CH (NH 2) COOH
Диаминомонокарбоновые кислоты:
Лизин – NH 2 CH 2 (CH 3) 2 CH(NH 2)COOH
Аргинин – NH 2 C(=NH)NH(CH 2) 3 CH(NH 2)COOH и др.
Моноаминомонокарбоновые кислоты могут содержать и другие функциональные группы в своем составе. Например, гидроксиаминокислоты (серин, треонин, тирозин) и серосодержащие аминокислоты (цистеин и метионин).
По характеру радикала аминокислоты подразделяют на неполярные (гидрофобные радикалы) и полярные (гидрофильные радикалы).
К первой группе относятся аминокислоты как с алифатическим (аланин, валин, лейцин, изолейцин, метионин), так и с циклическим радикалом (фенилаланин, триптофан, пролин).
Ко второй группе принадлежат α-аминокислоты, в радикале которых имеются полярные функциональные группы как способные к ионизации (ионогенные ), так и не способные (неионогенные). Поэтому вторую группу подразделяют на: полярные незаряженные (глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин), положительно заряженные (лизин, аргинин, гистидин) и отрицательно заряженные (аспарагиновая и глутаминовые кислоты). В растворах с рН>7.0 может происходить полная ионизация HS – групп цистеина и НО–групп тирозина, в результате чего они заряжаются отрицательно.

В белках ионогенные группы радикалов, расположенные на поверхности макромолекул, обуславливают электростатические взаимодействия и образование гидратной оболочки. Полярные неионогенные группы располагаются как на поверхности, так и внутри белковых молекул, участвуя в образовании водородных связей с другими полярными группами.
Номенклатура аминокислот
Наиболее широко для α-аминокислот применяются тривиальные названия, принятые международной номенклатурой ИЮПАК.
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Например:

Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино – с указанием положения аминогруппы буквой греческого алфавита.

Для α-аминокислот, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия. Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино- , три группы NH 2 – триамино- и т.д.

Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота :

§ 3 Изомерия аминокислот
1. Изомерия углеродного скелета

2.Изомерия положения функциональных групп

3. Оптическая изомерия
Все α-аминокислоты, кроме глицина H 2 N-CH 2 -COOH, содержат асимметрический атом углерода (α-атом) и могут существовать в виде оптических изомеров (зеркальных антиподов).




Все природные аминокислоты, кроме глицина, содержат асимметричные атомы углерода, существуют в оптически активных модификациях и, как правило, относятся к L-ряду. Большинство аминокислот L-ряда имеют сладкий вкус, а D-ряда – горький или безвкусны. Аминокислоты D-ряда содержатся только в некоторых антибиотиках и в оболочках бактерий (грамицидин С, актиномицин, полимиксин). Оптическая изомерия природных α -аминокислот играет важную роль в процессах биосинтеза белка.
Вкус α-аминокислот. Сладкие L – аминокислоты: глицин, серин, пролин, аланин.
![]()
Вопрос 3. Биполярнаяструктура аминокислот и образование хелатов.
Аминокислоты - бесцветные кристаллические вещества, растворимые в воде; t пл 220-315°С, при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Растворимость аминокислот в воде варьируется в широких пределах в зависимости от природы радикала и, главным образом, от наличия в молекуле гидрофильных или гидрофобных групп. Растворимость аминокислот в спирте значительно ниже, а в эфире, хлороформе и других органических растворителях они практически не растворяются. Высокая температура плавления аминокислот связана с тем, что их молекулы имеют структуру главным образом амфотерных (двузарядных) ионов. Например, строение простейшей аминокислоты - глицина - можно выразить формулой:
В водных растворах α-аминокислоты существуют в виде равновесной смеси диполярного иона , катионной и анионной форм:

Положение равновесия зависит от рН среды. Общим для всех α-аминокислот является преобладание катионных форм в сильнокислых (рН 1-2) и анионных – в сильнощелочных (рН 13-14) средах.
Значение рН, при котором суммарный заряд молекулы аминокислоты или белка равен нулю, а концентрация биполярного иона максимальна, называется изоэлектрической точкой (ИЭТ), а такое состояние молекулы – изоэлектрическим состоянием.
 Для аминокислот кислотного
характера ИЭТ находится в сильнокислой среде (у аспарагиновой кислоты рН=2.8, глутаминовой -3.2), нейтрального характера
– в слабокислой среде, основного характера
– в сильнощелочной (у лизина – рН 9.6, у аргинина – 10.8).
Для аминокислот кислотного
характера ИЭТ находится в сильнокислой среде (у аспарагиновой кислоты рН=2.8, глутаминовой -3.2), нейтрального характера
– в слабокислой среде, основного характера
– в сильнощелочной (у лизина – рН 9.6, у аргинина – 10.8).

В ИЭТ молекула не перемещается в постоянном электрическом поле ни к катоду, ни к аноду. При рН ниже ИЭТ α- аминокислота заряжается положительно и движется к катоду, при рН выше ИЭТ приобретает отрицательный заряд и движется к аноду. На этом основано разделение аминокислот и белков методами электрофореза и ионообменной хроматографии, которые позволяют идентифицировать и количественно определить их содержание в растворах и биологических жидкостях.
Таблица 2
Кислотно-основные свойства аминокислот

Вопрос 4. Химические свойства аминокислот: кислотно-оснόвные свойства, декарбоксилирование, переаминирование, реакции по карбоксильной группе и аминогруппе, хелатообразование.
Реакции, протекающие по карбоксильной группе .
Как карбоновые кислоты они образуют функциональные производные:
H 2 N–CH 2 –COOH + NaOH H 2 N–CH 2 –COO Na + + H 2 O
б) сложные эфиры
Для карбоксильной группы характерны реакции ацилирования:
при взаимодействии со спиртами в присутствии сильных кислот образуются сложные эфиры: 
Таким образом, в кислой среде, когда аминогруппа блокирована протоном, аминокислоты выступают ацилирующим реагентом, т.е. донором ацильной группы, а в щелочной среде за счет свободной аминогруппы они выступают акцептором ацильной группы от сильного ацилирующего реагента, напрмер, хлорангидрида карбоновой кислоты, при этом образуются N- ацильные производные аминокислот.

Образование галогенангидридов.
При действии на аминокислоты с защищенной аминогруппой оксид-дихлоридом серы (хлористым тионилом) или оксид-трихлоридом фосфора образуются хлорангидриды защищенных аминокислот: 
Хлорангидриды аминокислот более реакционноспособны в реакциях нуклеофильного замещения, чем аминокислоты, например, в реакциях саммиаком:
R – CH(NH 2) – COCl + NH 3 → R – CH(NH 2) – CONH 2 + HCl
Эта реакция имеет важное значение для обезвреживания аммиака в клетке, образующегося в процессах дезаминирования аминокислот, аминов и амидов.
Декарбоксилирование – важный путь распада аминокислот в организме. В α-аминокислотах электроноакцепторная группа – NH 3 + расположена в α-положении к группе – СОО - . Это вызывает сильную поляризацию связи между атомами углерода и способствует ее разрыву с образованием СО 2 , т.е. декарбоксилированию. В организме реакция катализируется декарбоксилазами, активность которых определяется пиридоксальфосфатом. В результате декарбоксилирования из α-аминокислот образуются биогенные амины:
R – CH(NH 2) - COOH → RCH 2 - NH 2 + CO 2
Аналогично происходит образование гистамина из гистидина, а из триптофана – триптамина и серотонина.

Гистамин обладает широким спектром физиологического действия: расширяет капилляры, ускоряет приток лейкоцитов в очаг воспаления, способствует активизации защитных сил организма, усиливает секрецию соляной кислоты в желудке, имеет прямое отношение к явлениям сенсибилизации и десенсибилизации, влияет на рецепторы сосудов, являясь нейромедиатором, участвует в болевом синдроме.
Реакции, протекающие по аминогруппе. Подобно аминам, аминокислоты реагируют с кислотами с образованием солей аммония:
H 2 N–CH 2 –COOH + HCl → + Сl -
Реакция ацилирования протекает в слабощелочной среде, используется для защиты аминогруппы:
НООС – CH(R) –NH 2 + R 1 – COCl → HOOC – CH(R) – NH – CO –R 1 + HCl
Реакция алкилирования (для защитыα -аминогруппы)
H 2 N – CH 2 –COOH + R 1 –Hal→ R 1 –NH – CH 2 – COOH +H-Hal
Реакция с азотистой кислотой . Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота - в гидроксикислоту:
H 2 N-CH(R)-COOH + HNO 2 → HO-CH(R)-COOH + N 2 + H 2 O
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира):
H 2 N-CH(R)-COOH + R"OH H 2 N-CH(R)-COOR" + Н 2 О.
Элиминирование – путь трансформации аминокислот с функциональной группой в β-положении.

В организме протекает реакция элиминирования серина:

C альдегидами. С формальдегидом в слабощелочной среде аминокислоты легко переходят в моноанион, содержащий свободную аминогруппу, поэтому легко вступают в реакцию нуклеофильного присоединения к формальдегиду. При взаимодействии α-аминокислот с альдегидами образуются замещенные имины (основания Шиффа) через стадию образования карбиноламинов.
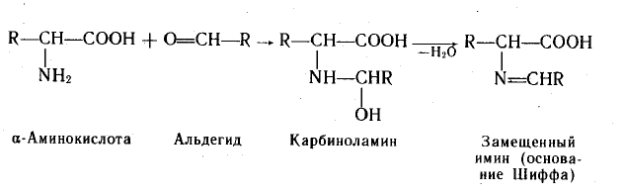
Амфотерный характер α –аминокислот не позволяет непосредственно проводить титрование их щелочью в аналитических целях. При взаимодействии аминокислот с формальдегидом получаются относительно устойчивые карбиноламины – N-метилольные производные, в которых наличие свободной карбоксильной группы позволяет провести титрование щелочью.

В таких производных аминокислот основность атома азота сильно понижена, что позволяет использовать эту реакцию для количественного определения α-аминокислот методом Серенсена. Способность аминогрупп в аминокислотах и белках взаимодействовать с формальдегидом приводит к необратимой денатурации белков. Этим объясняется высокая токсичность формальдегида и его стерилизующая способность.
Образование ДНФ – производных. Αминокислоты образуют с 2,4-динитрофторбензолом окрашенные в желтый цвет динитрофенильные производные (ДРФ-производные), растворимые в органических растворителях. Они экстрагируются из реакционной смеси органическими растворителями и используются для идентификации хроматографическими методами.
Данная реакция протекает по механизму нуклеофильного замещения в бензольном кольце. Такое замещение становится возможным за счет влияния двух сильных электроноакцепторных нитрогрупп:

Образование ФТГ-производных (реакция Эдмана). Эта реакция широко используется при установлении строения пептидов. Взаимодействие аминокислот с фенилизотиоционатом протекает по механизму нуклеофильного присоединения. В образовавшемся продукте далее осуществляется внутримолекулярная реакция нуклеофильного замещения, приводящая к образованию циклического замещенного амида.

Циклические соединения, получаемые по данной реакции, представляют собой производные тиогидантоина, поэтому для них принято название фенилтиогидантоиновых производных (ФТГ – производных) α-аминокислот. Такие производные отличаются строением радикала R.
Дезаминирование, отщепление (элиминирование) аминогруппы (NH 2) из органических соединений. Дезаминирование сопровождается замещением аминогруппы какой-либо др. группой (например, Н, ОН, OR, Hal) или образованием двойной связи. Дезаиминирование производят, в частности, действием на первичные амины азотистой кислотой. При этом из алифатических аминов образуются спирты (I) и олефины (II), например:

Дезаминирование циклоалифатических аминов сопровождается расширением или сужением цикла. Ароматические амины дают с азотистой кислотой (в присутствии сильных неорганических кислот) диазония соли. Такие реакции, как гидролиз, гидрогенолиз, расщепление четвертичных аммониевых солей, пиролитические и др., также приводят к реакции дезаминитрования. Важную роль играет эта реакция в процессах жизнедеятельности животных, растений и микроорганизмов. Для α-aминокислот характерно окислительное дезаминирование. с образованием аммиака и -кетокислот. Окислительному дезаминированию подвергаются также амины. Оксидазы природных аминокислот, кроме глутаматдегидрогеназы, дезаминирующей L-глутаминовую кислоту, в животных тканях мало активны. Поэтому большинство L-аминокислот подвергается непрямому дезаминированию путём предварительного переаминирования с образованием глутаминовой кислоты, которая затем претерпевает окислительное Ддезаминирование или др. превращения. Др. типы дезаминирования - восстановительное, гидролитическое (дезаминирование. аминопроизводных пуринов, пиримидинов и сахаров) и внутримолекулярное (дезаминирование. гистидина) - в большей степени распространены у микроорганизмов.
Внутримоекулярное дезаминирование
R–CH 2 – CH(NH 2)– COOH→ R–CH=CH–COOH + NH 3
α,β – ненасыщенная кислота
Гидролитическое дезаминирование
R–CH(NH 2) – COOH +H 2 O → R – CH(OH) – COOH + NH 3
α - оксикислота
Окислительное дезаминирование
R-CH(NH 2) – COOH +1/2 O 2 → R –C(O) – COOH + NH 3
α-кетокислота

Переаминирование, трансаминирование, обратимый перенос аминогруппы (-NH 2) от аминокислот или аминов к оксокислотам:

Реакция ферментативного переаминирования, открытая в 1937 советскими биохимиками А. Е. Браунштейном и М. Г. Крицман, играет роль важного промежуточного звена в процессах синтеза и дезаминирования многих аминокислот у животных, растений и микроорганизмов. Большинство природных аминокислот синтезируется в тканях путём переноса NH 2 -группы от глутаминовой кислоты - начального продукта усвоения азота - на различные оксокислоты. Обеспечивая быстрое взаимопревращение различных амино- и оксокислот, реакции переаминирования играют важную роль в регуляции и сопряжении обмена аминокислот и углеводов, ферменты переаминирования- аминотрансферазы имеются во всех живых клетках. Описано свыше 55 различных аминотрансфераз, катализирующих эту реакцию всех известных природных аминокислот и ряда биогенных аминов. Коферментом аминотрансфераз является производное витамина B 6 - пиридоксальфосфат, играющий роль переносчика NH2-группы.Резкое повышение содержания некоторых аминотрансфераз в плазме крови больных служит диагностическим признаком при поражениях печени (гепатиты), сердца (инфаркт миокарда), мышц (травмы, миодистрофические заболевания).

Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция), так и принадлежащих разным молекулам (межмолекулярная реакция).
При нагревании в сухом виде различные аминокислоты ведут себя по разному. Так, -аминокислоты образуют циклические дипептиды, называемые дикетопиперазинами :

-аминокислоты претерпевают дезаминирование :
СН 3 -СН 2 -СН(NH 2)-CH 2 -COOH → СН 3 -СН=СН-CH 2 -COOH + NH 3
- аминокислоты превращаются в циклические внутримолекулярные пептиды- лактамы :

Практическое значение имеет внутримолекулярное взаимодействие функциональных групп -аминокапроновой кислоты, в результате которого образуется -капролактам (полупродукт для получения капрона):

Образование комплексов с металлами. α-Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все α-аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:

В таких солях ион меди координационными связями соединен с аминогруппами.
Реакционная способность радикала обусловлена наличием НО-, SH- групп или ароматичсеского ядра. Важнейшими из них являются окислительно-восстановительные реакции, β-декарбоксиилрование, диметилирование, переметилирование, которые ведут к переходу одних аминокислот в другие, что расширяет возможности синтеза различных аминокислот (например, окисление фенилаланина в тирозин).
При полном окислении тиоловой группы цистеин превращается в цистеиновую кислоту, которая декарбоксилируясь, превращается в таурин, образующий с желчными кислотами парные желчные кислоты (таурохолевую и тауродезоксихолевую).
HS – CH 2 -CH(NH 2) – COOH + ½ O 2 → HO 3 S – CH 2 – CH(NH 2) - COOH→
цистеин цистеиновая кислота
→CO 2 + H 2 N – CH 2 – CH 2 –SO 3 H
Вопрос 5. Строение пептидной связи. Лактам-лактимная таутомерия.
Межмолекулярное взаимодействие -аминокислот приводит к образованию пептидов. При взаимодействии двух -аминокислот образуется дипептид.

Межмолекулярное взаимодействие трех -аминокислот приводит к образованию трипептида и т.д.
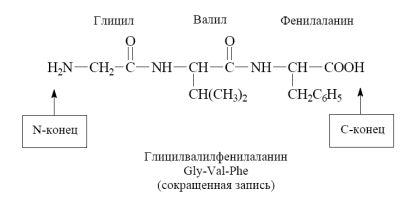
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью.
Аминокислоты – биологически важные органические соединения, состоящие из аминогруппы (-NH 2) и карбоновой кислоты (-СООН), и имеющие боковую цепь, специфичную для каждой аминокислоты. Ключевые элементы аминокислот – углерод, водород, кислород и азот. Прочие элементы находятся в боковой цепи определенных аминокислот. Известно около 500 аминокислот, которые можно классифицировать по-разному. Структурная классификация исходит из положения функциональных групп на альфа-, бета-, гамма- или дельта- положении аминокислоты. Кроме этой классификации, существуют еще и другие, например, классификация по полярности, рН уровню, а также типу группы боковой цепи (алифатические, ациклические, ароматические аминокислоты, аминокислоты, содержащие гидроксил или серу, и т.д.). В виде белков аминокислоты являются вторым (после воды) компонентом мышц, клеток и других тканей человеческого организма. Аминокислоты играют решающую роль в таких процессах, как транспорт нейротрансмиттеров и биосинтезе.
Аминокислоты белков
Аминокислоты, имеющие как амин-, так и карбоксильную группу, прикрепляются к первому (альфа-) атому углерода имеют особое значение в биохимии. Они известны как 2-, альфа или альфа-аминокислоты (общая формула в большинстве случаев H2NCHRCOOH, где R представляет собой органический заместитель, известный как «боковая цепь»); часто термин «аминокислота «относится именно к ним. Это 23 протеиногенных (то есть «служащих для строительства белка») аминокислоты, которые сочетаются в пептидные цепи («полипептиды»), обеспечивая построение широкого спектра белков. Они являются L-стереоизомерами («левыми» изомерами), хотя у некоторых бактерий и в некоторых антибиотиках встречаются некоторые из D-аминокислот («правых» изомеров). 20 из 23 протеиногенных аминокислот кодируются непосредственно триплетными кодонами в генетическом коде и известны как «стандартные» аминокислоты. Остальные три («нестандартные» или «неканонические») – это пирролизин (встречается у метаногенных организмов и других эукариотов), селеноцистеин (присутствует во многих прокариотах и в большинстве эукариотов) и N-формилметионин. Например, 25 человеческих белков включают в свою первичную структуру селеноцистеин, и структурно характеризуются как ферменты (селеноэнзимы), использующие селеноцистеин в качестве каталитического фрагмента на своих активных участках. Пирролизин и селеноцистеин кодируются с помощью вариантных кодонов; например, селеноцистеин кодируется стоп-кодоном и элементом SECIS (инсерционной последовательностью селеноцистеина). Комбинации кодон-тРНК (транспортная рибонуклеиновая кислота), которые не встречаются в природе, также можно использовать для «расширения» генетического кода и создания новых белков, известных как аллопротеины.
Функции аминокислот
Многие протеиногенные и непротеиногенные аминокислоты также играют важную, не связанную с образованием белка, роль в организме. Например, в головном мозге человека глутамат (стандартная глутаминовая кислота) и (» », нестандартная гамма-аминокислота), являются основными возбуждающими и тормозящими нейромедиаторами. Гидроксипролин (основной компонент соединительной ткани коллагена) синтезируют из ; стандартная аминокислота глицин используется для синтеза порфиринов, используемых в эритроцитах. Нестандартный используется для транспорта липидов.
9 из 20 стандартных аминокислот являются «незаменимыми» для человека, потому что они не производятся организмом, их можно получить только с пищей. Другие могут быть условно незаменимы для людей определенного возраста или людей, имеющих какие-либо заболевания.
Из-за своей биологической значимости аминокислоты играют важную роль в питании и обычно используются в пищевых добавках, удобрениях и пищевых технологиях. В промышленности аминокислоты используются при производстве лекарств, биоразлагаемого пластика и хиральных катализаторов.
Аминокислоты. История
Первые несколько аминокислот были открыты в начале 19 века. В 1806 году французские химики Луи Николя Воклен и Пьер Жан Робике изолировали в аспарагине первую аминокислоту, . был обнаружен в 1810 году, хотя его мономер, оставался неоткрытым аж до 1884 года. и были обнаружены в 1820 году. Термин «аминокислота» был введен в английский язык в 1898 году. Было установлено, что аминокислоты можно получить из белков путем ферментативного расщепления или кислотного гидролиза. В 1902 г. Эмиль Фишер и Франц Гофмейстер предположили, что белки являются результатом связи между аминогруппой одной аминокислоты с карбоксильной группой другой, образующих линейную структуру, которую Фишер назвал пептидом.
Общая структура аминокислот
В структуре аминокислот боковая цепь, специфичная для каждой аминокислоты, обозначается буквой R. Атом углерода, находящийся рядом с карбоксильной группой, называется альфа-углерод, и аминокислоты, боковая цепь которых связана с этим атомом, называются альфа-аминокислотами. Они представляют собой наиболее распространенную в природе форму аминокислот. У альфа-аминокислот, за исключением , альфа-углерод является хиральным атомом углерода. У аминокислот, углеродные цепи которых присоединяются к альфа-углероду (как, например, ), углероды обозначаются как альфа, бета, гамма, дельта, и так далее. У некоторых аминокислот аминогруппа прикреплена к бета или гамма-углероду, и поэтому они называются бета- или гамма- аминокислоты.
По свойствам боковых цепей аминокислоты подразделяются на четыре группы. Боковая цепь может делать аминокислоту слабой кислотой, слабым основанием, или эмульсоидом (если боковая цепь является полярной), или гидрофобным, плохо впитывающим воду, веществом (если боковая цепь неполярна).
Термин «аминокислота с разветвленной цепью» относится к аминокислотам, имеющим алифатические нелинейные боковые цепи, это , и . – единственная протеиногенная аминокислота, боковая группа которой прикреплена к альфа-аминогруппе и, таким образом, также является единственной протеиногенной аминокислотой, содержащей на этом положении вторичный амин. С химической точки зрения, пролин, таким образом, является имино кислотой, поскольку в нем отсутствует первичная аминогруппа, хотя в текущей биохимической номенклатуре он все еще классифицируется как аминокислота, а также «N-алкилированная альфа-аминокислота».
Изомерия
Все стандартные альфа-аминокислоты, кроме , могут существовать в форме одной из двух энантиомеров, называемых L или D аминокислоты, представляющих собой зеркальные отображения друг друга. L-аминокислоты представляют собой все аминокислоты, которые находятся в белках при переносе в рибосому, D-аминокислоты находятся в некоторых белках, получаемых путем ферментативных посттрансляционных модификаций после переноса и транслокации в эндоплазматический ретикулум, как, например, у таких экзотических морских организмов, как улитки-конус. Кроме того, они в большом количестве представлены на пептидогликанных клеточных стенках бактерий, а D-серин может выступать в качестве нейротрансмиттера в мозге. Конфигурация аминокислот L и D относится а не к оптической активности самой аминокислоты, а скорее к оптической активности изомера глицеральдегида, из которого, теоретически, можно синтезировать аминокислоту (D-глицеральдегид является правосторонней аминокислотой; L-глицеральдегид – лево). По альтернативной модели, в стереохимии используются буквы (S) и (R). Почти все аминокислоты в белках - (S) при альфа углероде, цистеин - (R), глицин не хирален. Цистеин необычен тем, что в его боковой цепи атом серы находится во втором положении, и имеет большую атомную массу, чем группы, присоединенные к первому углероду, который присоединен к альфа-углероду в других стандартных аминокислотах, при этом аминокислота обозначается как (R).
Стандартные аминокислоты
Аминокислоты являются структурными соединениями (мономерами), из которых состоят белки. Они объединяются между собой, формируя короткие полимерные цепи, называемые пептидами длинной цепи, полипептидами или белками. Эти полимеры являются линейными и неразветвленными, каждая аминокислота в цепи присоединяется к двум соседним аминокислотам. Процесс построения белка называется трансляцией и включает в себя пошаговое добавление аминокислот к растущей цепи белка через рибозимы, осуществляемый рибосомой. Порядок, в котором добавляются аминокислоты, считывается в генетическом коде с помощью шаблона мРНК, который представляет собой копию РНК одного из генов организма.
Двадцать две аминокислоты естественно включены в полипептиды и называются протеиногенными, или природными, аминокислотами. Из них 20 кодируются с помощью универсального генетического кода. Оставшиеся 2, селеноцистеин и пирролизин, включаются в белки при помощи уникального синтетического механизма. Селеноцистеин образуется, когда транслируемый мРНК включает SECIS элемент, вызывающий кодон UGA вместо стоп-кодона. Пирролизин используется некоторыми метаногенными археями в составе ферментов, необходимых для производства метана. Он кодируется с кодоном UAG, который в других организмах обычно играет роль стоп-кодона. За кодоном UAG следует PYLIS последовательность.
Нестандартные аминокислоты
Не-протеиногенные аминокислоты
Помимо 22 стандартных аминокислот существует множество других аминокислот, которые называются не-протеиногенными или нестандартными. Такие аминокислоты либо не встречаются в белках (например, ), либо не производятся непосредственно в изоляции при помощи стандартных клеточных механизмов (например, и ).
Нестандартные аминокислоты, находящиеся в белках, образуются путем пост-трансляционной модификации, то есть модификацией после трансляции в процессе синтеза белка. Эти модификации часто необходимы для функционирования или регуляции белка; например, карбоксилирование глутамата позволяет улучшить связывание ионов , а гидроксилирование важно для поддержания соединительной ткани. Другой пример – формирование гипузина в фактор инициации трансляции EIF5A посредством модификации остатка . Такие модификации могут также определять локализацию белка, например, добавление длинных гидрофобных групп может вызвать связывание белка с фосфолипидной мембраной.
Некоторые нестандартные аминокислоты не встречаются в белках. Это , и . Нестандартные аминокислоты часто встречаются в качестве промежуточных метаболических путей для стандартных аминокислот - например, орнитин и цитруллин встречаются в орнитиновом цикле как часть катаболизма кислоты. Редкое исключение доминированию альфа-аминокислоты в биологии - бета-аминокислота (3-аминопропановая кислота), которая используется для синтеза (витамина B5), компонента коэнзима А у растений и микроорганизмов.
Аминокислоты и питание человека
При введении в организм человека с пищей, 22 стандартные аминокислоты либо используются для синтеза белков и других биомолекул, либо окисляются в мочевину и углекислый газ в качестве источника энергии. Окисление начинается с удаления аминогруппы через трансаминазу, а затем аминогруппа включается в цикл мочевины. Другой продукт трансамидирования – кетокислота, которая входит в цикл лимонной кислоты. Глюкогенные аминокислоты также могут быть преобразованы в глюкозу посредством глюконеогенеза.
входит в состав только нескольких микробов, и только в одном организме имеется как Pyl, так и Sес. Из 22 стандартных аминокислот, 9 называют незаменимыми потому, что человеческий организм не может синтезировать их самостоятельно из других соединений в необходимых для нормального роста количествах, их можно получить только с пищей. Кроме того, и считаются полузаменимыми аминокислотами у детей (хотя таурин технически не является аминокислотой), потому что метаболические пути, которые синтезируют эти аминокислоты, у детей еще не полностью развиты. Необходимые количества аминокислот также зависят от возраста и здоровья человека, поэтому довольно сложно давать здесь общие диетические рекомендации.
Классификация аминокислот
Хотя существует множество способов классификации аминокислот, на основе их структуры и общих химических характеристик их R групп их можно разделить на шесть основных групп:
Алифатические: ,
Гидроксильные или серосодержащие: ,
Циклические:
Ароматические: ,
Основные: ,
Кислотные и их амиды: ,
Небелковые функции аминокислот
Нейромедиатор аминокислоты
В организме человека небелковые аминокислоты также играют важную роль в качестве промежуточных продуктов метаболизма, например, в биосинтезе нейромедиатора . Многие аминокислоты используются для синтеза других молекул, например:
является предшественником нейромедиатора серотонина.
и его предшественник фенилаланин являются предшественниками нейромедиаторов дофамина катехоламинов, адреналина и норадреналина.
является предшественником порфиринов, таких как гем.
является предшественником оксида азота.
и являются предшественниками полиаминов.
, и являются предшественниками нуклеотидов.
является предшественником различных фенилпропаноидов, которые играют важную роль в метаболизме растений.
Тем не менее, все еще известны не все функции других многочисленных нестандартных аминокислот.
Некоторые нестандартные аминокислоты используются растениями для защиты от травоядных животных. Например, является аналогом , который содержится во многих бобовых, и в особо крупных количествах в Canavalia gladiata (канавалия мечевидная). Эта аминокислота защищает растения от хищников, например насекомых, и при употреблении некоторых необработанных бобовых может вызывать заболевания у людей. Небелковая аминокислота содержится в других видах бобовых, особенно в Leucaena leucocephala. Это соединение является аналогом и может вызвать отравление у животных, пасущихся в местах произрастания этих растений.
Использование аминокислот
В промышленности
Аминокислоты используются для различных целей в промышленности, в основном - в качестве добавок в корма для животных. Такие добавки являются чрезвычайно необходимыми, так как во многих основных компонентах таких кормов, например, соевых бобах, очень мало или вовсе нет некоторых незаменимых аминокислот. , являются наиболее важными в производстве подобных кормов. В этой области аминокислоты также используются в хелатных катионах металла, чтобы улучшить поглощение минералов из пищевых добавок, что важно для улучшения здоровья или производительности этих животных.
В пищевой промышленности аминокислоты также широко используются, в частности, используют в качестве усилителя вкуса, а (аспартил-фенилаланин-1-метиловый эфир) – в качестве низкокалорийного искусственного подсластителя. Технологии, использующиеся в промышленности, связанной с кормлением животных, часто используются и в пищевой промышленности для снижения дефицита минеральных веществ (например, при анемии), за счет улучшения усвоения минеральных веществ из неорганических минеральных добавок.
Хелатообразующая способность аминокислот используется в сельскохозяйственных удобрениях для облегчения доставки минеральных веществ в растения при минеральной недостаточности (например, дефиците железа). Эти удобрения также используются для предотвращения возникновения болезней и улучшения общего состояния здоровья растений.
Помимо этого, аминокислоты используются в синтезе лекарств и при изготовлении косметики.
В медицине
Следующие аминокислотные производные имеют фармацевтическое применение:
5-HTP () используется в экспериментальном лечении депрессии.
L-ДОФА () используется в лечении паркинсонизма.
- препарат, ингибирующий орнитиндекарбоксилазу. Используется для лечения сонной болезни.
Расширенный генетический код
С 2001 года 40 неприродных аминокислот были добавлены в белки путем создания уникального кодона (перекодировки) и соответствующего РНК-переносчика: аминоацил - тРНК-синтетазная пара для кодирования его с различными физико-химическими и биологическими свойствами для использования в качестве инструмента для изучения структуры и функции белков или для создания новых или усовершенствования известных белков.
Аминокислоты и создание биоразлагаемых пластмасс и биополимеров
Аминокислоты в настоящее время исследуются в качестве компонентов биоразлагаемых полимеров. Эти соединения будут использоваться для создания экологически чистых упаковочных материалов и в медицине для доставки лекарственных средств и создания протезных имплантатов. Эти полимеры включают полипептиды, полиамиды, полиэфиры, полисульфиды и полиуретаны с аминокислотами, входящими в состав их основной цепи, либо связанными, как боковые цепи. Эти модификации изменяют физические свойства и реакционную способность полимеров. Интересным примером таких материалов выступает полиаспартат, водорастворимый биоразлагаемый полимер, который может найти применение в одноразовых подгузниках и сельском хозяйстве. В связи с его растворимостью и способностью образовывать хелатные соединения ионов металлов, полиаспартат также используется в качестве биоразлагаемого средства от накипи и ингибитора коррозии. Кроме того, в настоящее время разрабатывается ароматическая аминокислота тирозин в качестве возможной замены для токсичных фенолов, таких, как бисфенол А, в производстве поликарбонатов.
Химические реакции аминокислот
Так как аминокислоты имеют как первичную аминогруппу, так и первичную карбоксильную группу, эти химические вещества могут включаться в большинство реакций, связанных с этими функциональными группами, такие как: нуклеофильное присоединение, образования амидной связи и имина для аминогруппы и этерификации, образования амидной связи и декарбоксилирование группы карбоновой кислоты. Сочетание этих функциональных групп позволяет аминокислотам быть эффективными полидентатными лигандами металл-амино кислотных хелатов. Многочисленные боковые цепи аминокислот могут также вступать в химические реакции. Типы этих реакций определяются группами на их боковых цепях и, таким образом, отличаются в различных типах аминокислот.
Синтез аминокислот
Химический синтез аминокислот
Синтез пептида
Существует несколько способов синтеза аминокислот. Один из старейших методов начинается с бромирования на альфа-углероде карбоновой кислоты. Нуклеофильное замещение аммиаком преобразует алкилбромид в аминокислоту. В качестве альтернативы, синтез аминокислот Стрекера включает обработку альдегида цианидом калия и аммиаком, что выводит альфа-амино нитрил в качестве промежуточного соединения. В результате гидролиза нитрила в кислоте получается альфа-аминокислота. Использование в данной реакции аммиака или аммониевых солей дает незамещенную аминокислоту, а замена первичных и вторичных аминов дает замещенную аминокислоту. Кроме того, использование кетонов вместо альдегидов дает альфа, альфа-дизамещенные аминокислоты. В результате классического синтеза получаются рацемические смеси альфа-аминокислот, однако были разработаны некоторые альтернативные процедуры с использованием асимметричных катализаторов.
В настоящее время наиболее принятый метод автоматизированного синтеза на твердой подложке (например, полистирол) с использованием защитных групп (например, Fmoc-и t-Вос) и активирующей группы (например, DCC и DIC).
Образование пептидной связи
Как амино-, так и карбоксильные группы аминокислот могут в результате реакций образовывать амидные связи, одна молекула аминокислоты может взаимодействовать с другой и соединяться через амидную связь. Это полимеризации аминокислот является именно тем механизмом, который создает белки. Эта реакция конденсации приводит к вновь формируемой пептидной связи и образованию молекулы воды. В клетках эта реакция происходит не напрямую, вместо этого аминокислоту сначала активируют путем присоединения к молекуле транспортной РНК посредством сложноэфирной связи. Аминоацил-тРНК производится в АТФ-зависимой реакции на аминоацил тРНК синтетазе. Эта аминоацил-тРНК затем служит субстратом для рибосомы, который катализирует атаку аминогруппы удлиненной белковой цепи на сложноэфирной связи. В результате этого механизма, все белки синтезируются, начиная с N-конца в направлении С-конца.
Однако не все пептидные связи формируются таким образом. В некоторых случаях пептиды синтезируются специфическими ферментами. Например, трипептид играет важную роль в защите клеток от окислительного стресса. Этот пептид синтезируется из свободных аминокислот в две стадии. На первой стадии гамма-глутамилцистеин синтетаза конденсирует цистеин и глутаминовую кислоту посредством пептидной связи, образованной между карбоксильной боковой цепью глутамата (гамма углерод этой побочной цепи) и аминогруппой . Этот дипептид затем конденсируется через синтетазу с образованием .
В химии пептиды синтезируют при помощи различных реакций. В твердофазном синтезе пептидов в качестве активированных единиц чаще всего используются ароматические производные оксимы аминокислот. Их последовательно добавляют к растущей пептидной цепи, которая присоединена к твердой подложке из смолы. Возможность легко синтезировать огромное количество различных пептидов путем изменения типа и порядка аминокислот (с использованием комбинаторной химии) делает синтез пептидов особенно важным в создании библиотек пептидов для использования в создании лекарственных препаратов путем высокопроизводительного скрининга.
Биосинтез аминокислот
В растениях азот впервые был ассимилирован в органическое соединение в виде глутамата, формируемого из альфа-кетоглутарата и аммиака в митохондрии. Для формирования других аминокислот растения используют трансаминазу, чтобы переместить аминогруппу в другую альфа-кето-карбоновую кислоту. Например, аспартатаминотрансфераза преобразует глутамат и оксалоацетат в альфакетоглютарат и аспартат. Другие организмы также используют трансаминазы для синтеза аминокислот.
Нестандартные аминокислоты, как правило, формируются путем модификации стандартных аминокислот. Например, гомоцистеин образуется в результате транссульфирования или деметилирования через промежуточный метаболит S-аденозилметионин, а гидроксипролин производится путем посттрансляционной модификации .
Микроорганизмы и растения могут синтезировать многие необычные аминокислоты. Например, некоторые микроорганизмы могут производить 2-аминоизомасляную кислоту и лантионин, сульфидное производное . Обе эти аминокислоты можно найти в пептидных лантибиотиках, таких как аламетицин. У растений 1-аминоциклопропан-1-карбоновая кислота представляет собой небольшую дизамещенную циклическую аминокислоту, которая является ключевым промежуточным продуктом в производстве этилена у растений.
Катаболизм протеиногенных аминокислот
Аминокислоты могут быть классифицированы в соответствии со свойствами их основных продуктов, как, например:
* Глюкогенные, продукты которых обладают способностью к образованию глюкозы путем глюконеогенеза
* Кетогенные, продукты которых имеют свойство образовывать глюкозу. Эти продукты могут быть использованы для кетогенеза или синтеза липидов.
* Аминокислоты, катаболизируемые как в глюкогенные, так и кетогенные продукты.
Деградация аминокислот часто включает дезаминирование, перемещая аминогруппу в альфакетоглютарат с образованием глутамата. Этот процесс включает трансаминазы, часто такие же, как и использующиеся в аминировании в процессе синтеза. У многих позвоночных аминогруппа затем удаляется через цикл мочевины и выделяется в виде мочевины. Однако, процесс деградации аминокислот может приводить к образованию мочевой кислоты или аммиака. Например, серин дегидратаза преобразует серин в пируват и аммиак. После удаления одной или более аминогрупп, остальная часть молекулы может иногда быть использована для синтеза новых аминокислот или для энергии путем ввода в гликолиз или цикл лимонной кислоты.
Физико-химические свойства аминокислот
20 аминокислот, кодируемых непосредственно генетическим кодом, можно разделить на несколько групп в зависимости от их свойств. Важными факторами являются заряд, гидрофильность или гидрофобность, размер и функциональные группы. Эти свойства важны для структуры белков и белок-белковых взаимодействий. Водорастворимые белки, как правило, имеют гидрофобные остатки (Leu, Ile, Val, Phe и Trp), хранящиеся в середине белка, тогда как гидрофильные боковые цепи подвергаются растворению в воде. Интегральные мембранные белки, как правило, имеют наружные кольца гидрофобных аминокислот, которые закрепляют их в липидный бислой. В случае срединного положения между этими двумя крайностями, некоторые периферические мембранные белки имеют на своей поверхности ряд гидрофобных аминокислот, блокирующихся на мембране. Аналогичным образом, белки, которые связываются с положительно заряженными молекулами, в верхнем слое имеют отрицательно заряженные аминокислоты, такие как глутамат и аспартат, а белки, связывающиеся с отрицательно заряженными молекулами, имеют поверхности с положительно заряженными цепями, такие как лизин и . Существуют различные масштабы гидрофобности аминокислотных остатков.
Некоторые аминокислоты обладают особыми свойствами, например цистеин, который может образовывать ковалентные дисульфидные связи с другими остатками ; пролин, который образует цикл с полипептидной основой, и глицин, более гибкий, чем другие аминокислоты.
Многие белки при наличии дополнительных химических групп на аминокислотах претерпевают ряд посттрансляционных модификаций. Некоторые модификации могут производить гидрофобные липопротеины или гидрофильные гликопротеины. Эти модификации позволяют обращать направленность белка к мембране. Например, добавление и удаление жирных кислот пальмитиновой кислоты в остатки у некоторых сигнальных белков приводит к тому, что белки сначала присоединяются, а затем отделяются от клеточных мембран.
Аминокислоты и рост мышц
Аминокислоты - строительные элементы, из которых состоят все белки организма. В бодибилдинге аминокислотам уделяется особое значение, потому что мышцы практически полностью состоят из белка, то есть аминокислот. Организм использует их для собственного роста, восстановления, укрепления и выработки различных гормонов, антител и ферментов. От них зависит не только рост силы и «массы» мышц, но и восстановление физического и психического тонуса после тренировки, катаболизм подкожного жира и даже интеллектуальная деятельность мозга - источник мотивационных стимулов. Ученые установили, что аминокислоты чрезвычайно важны для восстановления мышц после тренировок, сохранения мышц во время цикла сушки или похудения, а также роста мышц.
Список Аминокислот
| 2014/07/11 00:29 | Наталья | |
| 2014/11/02 15:28 | Наталья | |
| 2015/01/21 16:10 | Наталья | |
| 2014/06/04 14:24 | Наталья | |


