Для поступающих в вузы химического профиля
При изучении предмета «химия»
сведениям о собственно химических превращениях
предшествуют данные о составе и строении
вещества, его физических свойствах.
Эту науку иногда называют молекулярной химией.
Вообще индивидуальные особенности вещества (свойства), позволяющие распознать его и отличить от других веществ, разделяют на две группы. Одну из них представляют химические свойства вещества, обусловливающие его способность превращаться в другие, новые вещества. В нашей статье будут затронуты физические свойства вещества, не связанные с изменением его химической природы.
К физическим свойствам
вещества относятся:
а) агрегатное состояние (газ, жидкость, твердое
тело) при нормальных условиях (0 °С, 1 атм); б)
цвет; в) запах; г) плотность; д) температуры
плавления и кипения; е) тепло- и
электропроводность; ж) растворимость в воде и
других растворителях. Именно физические
свойства являются главным стержнем новой
области знаний, получившей название
«супрамолекулярная химия» (см.: Пожарский А.Ф.
Соросовский образовательный журнал, 1997, № 9, с.
32–39).
Если классическая химия имеет дело главным образом с реакциями, в которых происходят разрыв и образование валентных связей, то объектом изучения супрамолекулярной химии (или химии межмолекулярных связей) служат невалентные взаимодействия: водородная связь, электростатические взаимодействия, структуры «без связи». Сочетание известной прочности 1 и способности к быстрым и обратимым изменениям – характерное свойство всех биологических молекулярных структур: нуклеиновых кислот, белков, ферментов, переносчиков частиц.
Все вещества состоят из атомов, молекул или ионов. Определим каждое из этих понятий. Атомами называют мельчайшие частицы вещества, характеризующиеся следующим строением: положительно заряженное ядро (плотное, тяжелое) и отрицательно заряженная электронная оболочка (рыхлая, легкая). Разновидности атомов (~100) отличаются друг от друга зарядом ядра. Единицу положительного заряда несет элементарная частица протон р (заряд +1). Число протонов у атомов различных видов разное. Число протонов определяет заряд ядра Z . Это число равно атомному номеру химического элемента в периодической системе.
Кроме протонов в состав ядра входят нейтральные элементарные частицы нейтроны n (заряд 0). По массе они примерно такие же, как протоны: m (n ) » m (p ) » 1 а. е. м. (атомная единица массы). Общее число протонов и нейтронов в ядре показывает массовое число А . Величина А обычно близка к целочисленному значению атомной массы элемента. Число нейтронов (N ) в ядре атома определяется путем вычитания из массового числа А числа протонов, равного заряду ядра Z : N = A – Z .
Атомы одного вида, ядра которых содержат одинаковое число протонов и разное число нейтронов, называют изотопами . Каждый элемент может иметь несколько изотопов. При обозначении изотопа вверху слева от символа элемента указывают его массовое число, а внизу слева – атомный номер. Например, у атома магния с порядковым (атомным) номером 12 есть три стабильных изотопа:
Единицей отрицательного заряда служит электрон е (заряд –1). Атом является электроотрицательной частицей: заряды ядра и электронной оболочки равны по величине и противоположны по знаку. В табл. 1 представлены количественные характеристики шести изотопов химических элементов.
Таблица 1

Благодаря химической связи из атомов образуются более сложные частицы – молекулы. Молекулой называют группу атомов (два или более) простого или сложного вещества, внутри которой связи между атомами значительно прочнее, чем связи между разными молекулами. Например, в молекулах простых веществ кислорода О 2 и азота N 2 химическая связь (показана черточками) между парой атомов, составляющих молекулу (О=О и N є N), прочная, а межмолекулярная связь, показанная точками (О=О...О=О...О=О), на несколько порядков слабее. Молекулы, как и атомы, – электронейтральные частицы.
Удаление из атомов одного или нескольких электронов не приводит к образованию атома нового элемента. Так, если из нейтрального атома лития Li, содержащего три электрона, удалить один электрон, то атом элемента лития сохранится, однако заряд его будет +1 (Li +). Заряд +1 возникает за счет того, что в этом случае заряд ядра +3 не будет полностью нейтрализован зарядом –2 оставшихся в атоме двух электронов, т. е. +3 – 2 = +1.
Аналогично, если к нейтральному атому фтора F присоединить один электрон, то образуется не атом нового элемента, а заряженный (заряд –1) атом элемента фтора (F –).
Итак, при удалении из нейтрального атома или присоединении к нему электронов атом приобретает заряд, равный числу перемещенных электронов. Атом, имеющий электрический заряд, называют ионом . Положительные ионы называют катионами , отрицательные – анионами .
Между противоположно заряженными ионами существует притяжение, обусловливающее устойчивость соединения. Связь между ионами Li + и F – называется ионной связью . К числу соединений с ионной связью относят большинство солей (в них металл соединен с кислотным остатком, например NaCl, MgSO 4), оксидов и гидроксидов металлов (BaO, Na 2 O; KOH, Fe(OH) 2).
Вещества молекулярного строения – газы: кислород О 2 , азот N 2 , сероводород H 2 S; жидкости: вода Н 2 О, триоксид серы SO 3 , бром Br 2 ; твердые вещества: нафталин С 10 Н 8 , сахароза C 12 H 22 O 11 , пентахлорид фосфора PCl 5 .
Химическая связь между атомами в молекуле характеризуется такими параметрами, как энергия связи, длина, кратность и полярность связи.
Энергия связи (Е св) – это энергия, необходимая для разрыва данной связи в 1 моль (N A = 6,02 10 23 молекул) вещества. Например, энергия связи между атомами в молекуле хлора Cl 2 для N A молекул равна энергии, затрачиваемой на расщепление 1 моль Cl 2 до атомов хлора:
Кратность связи определяется числом электронных пар, связывающих два атома (в записи на бумаге – числом черточек между атомами). Так, в этане Н 3 С–СН 3 связь между атомами углерода одинарная, в этилене Н 2 С=СН 2 – двойная, в ацетилене НС є СН – тройная. С увеличением кратности связи энергия связи возрастает. Энергии связей С–С, С=С и С є С составляют соответственно 348, 614 и 839 кДж/моль. Энергия одинарной связи О–О в пероксидах типа НО–ОН имеет значение Е св = 146 кДж/моль, а двойной связи О=О в молекулярном кислороде – Е св = 495 кДж/моль.
Длиной связи (l св) называют расстояние между ядрами соединенных атомов. Длины связей в различных соединениях примерно одного порядка и имеют значение десятых долей нанометра (1 нм = 10 –9 м). При увеличении кратности происходит уменьшение длин связей: l св (N–N) = 0,145 нм, l св (N=N) = 0,125 нм и l св (N є N) = 0,109 нм. Длины связей С–С, С=С и С є С равны соответственно 0,154, 0,134 и 0,120 нм.
Полярность связи обусловливается смещением связывающей электронной пары к одному из атомов, в результате чего образуется диполь 2 , который измеряется дипольным моментом (m ) – произведением концевого заряда (q ) на расстояние между зарядами (l ): m = q l . Cледовательно, дипольный момент тем больше, чем больше накапливаемые при разделении заряды и чем больше расстояние между положительным и отрицательным зарядами. Дипольный момент выражают в кулон-метрах (Кл м) или в дебаях (Д) (1 Д = 3,3 10 –30 Кл м). Если отрицательный заряд, равный заряду электрона (1,6 10 –19 Кл), и такой же положительный заряд находятся на расстоянии 0,1 нм, то дипольный момент равен: m = 1,6 10 –19 10 –10 = 1,6 10 –29 Кл м.
Зная дипольный момент молекулы HCl m = 3,44 10 –30 Кл м и межъядерное расстояние l (H–Cl) = 0,127 нм, можно рассчитать, что на атоме водорода имеется положительный заряд, а на атоме хлора – отрицательный, составляющий 0,17 от заряда электрона. Подобный расчет для молекулы KCl дает значения зарядов на атомах калия и хлора по 0,83 единицы заряда.
Приведем дипольные моменты некоторых химических связей (табл. 2).
Таблица 2

В этих примерах водород и углерод являются положительными концами диполей. У связи Н–С отрицательным полюсом диполя является углерод.
Дипольный момент молекулы, содержащей более двух атомов, зависит как от полярности связей, так и от молекулярной геометрии. Многоатомная молекула может иметь дипольный момент только в том случае, если ее связи полярны. Однако даже при наличии полярных связей молекула как целое может не иметь дипольного момента, если связи направлены так, что их полярности взаимно компенсируются. Это наблюдается в случае линейной молекулы СО 2:
Здесь стрелки указывают направление дипольного момента в сторону более электроотрицательного атома. Приведем ряд электроотрицательности 3 отдельных элементов (табл. 3).
Таблица 3
![]()
Поскольку кислород более электроотрицателен, чем углерод, связи в молекуле СО 2 оказываются полярными с повышенной концентрацией электронной плотности на атомах кислорода. Однако центры отрицательного и положительного зарядов совмещены в одной точке на атоме углерода, поэтому молекула в целом не имеет результирующего дипольного момента.
Другими примерами неполярных молекул, каждая из которых имеет полярные связи, являются трифторид бора ВF 3 , тетрахлорид углерода ССl 4 , гексафторид серы SF 6:

Симметричное расположение связей в неполярных молекулах служит причиной отсутствия у них положительно и отрицательно заряженных сторон.
- Задача
. Какие из
предложенных соединений имеют дипольный момент?
Если молекула обладает дипольным моментом,
укажите его направление:
а) NH 3 ; б) H 2 O; в) CH 4 ; г) CH 3 Cl; д) CH 2 Cl 2 ; е) CH 2 O; ж) HCN.
Решение
Согласно теории отталкивания валентных электронных пар, как связывающие электронные пары, так и свободные (типа обозначенных точками в молекулах аммиака Н 3 и воды Н 2:), принадлежащие одному атому, располагаются в пространстве как можно дальше друг от друга.
а) Аммиак представляет собой тригональную пирамидальную молекулу с неподеленной электронной парой в вершине пирамиды:

б) Молекула воды Н 2 О имеет уголковую структуру:

Молекулы NH 3 , H 2 O, CH 4 , CH 3 Cl и CH 2 Cl 2 имеют четыре валентные электронные пары вокруг центрального атома. Это определяет пространственную ориентацию присоединенных к центральному атому краевых атомов. У пяти названных соединений примерно тетраэдрическое расположение электронных пар.
в) Для молекулы метана СН 4 при соединении атомов водорода линиями получаем правильный тетраэдр с углеродом в центре:

г) В молекуле хлорметана СН 3 Сl дипольный момент направлен вдоль связи С–Сl. В этом диполе частичный отрицательный заряд находится на хлоре, а углерод и атомы водорода являются положительным концом диполя:
д) В молекуле дихлорметана CH 2 Cl 2 вклад дипольных моментов отдельных связей выглядит следующим образом:

Диполи связей C–H усиливают дипольный момент связей С–Сl в CH 2 Cl 2 .
е) Учитывая отталкивание валентных электронных пар, можно предположить, что валентные углы у атома С в формальдегиде СН 2 О будут равны ~120° (плоская тригональная структура, как у BF 3). Однако распределение заряда в СН 2 О асимметрично. Дипольный момент направлен по биссектрисе угла с отрицательным концом диполя на кислороде:
ж) В молекуле цианистого водорода Н–С є N имеется тройная связь. Поэтому все валентные электроны углерода участвуют в образовании химических связей. Строение молекулы линейное, таким образом достигается максимальное удаление электронов одинарной связи Н–С от электронов тройной связи C є N.
Дипольный момент направлен вдоль оси с частичным отрицательным зарядом на азоте.
Физические свойства органических веществ
Органической называют химию соединений углерода. При этом карбонаты металлов (Na 2 CO 3 , FeCO 3 , CaCO 3) и карбиды (СаС 2 , Al 4 C 3) обычно изучают в неорганической химии.
Под физическими свойствами вещества понимают его температуры кипения (t кип) и плавления (t пл), растворимость в воде. Эти характеристики напрямую связаны с величиной дипольного момента m .
При определенных условиях большинство веществ способно существовать в любом из трех агрегатных состояний: в твердом, жидком или газообразном. В газах молекулы находятся далеко друг от друга и не оказывают значительного взаимного влияния. Разнообразие физических свойств жидких и твердых веществ определяется главным образом действующими внутри них межмолекулярными силами притяжения, благодаря которым молекулы удерживаются возле друг друга. Рассмотрим взаимосвязь между строением вещества, действующими в нем межмолекулярными силами и его физическими свойствами.
Все межмолекулярные силы имеют электростатическую природу. Они подчиняются закону Кулона, согласно которому разноименные заряды притягиваются, а одноименные отталкиваются. В простейшем случае сила притяжения или отталкивания (F ) прямо пропорциональна произведению модулей зарядов (q 1 и q 2) и обратно пропорциональна квадрату расстояния (r ) между ними:
F = k (|q 1 ||q 2 |)/r 2 , где k – коэффициент пропорциональности.
Силы взаимодействия между нейтральными молекулами обычно намного меньше сил, удерживающих атомы в молекуле. Например, для испарения 1 моль жидкого HCl требуется 16 кДж теплоты, а для диссоциации того же количества HCl на атомы Н и Cl – уже 431 кДж.
Остановимся на двух типах межмолекулярных сил, характерных для органических веществ: диполь-дипольном взаимодействии и дисперсионном (наведенный диполь – наведенный диполь) взаимодействии.
Диполь-дипольные силы действуют между полярными молекулами.
Типы ориентации диполей:
(Стрелками показано направление действия сил.)
Температура кипения органических жидкостей повышается по мере возрастания молекулярного дипольного момента (табл. 4). Энергия притяжения (Е ) между дипольными молекулами подчиняется зависимости:
Е = m 4 /d 6 , где m – дипольный момент; d – расстояние между центрами диполей.
Таблица 4
Молекулярные массы, дипольные моменты и температуры кипения органических соединений

Индуцированный (наведенный) диполь возникает в результате неравномерного распределения молекулярных зарядов вследствие каких-то причин (например, случайного смещения электронов в одну сторону от ядра). Этот мгновенный дипольный момент индуцирует (вызывает) аналогичный дипольный момент у соседнего атома, потому что перемещение электронов в соседних атомах отчасти взаимозависимо (из-за взаимного отталкивания).
Схема взаимодействия индуцированных (мгновенных) диполей и электростатического притяжения между атомами:

Дисперсионные силы взаимодействия между двумя молекулами изменяются по закону F » 1/d 6 . Следовательно, эти силы имеют достаточно большую величину лишь при очень близком расположении молекул друг к другу. Величина дисперсионных сил притяжения зависит от способности молекул поляризоваться, т. е. деформировать свое электронное облако. Вообще говоря, чем больше молекула и чем дальше ее валентные электроны располагаются от ядер, тем больше ее поляризуемость. Значит, дисперсионные силы возрастают с увеличением размеров молекул и их молекулярной массы. Определенную роль играет и форма молекул.
Например, неопентан и н -пентан имеют одинаковую молекулярную формулу С 5 Н 12 , однако температура кипения н -пентана (36 °С) выше, чем у неопентана (9,5 °С). Такое различие объясняют разной формой молекул двух веществ:
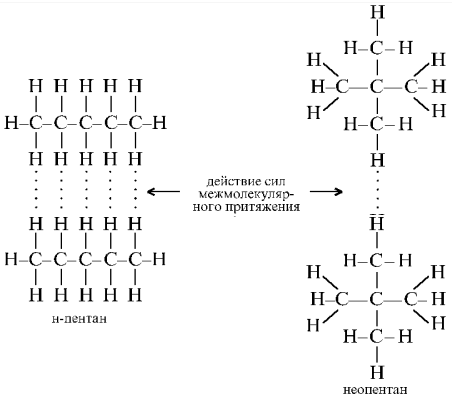
Молекулы н -пентана сильнее притягиваются друг к другу, потому что обладают большим числом центров взаимодействия (плотная упаковка) и способны вступать в контакт по всей длине молекулы. У молекул неопентана (неплотная упаковка) поверхность возможных контактов гораздо меньше.
Другие примеры различия в физических константах изомеров представлены в табл. 5.
Таблица 5
Температуры кипения и плавления изомеров бутана и гексана

Упражнения
1. Для каждой из следующих молекул, содержащих полярные ковалентные связи, укажите положительный и отрицательный концы диполя (стрелкой ®). Используйте ряд электроотрицательности элементов.
а) HCl; б) IСl; в) HOCl; г) COCl 2 .
2. Какое соединение из каждой пары имеет больший дипольный момент m? Почему?
а) (СН 3) 3 СН и (СН 3) 3 Сl; б) СНСl 3 и ССl 3 F;
в) СН 3 NН 2 и СН 3 OH; г) СН 3 NН 2 и СН 3 NО 2 .
3. Подберите алканы, соответствующие следующим температурам кипения, °С: 106, 116, 126, 151. Алканы: октан СН 3 (СН 2) 6 СН 3 ; 2-метилгептан (СН 3) 2 СН(СН 2) 4 СН 3 ; 2,2,3,3-тетраметилбутан (СН 3) 3 СС(СН 3) 3 ; нонан СН 3 (СН 2) 7 СН 3 .
4. Для трех изомеров гептана состава С 7 Н 16 – н -гептана СН 3 (СН 2) 5 СН 3 , 2-метилгексана (СН 3) 2 СН(СН 2) 3 СН 3 и 2,4-диметилпентана (СН 3) 2 СНСН 2 СН(СН 3) 2 – установите, какому соединению соответствует конкретная температура кипения. Значения t кип этих веществ, °С: 80, 90 и 98.
________________________
1 Энергия невалентных взаимодействий в 10–100 раз меньше энергии валентных связей, но ее бывает достаточно для создания прочных и эластичных ассоциатов.
2 Диполь – это совокупность двух разноименных, но равных по абсолютной величине электрических зарядов, находящихся на некотором расстоянии друг от друга.
3 Электроотрицательностью называют способность атомов в молекуле смещать общую (связывающую) электронную пару.
А.Д.Микитюк
точнее - из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов, образующих химические связи (см. Валентность ). Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул данного вещества не зависят от способа его получения. В случае одноатомных молекул (например, инертных газов) понятия Молекула и атома совпадают.Впервые понятие о Молекула было введено в химии в связи с необходимостью отличать Молекула как наименьшее количество вещества, вступающее в химические реакции, от атома как наименьшего количества данного элемента, входящего в состав Молекула (Международный конгресс в Карлсруэ, 1860). Основные закономерности строения Молекула были установлены в результате исследования химических реакций, анализа и синтеза химических соединений, а также благодаря применению ряда физических методов.
Атомы объединяются в Молекула в большинстве случаев химическими связями. Как правило, такая связь создаётся одной, двумя или тремя парами электронов, которыми владеют сообща два атома. Молекула может содержать положительно и отрицательно заряженные атомы, т. е. ионы; в этом случае реализуются электростатические взаимодействия. Помимо указанных, в Молекула существуют и более слабые взаимодействия между атомами. Между валентно не связанными атомами действуют силы отталкивания.
Состав Молекула выражают формулами химическими . Эмпирическая формула (например, С 2 Н 6 О для этилового спирта) устанавливается на основании атомного соотношения содержащихся в веществе элементов, определяемого химическим анализом, и молекулярной массы .
Развитие учения о структуре молекул неразрывно связано с успехами прежде всего органической химии. Теория строения органических соединений, созданная в 60-х гг. 19 в. трудами А. Молекула Бутлерова , Ф. А. Кекуле , А. С. Купера и др., позволила представить строение молекул структурными формулами или формулами строения, выражающими последовательность валентных химических связей в Молекула При одной и той же эмпирической формуле могут существовать Молекула разного строения, обладающие различными свойствами (явление изомерии ). Таковы, например, этиловый спирт С 5 Н 5 ОН и диметиловый эфир (СН 3) 2 О. Структурные формулы этих соединений разнятся:
В некоторых случаях изомерные Молекула быстро превращаются одна в другую и между ними устанавливается динамическое равновесие (см. Таутомерия ). В дальнейшем Я. Х. Вант-Гофф и независимо французский химик А. Ж. Ле Бель пришли к пониманию пространственного расположения атомов в молекуле и к объяснению явления стереоизомерии. А. Вернер (1893) распространил общие идеи теории строения на неорганические комплексные соединения. К началу 20 в. химия располагала подробной теорией строения Молекула , исходящей из изучения только их химических свойств. Замечательно, что прямые физические методы исследования, развитые позднее, в подавляющем большинстве случаев полностью подтвердили структурные формулы химии, установленные путём исследования макроскопических количеств вещества, а не отдельных Молекула
В физике понятие о Молекула оказалось необходимым для объяснения свойств газов, жидкостей и твёрдых тел. Прямое экспериментальное доказательство существования Молекула впервые было получено при изучении броуновского движения (французский физик Ж. Перрен, 1906).
В твёрдом теле Молекула могут сохранять или не сохранять свою индивидуальность. Так, большинство Молекула органических соединений образует молекулярные кристаллы , в узлах решёток которых находятся Молекула , связанные одна с другой относительно слабыми силами межмолекулярного взаимодействия. Напротив, в ионных (например, в случае ) и атомных (алмаз) кристаллах нет отдельных Молекула и весь кристалл подобен одной Молекула (см. Кристаллохимия ). Структура Молекула может изменяться при переходе от кристалла к газу. Так, 2 5 в газе состоит из единых Молекула , в кристалле - из ионов O 2 + и O 3 - ; газообразный 5 - из Молекула с конфигурацией тригональной бипирамиды, твёрдый - из октаэдрического иона 6 - и тетраэдрического иона 4 + .
Равновесные межъядерные расстояния r
0 и энергии диссоциации D
(при 25°С) некоторых двухатомных молекул
| Молекула | r 0, Ǻ | D, кдж/моль (ккал/моль ) | Молекула | r 0 , Ǻ | D,Кдж/моль (ккал/моль ) |
| 2 | 0,74 | 426,5 (104,18) | 2 | 2,14 | 192,7 (46) |
| 2 | 2,67 | 104,7 (25) | 2 | 2,67 | 147,1 (35,1) |
| 2 | 1,09 | 94,3 (22,5) | LiH | 1,59 | 243 (58) |
| O 2 | 1,21 | 495,7 (118,3) | NaH | 1,89 | 196,9 (47) |
| 2 | 1,48 | 155 (37) | HhF | 0,92 | 565,6 (135) |
| Na 2 | 3,08 | 78,5 (17,3) | H | 1,27 | 431,6 (103) |
| 2 | 1,99 | 242,6 (57,9) | H | 1,60 | 264 (63) |
Строение молекул. Геометрическая структура Молекула определяется равновесным расположением атомных ядер. Энергия взаимодействия атомов зависит от расстояния между ядрами. На очень больших расстояниях эта энергия равна нулю; если при сближении атомов образуется химическая связь, то атомы сильно притягиваются друг к другу (слабое притяжение наблюдается и без образования химической связи); при дальнейшем сближении атомов действуют электростатические силы отталкивания атомных ядер; препятствием к сильному сближению атомов является также невозможность совмещения их внутренних электронных оболочек. На рис. 1 показана зависимость потенциальной энергии двухатомной Молекула от межъядерного расстояния r . Эта энергия минимальна при равновесном расстоянии r 0 , стремится к нулю при r ® ¥ и возрастает до ¥ при r ® 0. Разность энергий при r = r 0 и r ® ¥ характеризует энергию связи, энергию диссоциации D . Равновесные расстояния r 0 в двухатомных и многоатомных Молекула и, следовательно, расположение атомных ядер в Молекула определяются методами спектроскопии, рентгеновского структурного анализа и электронографии , а также нейтронографии , позволяющими получить сведения и о распределении электронов (электронной плотности) в Молекула Рентгенографическое изучение молекулярных кристаллов даёт возможность установить геометрическое строение очень сложных Молекула , вплоть до Молекула белков. Косвенную, но весьма детальную информацию о строении сложных Молекула получают различными спектроскопическими методами, в особенности с помощью спектров ядерного магнитного резонанса (ЯМР). Геометрия простых Молекула , содержащих малое число атомов, также эффективно исследуется методами спектроскопии. Расстояния (в Ǻ) между 2 данными валентно связанными атомами приблизительно постоянны в Молекула различных соединений, они уменьшаются с увеличением кратности связи:
| - ……………. | 1,54 | - …………….. | 1,39 |
| = ……………... | 1,34 | - ……………. | 1,77 |
| - - - (в бензоле)... | 1,39 | -Br……………. | 1,92 |
| º ……………... | 1,2 | - ……………… | 2,1 |
| -H…………….. | 1,09 | - …………….. | 1,82 |
| -O…………….. | 1,42 | O-H……………. | 0,96 |
| =O……………... | 1,21 | -H…………….. | 1,01 |
| - …………….. | 1,46 | S-H…………….. | 1,35 |
Можно приписать каждому атому в данном валентном состоянии в М определённый атомный, или ковалентный, радиус (в случае ионной связи - ионный радиус, см. Атомные радиусы , Ионные радиусы ), характеризующий размеры электронной оболочки атома (иона), образующего химическую связь в Молекула Представление о приблизительном постоянстве этих радиусов оказывается полезным при оценке межатомных расстояний и, следовательно, при расшифровке структуры Молекула Длина связи представляет собой сумму соответствующих атомных радиусов.
Размер Молекула
как целого, т. с. размер её электронной оболочки, есть величина до некоторой степени условная - имеется отличная от нуля, хотя и весьма малая, вероятность найти электроны Молекула
и на большом расстоянии от её атомных ядер. Практически размеры Молекула
определяются равновесным расстоянием, на которое они могут быть сближены при плотной упаковке Молекула
в молекулярном кристалле и в жидкости. На больших расстояниях Молекула
притягиваются одна к другой, на меньших - отталкиваются. Размеры Молекула
поэтому можно найти с помощью рентгеноструктурного анализа молекулярных кристаллов, порядок величины этих размеров может быть определён из коэффициентов диффузии, теплопроводности и вязкости газов и из плотности вещества в конденсированном состоянии. Расстояние, на которое могут сблизиться валентно не связанные атомы, принадлежащие одной и той же Молекула
или различным Молекула
, может быть охарактеризовано средними значениями т. н. ван-дер-ваальсовых радиусов (в Ǻ):
| H……... | 1,0-1,2 | S……… | 1,9 |
| ……... | 1,75-2,0 | …….. | 1,0 |
| ……... | 1,5 | …….. | 2,2 |
| ……… | 1,9 | ……… | 1,4 |
| …….. | 2,0 | ……... | 1,8 |
| …….. | 2,2 | Br……... | 2,0 |
| O……… | 1,4 | ………. | 2,2 |
Ван-дер-ваальсовы радиусы существенно превышают ковалентные. Зная величины ван-дер-ваальсовых, ковалентных, а также ионных радиусов, можно построить наглядные модели Молекула , отражающие форму и размеры их электронных оболочек (рис. 2 ).
Ковалентные химические связи в Молекула расположены под определёнными углами, зависящими от состояния гибридизации атомных орбиталей (см. Валентность ). Так, для Молекула насыщенных органических соединений характерно тетраэдрическое расположение связей, образуемых атомом углерода; для Молекула с двойной связью (С=С) - плоское расположение связей атомов углерода; в Молекула соединений с тройной связью (СºС) - линейное расположение связей:

Таким образом, многоатомная Молекула обладает определённой конфигурацией в пространстве, т. е. определённой геометрией расположения связей, которая не может быть изменена без их разрыва. Молекула характеризуется той или иной симметрией расположения атомов. Если Молекула не имеет плоскости и центра симметрии, то она может существовать в двух конфигурациях, представляющих зеркальные отражения одна другой (зеркальные антиподы, или стереоизомеры, см. Изомерия ). Все важнейшие биологически функциональные вещества в живой природе фигурируют в форме одного определённого стерсоизомера.
Молекула , содержащие единичные связи, или сигма-связи, могут существовать в различных конформациях , возникающих при поворотах атомных групп вокруг единичных связей. Важные особенности макромолекул синтетических и биологических полимеров определяются именно их конформационными свойствами.
Взаимодействие атомов в молекуле. Природа химических связей в Молекула оставалась загадочной вплоть до создания квантовой механики - классическая физика не могла объяснить насыщаемость и направленность валентных связей. Основы теории химической связи были созданы В. Гейтлером и немецким учёным Ф. Лондоном в 1927 на примере простейшей молекулы Н 2 . В дальнейшем теория и методы расчёта были значительно усовершенствованы, в частности на основе широкого применения молекулярных орбиталей метода , и квантовая химия позволяет вычислять межатомные расстояния, энергии Молекула , энергии химических связей и распределение электронной плотности для сложных Молекула ; при этом расчётные данные хорошо согласуются с экспериментальными.
Химические связи в Молекула подавляющего числа органических соединений являются ковалентными. Напротив, в ряде неорганических соединений существуют ионные, а также донорно-акцепторные связи (см. Химическая связь ), реализуемые в результате обобществления неподелённой пары электронов данного атома. Энергия образования Молекула из атомов во многих рядах сходных соединений приближённо аддитивна. Иными словами, в этих случаях можно считать, что энергия Молекула есть сумма энергии её связей, имеющих постоянные значения в рассматриваемом ряду. Отсюда следует практическая возможность приписать химическим связям приближённо автономные электронные оболочки.
Аддитивность энергии Молекула выполняется не всегда. Яркий пример нарушения аддитивности представляют плоские Молекула органических соединений с т. н. сопряжёнными связями, т. е. с кратными связями, чередующимися с единичными. В этих случаях валентные электроны, определяющие кратность связей, т. н. p-электроны, становятся общими для всей системы сопряжённых связей, делокализованными. Такая делокализация электронов приводит к дополнительной стабилизации Молекула Например, энергия образования Молекула 1,3-бутадиена Н 2 С= H- H= H 2 больше ожидаемой по аддитивности на 16,8 кдж/моль (на 4 ккал/моль ). Выравнивание электронной плотности вследствие обобществления p-электронов по связям выражается в удлинении двойных связей и укорочении единичных. В правильном шестиугольнике межуглеродных связей и бензола (см. формулу) все связи одинаковы и имеют длину, промежуточную между длиной единичной и двойной связи. Сопряжение связей ярко проявляется в молекулярных спектрах (см. ниже).

Современная квантовомеханическая теория химической связи учитывает частичную делокализацию не только p-, но и s-электронов, наблюдающуюся в любых молекулах. Вообще говоря, это не нарушает аддитивности энергий молекул.
В подавляющем большинстве случаев суммарный спин валентных электронов в Молекула равен нулю, т. е. спины электронов попарно насыщены. Молекула , содержащие неспаренные электроны - радикалы свободные (например, атомный водород Н · · , метил H· · 3), обычно неустойчивы, т. к. при их соединении друг с другом происходит значительное понижение энергии вследствие образования валентных связей. Наиболее эффективным методом изучения строения свободных радикалов является электронный парамагнитный резонанс (ЭПР).
Электрические и оптические свойства молекул. Поведение вещества в электрическом поле определяется основными электрическими характеристиками Молекула - постоянным дипольным моментом и поляризуемостью. Дипольный момент означает несовпадение центров тяжести положительных и отрицательных зарядов в Молекула , т. е. электрическую асимметрию Молекула Соответственно Молекула , имеющие центр симметрии, например H 2 , лишены постоянного дипольного момента; напротив, в H электроны смещены к атому и дипольный момент равен 1,03 D (1,03×10 -18 ед. СГС). Поляризуемостью характеризуется способность электронной оболочки любой Молекула смещаться под действием электрического поля, в результате чего в Молекула создаётся индуцированный дипольный момент. Значения дипольного момента и поляризуемости находят экспериментально с помощью измерений диэлектрической проницаемости . В случае аддитивности свойств Молекула дипольный момент Молекула может быть представлен суммой дипольных моментов связей (с учётом их направления), то же относится к поляризуемости Молекула
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны - тем самым они определяются поляризуемостью Молекула вещества. С поляризуемостью непосредственно связаны преломление и рассеяние света, оптическая активность и другие явления, изучаемые молекулярной оптикой - разделом физической оптики, посвященным изучению оптических свойств вещества.
Магнитные свойства молекул. Молекула и макромолекулы подавляющего большинства химыических соединений диамагнитны (см. Диамагнетизм ). Магнитная восприимчивость Молекула (c) в ряде органических соединений может быть выражена как сумма значений c для отдельных связей; однако аддитивность c выполняется хуже, чем аддитивность поляризуемостей a. И c, и a определяются свойствами внешних электронов Молекула ; эти две величины связаны одна с другой.
Парамагнитны Молекула , обладающие постоянным магнитным моментом (см. Парамагнетизм ). Таковы Молекула с нечётным числом электронов во внешней оболочке (например, O и любые свободные радикалы), Молекула , содержащие атомы с незамкнутыми (незаполненными) внутренними оболочками (переходные металлы и др.). Магнитная восприимчивость парамагнитных веществ зависит от температуры, т. к. тепловое движение препятствует ориентации магнитных моментов в магнитном поле. Строение парамагнитных Молекула эффективно изучается методом ЭПР.
Атомные ядра элементов, у которых атомный номер или массовое число нечётны, обладают ядерным спиновым парамагнетизмом. Для таких ядер характерен ядерный магнитный резонанс (ЯМР), спектр которого зависит от электронного окружения ядер в Молекула .
Частоты в спектрах, соответствующих вращательным переходам, зависят от моментов инерции Молекула , определение которых из спектроскопических данных позволяет получить наиболее точные значения межатомных расстояний в Молекула
Общее число линий или полос в колебательном спектре Молекула зависит от её симметрии. Частоты колебаний, наблюдаемые в спектрах, определяются, с одной стороны, массами атомов и их расположением, с другой - динамикой межатомных взаимодействий. Теория колебаний многоатомных Молекула соответственно опирается на теорию химического строения и классическую механику связанных колебаний. Исследование колебательных спектров позволяет сделать ряд выводов о строении Молекула , о межатомных и межмолекулярных взаимодействиях, изучать явления таутомерии, поворотной изомерии.
Электронные переходы в Молекула характеризуют структуру их электронных оболочек, состояние химических связей. Спектры Молекула , обладающих большим числом сопряжённых связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Вещества, построенные из таких Молекула , обладают цветностью, к ним относятся все органические красители. Изучение электронно-колебательных спектров Молекула необходимо для понимания естественной и магнитной оптической активности.
Молекулы в химии, физике и биологии.
Понятие о Молекула
- основное для химии, и большей частью сведений о строении и функциональности Молекула
наука обязана химическим исследованиям. При химической реакции происходит превращение одних Молекула
в другие. Для такого превращения обычно необходима некоторая избыточная энергия Молекула
- энергия активации (см. Кинетика химическая
).
В акте химического взаимодействия Молекула
проходят через конфигурацию т. н. активированного комплекса, или переходного состояния Молекула
Характер и скорость химической реакции определяются этим состоянием, в свою очередь зависящим от строения взаимодействующих Молекула
Химия решает две главные задачи, относящиеся к Молекула
, - устанавливает строение Молекула
на основании химических реакций и, наоборот, на основе строения Молекула
определяет ход реакций. Широкая совокупность важнейших проблем современной химии, в том числе и нерешённых, сводится к теории химической реакционной способности. Исследование этих
Статья про слово "Молекула " в Большой Советской Энциклопедии была прочитана 20212 раз
МОЛЕКУЛ СТРОЕНИЕ (молекулярная структура), взаимное расположение атомов в молекулах. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении расположения атомов в исходных соединениях и характера изменений при образовании из них других соединений.
Первые представления о структуре молекул основывались на анализе химического поведения вещества. Эти представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволяло определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. Этапы развития представлений о строении молекулы метана отражены на рис. 1. Современным данным отвечает структура г : молекула имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах - атомы водорода.
Подобные исследования, однако, ничего не говорили о размерах молекул. Эта информация стала доступна лишь с разработкой соответствующих физических методов. Наиболее важным из них оказалась рентгеновская дифракция. Из картин рассеяния рентгеновских лучей на кристаллах появилась возможность определять точное положение атомов в кристалле, а для молекулярных кристаллов удалось локализовать атомы в отдельной молекуле. Среди других методов можно отметить дифракцию электронов при прохождении их через газы или пары и анализ вращательных спектров молекул.
Вся эта информация дает только общее представление о структуре молекулы. Природу химических связей позволяет исследовать современная квантовая теория. И хотя с достаточно высокой точностью молекулярную структуру рассчитать пока не удается, все известные данные о химических связях можно объяснить. Было даже предсказано существование новых типов химических связей.
Простая ковалентная связь.
Молекула водорода Н 2 состоит из двух идентичных атомов. По данным физических измерений длина связи - расстояние между ядрами атомов водорода (протонами) - составляет 0,70 Å (1 Å = 10 -8 см), что отвечает радиусу атома водорода в основном состоянии, т.е. в состоянии с минимальной энергией. Образование связи между атомами можно объяснить лишь в предположении, что их электроны локализуются в основном между ядрами, образуя облако отрицательно заряженных связывающих частиц и удерживая вместе положительно заряженные протоны.
Рассмотрим два водородных атома в основном состоянии, т.е. состоянии, в котором их электроны находятся на 1s -орбитали. Каждый из этих электронов можно рассматривать как волну, а орбиталь - как стоячую волну. При сближении атомов орбитали начинают перекрываться (рис. 2), и, как в случае обычных волн, возникает интерференция - наложение волн (волновых функций) в области перекрывания. Если знаки волновых функций противоположны, то при интерференции волны уничтожают друг друга (деструктивная интерференция), а если одинаковы, то происходит их сложение (конструктивная интерференция). При сближении атомов водорода возможны два исхода в зависимости от того, находятся ли волновые функции в фазе (рис. 2,а ) или в противофазе (рис. 2,б ). В первом случае произойдет конструктивная интерференция, во втором - деструктивная, при этом появятся две молекулярные орбитали; для одной из них характерна высокая плотность в области между ядрами (рис. 2,в ), для другой - низкая (рис. 2,г ) - фактически узел с нулевой амплитудой, разделяющей ядра.
Таким образом, при сближении атомов водорода и их взаимодействии 1s -орбитали образуют две молекулярные орбитали, а два электрона должны заполнить какую-то одну из них. Электроны в атомах всегда стремятся занять наиболее устойчивое положение - то, в котором их энергия минимальна. Для орбитали, показанной на рис. 2,в , характерна высокая плотность в области между ядрами, и каждый электрон, занявший эту орбиталь, будет бóльшую часть времени находиться вблизи положительно заряженных ядер, т.е. его потенциальная энергия будет мала. Напротив, у орбитали, показанной на рис. 2,г , максимальная плотность имеет место в областях, расположенных слева и справа от ядер, и энергия электронов, находящихся на этой орбитали, будет велика. Итак, электроны обладают меньшей энергией, когда они занимают орбиталь в , причем эта энергия даже меньше той, которая была бы у них при бесконечном удалении атомов друг от друга. Поскольку в данном случае имеются только два электрона, оба они могут занимать более выгодную с энергетической точки зрения орбиталь, если их спины антипараллельны (принцип Паули). Поэтому энергия системы, состоящей из двух атомов водорода, при сближении атомов уменьшается, и чтобы затем удалить атомы друг от друга, потребуется энергия, равная энергии образования стабильной молекулы водорода Н 2 . Заметим, что необходимым условием существования молекулы водорода является преимущественная локализация электронов между ядрами в соответствии с тем, что мы уже говорили выше. Молекулярную орбиталь в называют связывающей, а орбиталь г - разрыхляющей.
МОЛЕКУЛА
МОЛЕКУЛА, наименьшая частица вещества, обладающая его основными химическими свойствами. Состоит из атомов, расположенных в пространстве в определенном порядке и соединенных химическими связями. Состав и расположение атомов отражены в химической формуле. Число атомов в молекуле составляет от 2 (H2, O2, HCl) до многих тысяч (например, белки); размеры молекул варьируют от десятых долей до млн. нанометров. По величине молекулярной массы все вещества условно делят на низко- и высокомолекулярные. Вещество в газообразном состоянии состоит, как правило, из отдельных молекул (кроме благородных газов и паров металлов); в большинстве жидкостей отдельные молекулы соединены друг с другом в ассоциаты. Существуют кристаллы, образованные молекулами (нафталин , кристаллы белков, нуклеиновых кислот). Молекулы одного вещества превращаются в молекулы другого вещества в результате химических реакций.
Современная энциклопедия . 2000 .
Синонимы :Смотреть что такое "МОЛЕКУЛА" в других словарях:
молекула - ы, ж. molecule f. Мельчайшая частица вещества, обладающая всеми его химическим свойствами, способная существовать самостоятельно. БАС 1. Молекюль. Веселитский 26. Молекула и молекюль. Михельсон 1865. Молекюла. Так называется безконечная… … Исторический словарь галлицизмов русского языка
- (новолат. molecule, уменьшит. от лат. moles масса), наименьшая ч ца в ва, обладающая его осн. хим. св вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч … Физическая энциклопедия
МОЛЕКУЛА, мельчайшая частица вещества (например, химического соединения), определяющая химические свойства этого вещества. Молекула может состоять из одного атома, но обычно состоит из двух или более атомов, удерживаемых вместе ХИМИЧЕСКИМИ… … Научно-технический энциклопедический словарь
- (уменьшительная форма от лат. moles – масса) наименьшая частица химического соединения; состоит из системы атомов, с помощью химических средств может распадаться на отдельные атомы. Молекулы благородных газов, гелия и т. д. одноатомны; сложнейшие … Философская энциклопедия
Эксимер, генонема, эписома, хромосома, микрочастица, макромолекула Словарь русских синонимов. молекула сущ., кол во синонимов: 10 биомолекула (1) … Словарь синонимов
- (новолат. molecula уменьшит. от лат. moles масса), микрочастица, образованная из атомов и способная к самостоятельному существованию. Имеет постоянный состав входящих в нее атомных ядер и фиксированное Число электронов и обладает совокупностью… … Большой Энциклопедический словарь
МОЛЕКУЛА, молекулы, жен. (от лат. moles масса) (ест.). Мельчайшая частица вещества, способная существовать самостоятельно и обладающая всеми свойствами данного вещества. Молекулы состоят из атомов. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МОЛЕКУЛА, ы, жен. Мельчайшая частица вещества, обладающая всеми его химическими свойствами. М. состоит из атомов. | прил. молекулярный, ая, ое. Молекулярная масса. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Или частица система или группа атомов … Энциклопедия Брокгауза и Ефрона
- [франц. molecule от лат. moles масса ] наименьшая частица данного вещества, обладающая его основными хим. свойствами, способная к самостоятельному существованию и состоящая из одинаковых или различных атомов, соединенных в одно целое хим. связями … Геологическая энциклопедия
Книги
- Молекула , Джесси Рассел. Эта книга будет изготовлена в соответствии с Вашим заказом по технологии Print-on-Demand. High Quality Content by WIKIPEDIA articles! Моле?кула (новолат. molecula, уменьшительное от лат.…
- Самая главная молекула. От структуры ДНК к биомедицине XXI века , Франк-Каменецкий Максим Д.. Из всего, что нас окружает, самой необъяснимой кажется жизнь. Мы привыкли, что она всегда вокруг нас и в нас самих, и потеряли способность удивляться. Но пойдите в лес, взгляните так, будто…
На листьях черёмухи были водяные капли. Прошло немного времени, и они исчезли: вода испарилась.
В стакан чая бросили кусок сахару. Сахар растворился.
Есть ли что-нибудь общее между испарением воды, растворением сахара и запахом цветов?
В рассказе « » говорится, что все на свете тела состоят из мельчайших частиц- атомов. Но если сказать точнее - не просто из атомов, а из групп атомов. Такие «компании» атомов называют молекулами. Ведь атомы в природе - всё равно что материалы в строительстве. Из немногих видов стройматериалов - кирпичей, досок, брёвен, балок - строят сотни различных домов. А из 92 сортов атомов природа и человек создали сотни тысяч разных веществ: в каждом веществе атомы соединяются в разные группы, образуют разные молекулы.
Когда кусок сахару растворяется, все его молекулы, до той поры соединённые вместе в твёрдый кусок, отделяются друг от друга и перемешиваются с молекулами воды. При испарении воды её молекулы смешиваются с молекулами и , из которых состоит воздух. И точно так же любое пахучее вещество (в том числе и нектар черёмуховых цветов) посылает свои молекулы в воздух. Эти молекулы движутся вместе с молекулами воздуха и попадают в наш нос, вызывая в нём ощущение запаха.
У каждого вещества свои молекулы. Некоторые из них очень просты. Например, молекула кислорода состоит из двух атомов кислорода, а молекула водорода - из двух атомов водорода. Это простые вещества.
Но если смешать водород и кислород и поджечь, как это делал , мы получим воду. При поджигании этой смеси молекулы водорода и кислорода сначала распадутся на атомы, а затем соединятся, образуя молекулы воды. Вода - это уже сложное вещество.
Существуют и очень сложные молекулы. У таких веществ, как , каучук, древесина, у многих молекулы состоят из нескольких сотен и даже тысяч атомов.
Свойства веществ зависят в первую очередь от свойств их молекул. Если молекулы связаны друг с другом слабо, состоящее из них вещество будет газообразным, как например водяной пар. Молекулы в нём движутся быстро и свободно, только случайно сталкиваясь между собой. Если охлаждать водяной пар, молекулы воды будут двигаться медленнее, начнут соединяться одна с другой и пар превратится в жидкость. В жидкости молекулы связаны уже гораздо теснее, но всё-таки они могут ещё двигаться сравнительно свободно. Если же понизить температуру до 0° или ниже, вода замёрзнет и образуется твёрдое кристаллическое вещество - лёд, в котором молекулы воды могут только колебаться, почти не двигаясь с места.
Разнообразны и формы молекул. Молекулы воды похожи на шарики, а молекулы каучука - на длинные нити, так тесно переплетающиеся, что их почти невозможно отделить одну от другой. Потому-то, кстати, каучук так легко растягивается.


