Electronegativitatea este proprietatea unui element chimic de a atrage electroni către atomul său din atomii altor elemente cu care acest element formează o legătură chimică în compuși.
Odată cu formarea unei legături chimice între atomii diferitelor elemente, norul de electroni comun se deplasează către un atom mai electronegativ, datorită căruia legătura devine polară covalent și cu o mare diferență de electronegativități, ionică.
Electronegativitatea este luată în considerare la scrierea formulelor chimice: în compușii binari, simbolul elementului cel mai electronegativ este scris în spate.
Electronegativitatea crește de la stânga la dreapta pentru elementele din fiecare perioadă și scade de sus în jos pentru elementele din același grup PS.
Valenţă elementul este proprietatea atomilor săi de a se combina cu un anumit număr de alți atomi.
Distingeți între valența stoichiometrică, electronică și numărul de coordonare. Vom lua în considerare doar valența stoichiometrică.
Stoichiometric valența arată câți atomi ai unui alt element sunt atașați de un atom al acestui element. Unitatea de valență este luată ca valență de hidrogen, deoarece hidrogenul este întotdeauna monovalent. De exemplu, în compușii HCl, H20, NH3 (ortografia corectă a amoniacului H3N este deja utilizată în manualele moderne), clorul CH4 este monovalent, oxigenul este divalent, azotul este trivalent și carbonul este tetravalent.
Valența stoichiometrică a oxigenului este de obicei 2. Deoarece aproape toate elementele formează compuși cu oxigenul, este convenabil să-l utilizați ca standard pentru a determina valența unui alt element. De exemplu, în compușii Na2O, CoO, Fe2O3, SO3 sodiu este monovalent, cobaltul este divalent, fierul este trivalent, sulful este hexavalent.
În reacțiile redox, va fi important pentru noi să determinăm stările de oxidare ale elementelor.
Starea de oxidare elementul dintr-o substanță se numește valența sa stoichiometrică, luată cu semnul plus sau minus.
Elementele chimice sunt împărțite în elemente valență constantă elemente de valență variabilă.
1.3.3. Substanțe ale structurii moleculare și non-moleculare. Tip rețea de cristal. Dependența proprietăților substanțelor de compoziția și structura acestora.
În funcție de starea compușilor din natură, aceștia sunt împărțiți în moleculari și nemoleculari. ÎN substanțe moleculare Cele mai mici particule structurale sunt moleculele. Aceste substanțe au o rețea de cristal molecular. În substanțele non-moleculare, cele mai mici particule structurale sunt atomii sau ionii. Rețeaua lor cristalină este atomică, ionică sau metalică.
Tipul de rețea cristalină determină în mare măsură proprietățile substanțelor. De exemplu, metalele cu tip metalic de rețea cristalină, diferă de toate celelalte elemente plasticitate ridicată, conductivitate electrică și termică... Aceste proprietăți, precum și multe altele - maleabilitate, luciu metalic etc. datorită unui tip special de legătură între atomii de metal - conexiune metalică. Trebuie remarcat faptul că proprietățile inerente metalelor apar doar în stare condensată. De exemplu, argintul în stare gazoasă nu are proprietățile fizice ale metalelor.
Un tip special de legătură în metale - metalic - se datorează unei deficiențe de electroni de valență, deci sunt comune întregii structuri a metalului. Cel mai simplu model al structurii metalelor presupunea că rețeaua cristalină a metalelor constă din ioni pozitivi înconjurați de electroni liberi, mișcarea electronilor are loc haotic, ca moleculele de gaz. Cu toate acestea, un astfel de model, deși explică calitativ multe proprietăți ale metalelor, se dovedește a fi insuficient în verificarea cantitativă. Dezvoltarea în continuare a teoriei stării metalice a dus la crearea teoria zonelor metalelor, care se bazează pe conceptele de mecanică cuantică.
În nodurile rețelei de cristal există cationi și atomi de metal, iar electronii se mișcă liber de-a lungul rețelei de cristal.
O proprietate mecanică caracteristică a metalelor este plastic, datorită particularităților structurii interne a cristalelor lor. Plasticitatea este înțeleasă ca fiind capacitatea corpurilor aflate sub influența forțelor externe de a suferi deformări, care rămâne chiar și după încetarea influenței externe. Această proprietate a metalelor le permite să fie modelate în diferite forme în timpul forjării, laminate în foi sau trase în sârmă.
Plasticitatea metalelor se datorează faptului că, sub influență externă, straturile de ioni care formează rețeaua cristalină se deplasează una față de cealaltă fără rupere. Acest lucru apare ca urmare a faptului că electronii deplasați, datorită redistribuirii libere, continuă să comunice între straturile ionice. Când acționează mecanic asupra unui solid cu o rețea atomică, straturile sale individuale sunt deplasate și aderența dintre ele este ruptă din cauza rupturii legaturi covalente.
ioni, atunci se formează aceste substanțe tip ionic de rețea cristalină.

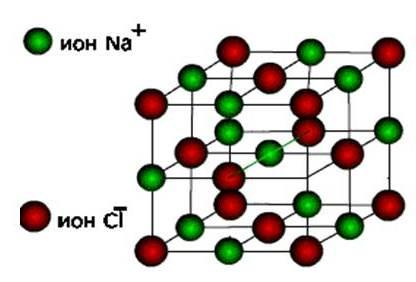
Acestea sunt săruri, precum și oxizi și hidroxizi ai metalelor tipice. Acestea sunt substanțe dure, fragile, dar calitatea lor principală : soluțiile și topiturile acestor compuși conduc curentul electric.
Dacă siturile rețelei de cristal sunt atomi, atunci se formează aceste substanțe tip atomic de rețea cristalină(diamant, bor, oxizi de siliciu din aluminiu și siliciu). Foarte dur și rezistent la proprietăți, insolubil în apă.
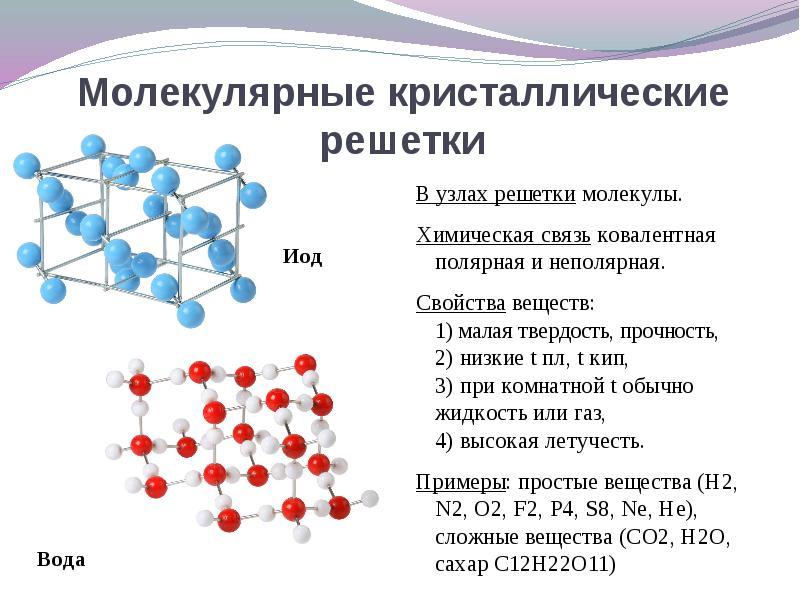
Dacă siturile rețelei de cristal sunt molecule, atunci se formează aceste substanțe (în condiții normale gaze și lichide: О 2, HCl; I 2 materie organică).
Este interesant de observat galiul metalic, care se topește la o temperatură de 30 o C. Această anomalie se explică prin faptul că moleculele de Ga 2 sunt situate în nodurile rețelei cristaline și proprietățile sale în care devin similare substanțelor cu rețea cristalină moleculară.
Exemplu.Toate nemetalele din grup au o structură non-moleculară:
1) carbon, bor, siliciu; 2) fluor, brom, iod;
3) oxigen, sulf, azot; 4) clor, fosfor, seleniu.
În substanțele non-moleculare, cele mai mici particule structurale sunt atomii sau ionii. Rețeaua lor cristalină este atomică, ionică sau metalică
Cand decizie această întrebare este mai ușor de parcurs din contră. Dacă siturile rețelei de cristal sunt molecule, atunci se formează aceste substanțe tip molecular de rețea cristalină(în condiții normale gaze și lichide: O 2, HCI; de asemenea I 2, sulf rombic S 8, fosfor alb P 4, substanțe organice). Conform proprietăților lor, aceștia sunt compuși fragili, cu topire redusă.
În al doilea răspuns există gaz fluor, în al treilea - gaze de oxigen și azot, în al patrulea - gaz clor. Aceasta înseamnă că aceste substanțe au o rețea cristalină moleculară și o structură moleculară.
ÎN primul Răspunsul este că toate substanțele sunt compuși solizi în condiții normale și formează o rețea atomică, ceea ce înseamnă că au o structură non-moleculară.
Răspuns corect:1) carbon, bor, siliciu
- Cel mai puțin electronegativ element chimic
- fier
- magneziu
- calciu
Ar trebui acordată atenție expresiei „cel mai puțin electronegativ”, adică elementului cu cele mai mari proprietăți metalice. Acest argument ne va permite să excludem azotul din posibilele răspunsuri, ca nemetal, și să ne concentrăm asupra calciului ca fiind cel mai activ dintre metalele propuse în sarcină. Răspuns: 4.
- Cea mai polară legătură chimică dintr-una dintre molecule
- CCl 4
- CBr 4
Cunoașterea regularităților schimbărilor electronegativității în perioadele și grupurile din Tabelul periodic al D.I. Răspuns: 2.
- În moleculele de clorură de hidrogen și clor, respectiv legătura chimică
- ionice și polare covalente
- nepolare ionice și covalente
- covalent polar și covalent nepolar
- hidrogen și nepolar covalent
Cuvântul cheie pentru realizarea rapidă și corectă a acestei sarcini este „în consecință”. În variantele propuse, doar unul dintre răspunsuri începe cu cuvintele „polar covalent”, adică o legătură caracteristică clorurii de hidrogen. Răspuns: 3.
- Starea de oxidare a manganului într-un compus a cărui formulă este K2 MnO4 este
Cunoașterea regulilor pentru calcularea stărilor de oxidare a elementelor prin formulă vă va permite să alegeți răspunsul corect. Răspuns: 3.
- Sulful din sare are cea mai scăzută stare de oxidare
- sulfat de potasiu
- sulfit de potasiu
- sulfură de potasiu
- hidrogen sulfat de potasiu
Evident, finalizarea rapidă a acestei sarcini va fi facilitată de traducerea numelor sărurilor în formule. Deoarece sulful este un element al grupei VIA, cea mai scăzută stare de oxidare este -2. Această valoare corespunde unui compus cu formula K 2 S - sulfură de potasiu. Răspuns: 3.
- Starea de oxidare +5 pe care o are atomul de clor în ion
- C1O - 4
- C1O -
- C1O - 3
- C1O - 2
Când efectuați această sarcină, ar trebui să acordați atenție faptului că, în condițiile în care nu sunt dați compuși neutri din punct de vedere electric, ci ioni de clor cu o sarcină negativă unitară ("-"). Deoarece suma stărilor de oxidare a atomilor dintr-un ion este egală cu sarcina ionului, sarcina negativă totală a atomilor de oxigen din ionul dorit ar trebui să aibă o valoare de -6 (+5 - 6 \u003d -1). Răspuns: 3.
- Starea de oxidare -3 azot are în fiecare dintre cei doi compuși
- NF3 ȘI NH3
- NH4CI și N203
- NH4CI și NH3
- HNO2 și NF3
Pentru a determina răspunsul corect, este necesar să împărțiți mental opțiunile de răspuns în subcolonele din stânga și din dreapta. Apoi alegeți-l pe cel în care compușii au o compoziție mai simplă - în cazul nostru, aceasta este subcoloana dreaptă a compușilor binari. Analiza va permite excluderea răspunsurilor 2 și 4, deoarece în oxid și fluor, azotul are o stare de oxidare pozitivă, ca un element mai puțin electronegativ. Acest argument ne permite să excludem răspunsul 1, deoarece prima substanță din acesta este aceeași fluorură de azot. Răspuns: 3.
- La substanțe structura moleculară nu se aplica
- dioxid de carbon
- metan
- clorură de hidrogen
- carbonat de calciu
Ar trebui acordată atenție judecății negative inerente condiției cesiunii. Deoarece substanțele gazoase în condiții normale au o rețea cristalină moleculară în stare solidă, opțiunile 1-3 nu îndeplinesc condiția sarcinii. Alocarea carbonatului de calciu sărurilor va confirma din nou răspunsul corect. Răspuns: 4.
- Sunt următoarele judecăți despre proprietățile substanțelor și structura acestora?
A. Rufele umede se usucă în îngheț, deoarece substanțele cu structură moleculară sunt capabile de sublimare (sublimare).
B. Rufele umede se usucă la rece, deoarece moleculele de apă au o greutate moleculară mică.
- numai A este adevărat
- numai B este adevărat
- ambele judecăți sunt corecte
- ambele judecăți nu sunt corecte
Cunoştinţe proprietăți fizice substanțele de structură moleculară ne permit să decidem că motivul uscării hainelor umede în frig este capacitatea sublimării gheții și nu structura dipolului a moleculelor de apă. Raspunsul 1.
- Fiecare dintre substanțe are o structură moleculară, ale cărei formule sunt date în serie
- CO 2, HNO 3, CaO
- Na2S, Br2, NO2
- H2S04, Cu, O3
- SO2, I2, HCI
Deoarece opțiunile propuse conțin trei substanțe fiecare, este logic să împărțiți mental aceste opțiuni în trei piloni verticali. Analiza fiecăruia dintre ele, începând cu substanțe cu o compoziție mai simplă (stâlpul mijlociu), va elimina răspunsul 3, deoarece conține metal cupru, care are o rețea cristalină metalică. O analiză similară a coloanei din dreapta ne va permite să excludem răspunsul 1, deoarece conține un oxid de metal alcalin pământos (rețea ionică). Din cele două opțiuni rămase, opțiunea 2 trebuie exclusă, deoarece conține o sare de metal alcalin - sulfură de sodiu (rețea ionică). Răspuns: 4.
Sarcini de auto-studiu
- Starea de oxidare +5 azot prezintă în compus, a cărui formulă este
- N 2 O 5
- N204
- N20
- Starea de oxidare a cromului într-un compus a cărui formulă (NH 4) 2 Cr 2 O 7 este
- Starea de oxidare a azotului scade într-un număr de substanțe, ale căror formule
- NH3, NO2, KNO3
- N204, KNO2, NH4CI
- N2, N20, NH3
- HNO 3, HNO 2, NO 2
- Starea de oxidare a clorului crește într-un număr de substanțe, ale căror formule
- НСlO, НСlO 4, КСlO 3
- Сl 2, С1 2 O 7, КСlO 3
- Ca (C1O) 2, KClO3, HClO4
- КСl, КСlO 3, КСlO
- Cea mai polară legătură chimică din moleculă
- amoniac
- sulfat de hidrogen
- bromură de hidrogen
- fluorură de hidrogen
- Substanță cu o legătură nepolară covalentă
- fosfor alb
- fosfura de aluminiu
- clorură de fosfor (V)
- fosfat de calciu
- Formulele pentru substanțe cu numai legături ionice sunt scrise pe rând
- clorură de sodiu, clorură de fosfor (V), fosfat de sodiu
- oxid de sodiu, hidroxid de sodiu, peroxid de sodiu
- disulfură de carbon, carbură de calciu, oxid de calciu
- fluorură de calciu, oxid de calciu, clorură de calciu
- Rețeaua cristalină atomică are
- oxid de sodiu
- oxid de calciu
- oxid de sulf (IV)
- oxid de aluminiu
- Conexiune ionică zăbrele de cristal format prin interacțiunea clorului cu
- fosfor
- bariu
- hidrogen
- gri
- Sunt corecte următoarele judecăți despre clorura de amoniu?
A. Clorura de amoniu este o substanță cu structură ionică, formată datorită legăturilor covalente polare și ionice.
B. Clorura de amoniu este o substanță cu structură ionică și, prin urmare, solidă, refractară și nevolatilă.
- numai A este adevărat
- numai B este adevărat
- ambele judecăți sunt corecte
- ambele judecăți sunt greșite
08. Electronegativitate, stare de oxidare, oxidare și reducere
Să discutăm despre semnificația conceptelor extrem de interesante care există în chimie și, așa cum se întâmplă adesea în știință, destul de confuze și utilizate cu susul în jos. Va fi vorba despre „electronegativitate”, „stare de oxidare” și „reacții redox”.
Ce înseamnă acest lucru - conceptul este folosit pe dos?
Vom încerca să vă povestim treptat.
Electronegativitate ne arată proprietățile redox ale unui element chimic. Adică capacitatea sa de a lua sau de a da fotoni gratis. Și, de asemenea, dacă acest element este o sursă sau absorbant de energie (eter). Yang sau Yin.
Starea de oxidare Este un concept similar cu electronegativitatea. De asemenea, caracterizează proprietățile redox ale elementului. Dar există următoarea diferență între ele.
Electronegativitatea dă caracteristica unui singur element. În sine, în afara de a-l găsi în compoziția oricărui compus chimic. În timp ce starea de oxidare caracterizează capacitatea sa de redox exact atunci când elementul face parte dintr-o moleculă.
Să vorbim puțin despre ce este capacitatea de oxidare și care este capacitatea de restabilire.
Oxidare Este procesul de transfer al fotonilor liberi (electroni) către un alt element. Oxidarea nu este deloc eliminarea electronilor, așa cum se crede acum în știință. ... Când un element oxidează un alt element, acesta acționează ca acidul sau oxigenul (de unde și denumirea de „oxidare”). A oxida înseamnă a promova distrugerea, degradarea, arderea elementelor ... Capacitatea de oxidare este capacitatea de a provoca distrugerea moleculelor de către energia transferată acestora (fotoni liberi). Amintiți-vă că energia distruge întotdeauna materia.
Este uimitor de cât timp au existat contradicții în logică în știință pe care nimeni nu le-a observat.
De exemplu: „Acum știm că un agent oxidant este o substanță care dobândește electroni, iar un agent reducător este o substanță care îi dă” (Enciclopedia unui tânăr chimist, articolul „Reacții redox”)
Și chiar acolo, două paragrafe mai jos: „Cel mai puternic oxidant este curentul electric (fluxul de electroni încărcați negativ)” (ibid.).
Acestea. primul citat spune că oxidantul este cel care acceptă electroni, iar al doilea este oxidantul care renunță.
Și astfel de concluzii eronate, contradictorii te fac să memorezi în școli și institute!
Se știe că cei mai buni agenți de oxidare sunt nemetalele. Mai mult, cu cât numărul perioadei este mai mic și cu cât numărul grupului este mai mare, cu atât proprietățile agentului oxidant sunt mai pronunțate. Acest lucru nu este surprinzător. Am discutat motivele acestui fapt într-un articol dedicat analizei tabelului periodic, în partea a doua, unde am vorbit despre culoarea nucleonilor. De la grupul 1 la 8, culoarea nucleonilor din elemente se schimbă treptat de la violet la roșu (dacă luăm în considerare și culoarea albastră a elementelor d– și f). Combinația de particule galbene și roșii facilitează eliberarea fotonilor liberi acumulați. Galbenii se acumulează, dar se păstrează slab. Iar cele roșii contribuie la impact. Eliberarea fotonilor este procesul de oxidare. Dar când unele sunt roșii, atunci nu există particule capabile să acumuleze fotoni. De aceea elementele grupei 8, gazele nobile, nu sunt agenți de oxidare, spre deosebire de vecinii lor, halogeni.
Recuperare Este procesul opus oxidării. În zilele noastre, în știință, se crede că atunci când un element chimic primește electroni, acesta este redus. Acest punct de vedere este destul de ușor de înțeles (dar nu este acceptat). La studierea structurii elementelor chimice, s-a constatat că acestea emit electroni. Au ajuns la concluzia că electronii fac parte din elemente. Aceasta înseamnă că transferul de electroni către un element este un fel de restaurare a structurii sale pierdute.
Cu toate acestea, în realitate, acest lucru nu este cazul.
Electronii sunt fotoni liberi. Nu sunt nucleoni. Ele nu fac parte din corpul elementului. Ele sunt atrase, venind din exterior, și se acumulează pe suprafața nucleonilor și între ele. Dar acumularea lor nu duce deloc la refacerea structurii unui element sau a unei molecule. Dimpotrivă, acești fotoni de către eterul (energia) emis de aceștia slăbesc și distrug legăturile dintre elemente. Și acesta este un proces de oxidare, dar nu o reducere.
A restabili o moleculă înseamnă, în realitate, a lua energie din ea (în acest caz, fotoni liberi) și nu a o comunica. Prin selectarea fotonilor, elementul reducător condensează substanța - o restabilește.
Cei mai buni agenți reducători sunt metalele. Această proprietate rezultă în mod natural din compoziția lor calitativă și cantitativă - Câmpurile lor de atracție sunt cele mai mari și există întotdeauna multe sau suficiente particule la suprafață de culoare albastră.
Puteți deduce chiar următoarea definiție a metalelor.
Metal Este un element chimic, ale cărui straturi de suprafață trebuie să conțină particule albastre.
A metaloid - Acesta este un element în compoziția straturilor de suprafață ale cărora nu există sau aproape niciun foton albastru și există întotdeauna roșu.
Metalele cu atracția lor puternică îndepărtează perfect electronii. Și așa sunt restauratori.
Să oferim o definiție a conceptelor „electronegativitate”, „stare de oxidare”, „reacții redox”, care pot fi găsite în manualele de chimie.
« Starea de oxidare - sarcina condiționată a unui atom dintr-un compus, calculată pe ipoteza că acesta constă numai din ioni. Când se definește acest concept, se presupune convențional că electronii de legătură (valență) sunt transferați către atomi mai electronegativi și, prin urmare, compușii constau, așa cumva, din ioni încărcați pozitiv și negativ. Starea de oxidare poate fi zero, negativă sau pozitivă, care este de obicei plasată deasupra simbolului elementului din partea de sus.
Valoarea zero a stării de oxidare este atribuită atomilor elementelor care se află într-o stare liberă ... O valoare negativă a stării de oxidare are acei atomi spre care este deplasat norul de electroni care leagă (perechea de electroni). Pentru fluor în toți compușii săi, este -1. Atomii care donează electroni de valență altor atomi au o stare de oxidare pozitivă. De exemplu, pentru metalele alcaline și alcalino-pământoase, este, respectiv, +1 și +2. În ionii simpli, este egal cu sarcina ionului. În majoritatea compușilor, starea de oxidare a atomilor de hidrogen este + 1, dar în hidrurile metalice (compușii lor cu hidrogen) și alții, este -1. Pentru oxigen, starea de oxidare este -2, dar, de exemplu, în combinație cu fluor va fi +2, iar în compușii peroxizi -1. ...
Suma algebrică a stărilor de oxidare a atomilor dintr-un compus este zero, iar într-un ion complex - sarcina ionului. ...
Cea mai ridicată stare de oxidare este cea mai mare valoare pozitivă. Pentru majoritatea elementelor, este egal cu numărul grupului din sistemul periodic și este o caracteristică cantitativă importantă a unui element din compușii săi. Cea mai mică valoare a stării de oxidare a unui element care apare în compușii săi se numește de obicei cea mai scăzută stare de oxidare; toate celelalte sunt intermediare ”(Dicționarul enciclopedic al unui tânăr chimist, articolul„ Starea de oxidare ”).
Iată informațiile de bază referitoare la acest concept. Este strâns legat de un alt termen, electronegativitatea.
« Electronegativitate - aceasta este capacitatea unui atom dintr-o moleculă de a atrage electronii implicați în formarea unei legături chimice ”(Dicționarul enciclopedic al unui tânăr chimist, articolul„ Electronegativitate ”).
„Reacțiile redox sunt însoțite de o schimbare a stării de oxidare a atomilor care alcătuiesc reactanții, ca urmare a mișcării electronilor de la atomul unuia dintre reactivi (agent reducător) la atomul celuilalt. Reacțiile de oxidare-reducere au loc simultan oxidare (eliberare de electroni) și reducere (adăugare de electroni) "(Dicționar enciclopedic chimic, ed. De IL Knunyants, articolul„ Reacții redox ”).
În opinia noastră, există multe greșeli ascunse în aceste trei concepte.
La început , credem că formarea unei legături chimice între două elemente nu este deloc un proces de socializare a electronilor lor. O legătură chimică este o legătură gravitațională. Electronii, care presupun că zboară în jurul nucleului, sunt fotoni liberi care se acumulează pe suprafața nucleonilor din corpul unui element și între ei. Pentru ca o conexiune să apară între două elemente, fotonii lor liberi nu trebuie să se deplaseze între elemente. Acest lucru nu se întâmplă. De fapt, elementul mai greu elimină (atrage) fotonii liberi din cel mai ușor și îi păstrează (mai precis, pe sine). Iar zona elementului mai ușor, din care au fost îndepărtați acești fotoni, devine mai mult sau mai puțin goală. Din cauza faptului că atracția din această zonă se manifestă într-o măsură mai mare. Iar elementul mai ușor este atras de cel mai greu. Așa apare o legătură chimică.
În al doilea rând , chimia modernă vede distorsionată - cu capul în jos - capacitatea elementelor de a atrage electroni spre ele însele. Se crede că cu cât electronegativitatea unui element este mai mare, cu atât este mai capabil să atragă electroni către el însuși. Iar fluorul și oxigenul se presupun că fac cel mai bine - atrag electronii altor persoane. La fel ca și alte elemente din 6 și 7 grupuri.
De fapt, această opinie nu este altceva decât o amăgire. Se bazează pe concepția greșită că cu cât numărul grupului este mai mare, cu atât elementele sunt mai grele. Și, de asemenea, cu atât este mai mare sarcina pozitivă a nucleului. Asta-i prostie. Oamenii de știință încă nu se obosesc nici măcar să explice ceea ce, din punctul lor de vedere, constituie o „acuzație”. Pur și simplu, ca și în numerologie, au numărat toate elementele în ordine și au stabilit valoarea taxei în conformitate cu numărul. Mare drumeție!
De asemenea, este clar pentru un copil că gazul este mai ușor decât metalul dens. Cum se face că în chimie se crede că gazele atrag mai bine electronii către ei înșiși?
Metalele dense, desigur, sunt mai bune la atragerea electronilor.
Oamenii de știință din domeniul chimiei, desigur, pot menține termenul „electronegativitate” în uz, deoarece este atât de comun. Cu toate acestea, vor trebui să-și schimbe semnificația cu exact opusul.
Electronegativitate Este capacitatea unui element chimic dintr-o moleculă de a atrage electroni către sine. Și, în mod natural, metalele au această capacitate mai bine decât nemetalele.
În ceea ce privește poli electrici din moleculă, atunci, într-adevăr, pol negativ - acestea sunt elemente nemetalice care donează electroni, cu Câmpuri de atracție inferioare. A pozitiv - acestea sunt întotdeauna elemente cu proprietăți metalice mai pronunțate, cu câmpuri mari de atracție.
Să zâmbim împreună.
Electronegativitate - aceasta este o altă încercare de a descrie calitatea unui element chimic, împreună cu masa și sarcina deja existente. Așa cum se întâmplă adesea, oamenii de știință dintr-un alt domeniu al științei, în acest caz, chimia, ca și cum nu ar avea încredere în colegii lor fizicieni, ci mai degrabă pur și simplu pentru că orice persoană, făcând descoperiri, merge pe drumul său și nu doar explorează experiența altora.
S-a întâmplat și de data asta.
Masa și încărcătura nu au făcut nimic pentru a ajuta chimiștii să înțeleagă ce se întâmplă în atomi în timp ce aceștia interacționează între ei - și a fost introdusă electronegativitatea - capacitatea unui element de a atrage electronii implicați în formarea unei legături chimice. Trebuie admis că ideea acestui concept este prezentată destul de corect. Cu singurul amendament care reflectă realitatea pe dos. După cum am spus deja, cel mai bine este să atragem electroni către metale și nu nemetale - datorită particularităților culorii nucleonilor de suprafață. Metalele sunt cei mai buni agenți reducători. Nemetalele sunt agenți de oxidare. Se scot metale, se scot nemetale. Metale - Yin, nemetale - Yang.
Esoterismul vine în ajutorul științei în materie de înțelegere a secretelor Naturii.
Cu privire la starea de oxidare , atunci aceasta este o bună încercare de a înțelege modul în care distribuția electronilor liberi are loc într-un compus chimic - o moleculă.
Dacă un compus chimic este omogen - adică este simplu, structura sa constă din elemente de același tip - atunci totul este corect, într-adevăr, starea de oxidare a oricărui element din compus este zero. Deoarece acest compus nu are agenți oxidanți și nici agenți reducători. Și toate elementele sunt de aceeași calitate. Nimeni nu ia electroni, nimeni nu-i dă. Fie că este o substanță densă, fie un lichid, fie un gaz, nu contează.
Starea de oxidare, la fel ca electronegativitatea, demonstrează calitatea unui element chimic - numai în cadrul unui element chimic. Starea de oxidare este concepută pentru a compara calitatea elementelor chimice din compus. În opinia noastră, ideea este bună, dar implementarea ei nu este pe deplin satisfăcătoare.
Suntem categoric împotriva întregii teorii și a conceptului structurii elementelor chimice și a legăturilor dintre ele. Ei bine, doar pentru că numărul grupurilor, conform ideilor noastre, ar trebui să fie mai mare de 8. Aceasta înseamnă că întregul sistem se prăbușește. Și nu numai asta. În general, numărarea electronilor din atomi „pe de o parte” nu este cumva gravă.
În conformitate cu conceptul actual, se dovedește că cele mai mici sarcini convenționale sunt atribuite celor mai puternici oxidanți - fluorul are o sarcină de -1 în toți compușii, oxigenul este -2 aproape peste tot. Și pentru metalele foarte active - alcaline și alcalino-pământoase - aceste sarcini, respectiv, +1 și +2. Nu este deloc logic. Deși, repetăm, înțelegem foarte bine schema generală în conformitate cu care s-a făcut acest lucru - totul de dragul a 8 grupe din tabel și a 8 electroni la nivelul energiei externe.
Cel puțin, valoarea acestor taxe pentru halogeni și oxigen ar fi trebuit să fie cea mai mare cu un semn minus. Și în metalele alcaline și alcalino-pământoase este de asemenea mare, numai cu semnul plus.
În orice component chimic există elemente care donează electroni - oxidanți, nemetale, o sarcină negativă și elemente care donează electroni - reducători, metale, o sarcină pozitivă. În acest fel, se compară elementele, se leagă între ele și se încearcă determinarea stării lor de oxidare.
Cu toate acestea, pentru a afla în acest fel starea de oxidare, în opinia noastră, nu reflectă cu exactitate realitatea. Ar fi mai corect să comparăm electronegativitatea elementelor dintr-o moleculă. La urma urmei, electronegativitatea este aproape aceeași cu starea de oxidare (caracterizează calitatea, doar a unui singur element).
Puteți lua scara electronegativității și puteți pune valorile sale în formula pentru fiecare element. Și atunci va fi imediat vizibil ce elemente renunță la electroni și care dintre ele iau. Elementul a cărui electronegativitate în compus este cea mai mare - polul negativ, donează electroni. Iar cel a cărui electronegativitate este cea mai mică - polul pozitiv, ia electroni.
Dacă există, să zicem, 3 sau 4 elemente într-o moleculă, nimic nu se schimbă. De asemenea, punem valorile electronegativității și comparăm.
Cu toate acestea, nu trebuie să uitați să desenați un model al structurii moleculei. Într-adevăr, în orice compus, dacă nu este simplu, adică nu constă dintr-un singur tip de elemente, metalele și nemetalele sunt conectate între ele, în primul rând. Metalele iau electroni din nemetale și se leagă de ei. Și dintr-un element al unui nemetal, electronii pot fi preluați simultan din 2 sau mai multe elemente cu proprietăți metalice mai pronunțate. Astfel apare o moleculă complexă și complexă. Dar asta nu înseamnă că într-o astfel de moleculă elementele metalice vor intra într-o legătură puternică între ele. Poate că vor fi amplasați unul pe altul. Dacă urmează, vor fi atrași. Dar o legătură puternică se formează numai dacă un element este mai metalic decât celălalt. Este imperativ ca un element să selecteze electronii - îi îndepărtează. În caz contrar, elementul nu va fi expus - eliberarea de fotoni liberi de pe suprafață. Câmpul de atracție nu se va manifesta pe deplin și nu va exista o legătură puternică. aceasta subiect complex - educație legături chimiceși nu vom intra în detalii despre acest lucru în acest articol.
Credem că am tratat în detaliu suficient subiectul dedicat analizei conceptelor de „electronegativitate”, „stare de oxidare”, „oxidare” și „reducere” și v-am furnizat o mulțime de informații interesante.
Din cartea Visele ghidate autor Mir ElenaRestaurare „Când se naște semnul unic al individualizării, esența și viața sunt împărțite în două. De acum înainte, dacă nu se ajunge la pacea finală, esența și viața nu se vor mai vedea niciodată ”. William, „Secretul florii de aur” După facultate
Din cartea Cartea Secretelor. Incredibilul evident pe Pământ și dincolo autor Vyatkin Arkady DmitrievichMasochismul ca grad extrem de vampirism voluntar În acest sens, masochismul este similar cu codependența. Masochisti sunt oameni care primesc senzații plăcute din propria suferință fizică și mentală. Cu alte cuvinte, le place să fie bătute, certate, agresate
Din cartea Vampiri în Rusia. Tot ce trebuie să știți despre ele! autor Bauer AlexanderCum se determină nivelul pierderii de sânge Când un vampir bea sânge, el bea de la o jumătate de litru la un litru și jumătate de sânge odată. Corpul uman conține doar cinci până la șase litri de sânge, astfel încât o astfel de pierdere de sânge nu pune în mod necesar viața în pericol. Cu toate acestea, un vampir poate
Din cartea Modelarea viitorului într-un vis autor Mir ElenaRecuperare După absolvire, lucrând ca inginer într-o întreprindere închisă, mi-am dat seama că nu mă aflu la locul meu, așa că am decis să-mi schimb profesia și am intrat în școala de improvizație jazz, iar mai târziu în departamentul clasic al școlii de muzică.
Din cartea Regulile de aur ale Feng Shui. 10 pași simpli către succes, bunăstare și longevitate autor Ogudin Valentin LeonidovichGradul de influență negativă a obiectelor externe Obiectele externe exercită cea mai mare influență negativă, fiind direct în fața intrării casei. Dar cu cât sunt situate mai mult într-un unghi față de intrare, cu atât influența lor devine mai slabă.
autorul Shure EduardGradul I: Gătit. Predica de pe munte și Împărăția lui Dumnezeu Lucrarea lui Hristos începe cu o idilă galileană și cu anunțul „împărăției lui Dumnezeu”. Această predicție ne indică învățăturile sale populare. În același timp, este o pregătire pentru mai sublim
Din cartea Evoluția divină. De la Sfinx la Hristos autorul Shure EduardAl doilea grad de inițiere (purificare). Vindecări miraculoase. Terapia creștină În toate misterele antice, pregătirea morală și intelectuală a fost urmată de purificarea sufletului, care ar trebui să reînvie organe noi în el și ulterior să-i dea capacitatea
Din cartea Ghicitoarea Marelui Sfinx autor Barbaren GeorgesRestaurarea statuii Epoca reală a Marelui Sfinx datează de la începutul erei adamice. Cel puțin este un contemporan al piramidelor, al cărui ansamblu, după cum vom vedea, a completat cu el însuși. Imaginea Marelui Sfinx a fost expusă în ultimele secole.
Din cartea Vindecarea sufletului. 100 de tehnici de meditație, exerciții de vindecare și relaxare autor Rajneesh Bhagwan ShriRestabilirea ritmului ... Setați aceeași oră pentru a merge la culcare - dacă în fiecare seară sunt unsprezece, apoi unsprezece.Acesta este primul: începeți o anumită oră și în curând corpul va putea intra în acest ritm. Nu vă schimbați de data aceasta, altfel veți confunda corpul. Corp
autorul Kuzmishin E.L.Gradul de ucenic Admiterea la gradul de ucenic Decorarea cutiei și a veșmintelor Pereții și tavanul cutiei trebuie agățate cu pânză albastră și albă fără aurire. Deasupra capului Maestrului Închinător este un triunghi înconjurat de strălucire cu numele înscris în centrul său
Din cartea Cagliostro și francmasoneria egipteană autorul Kuzmishin E.L.Admiterea la Gradul de decorare a ucenicilor din Lojă și veșminte Pereții și tavanul Lojei vor fi atârnate cu pânză albastră și albă fără aurire. Deasupra capului Venerabilului Maestru se află un triunghi înconjurat de strălucire cu numele „Iehova” inscripționat în centrul său, brodat
Din cartea Autobiografia unui yoghin autor Yogananda ParamahansaCapitolul 23 Obțin o diplomă universitară - Ignorați definițiile filozofice ale manualului dvs., bazându-vă, fără îndoială, pe niște „intuiții” discrete care să vă ghideze în cadrul examenelor. Dar dacă nu apelați urgent la o metodă mai științifică, atunci trebuie
Din cartea Cabalei. Lumea superioară. Începutul drumului autor Laitman Michael7.5. Gradul de realizare a răului Așa cum se explică în articolul „Dând Tora”, plăcerea și fericirea sunt determinate de gradul de asemănare cu Creatorul în proprietăți, în timp ce suferința și nerăbdarea sunt determinate de gradul de diferență față de Creator. În consecință, egoismul este dezgustător pentru noi și insuportabil de dureros,
Opțiunea 1
1. Determinați starea de oxidare a atomilor elementelor chimice din următorii compuși: HNO₃, NO₂, H₃N, SO₂, N₂O.
2. Folosind tabelul periodic, aranjați următoarele elemente în ordinea descrescătoare a electronegativității: O, N, Be, B, Li, C. Determinați unde fluorul și sodiul ar trebui să fie localizate în acest rând. Explicați răspunsul. 
3. Cum se schimbă starea de oxidare a unui atom de sulf în timpul oxidării SO₂ în SO₃? Explicați răspunsul.
Opțiunea 2
1. Determinați starea de oxidare a atomilor elementelor chimice din următorii compuși: CO₂, H₃PO₄, SiH₄, P₂O₅, Mg₂Si.
2. În direcția atomilor al căror element chimic general perechi electronice, în moleculele următorilor compuși: BF₃, PCl₃, CS₂, CCl₄, HBr? Dați un răspuns motivat.
3. Se schimbă starea de oxidare a carbonului în timpul formării acid carbonic H₂CO₃ din dioxid de carbon și apă? Explicați răspunsul.
Opțiunea 3
1. Determinați starea de oxidare a atomilor elementelor chimice din următorii compuși: Cl₂, NaClO, CaCl₂, HF, SO₃, Cl₂O₇.
2. Folosind sistem periodic elemente chimice, aranjați următoarele elemente în ordine crescătoare a electronegativității lor: P, Al, Cl, Na, S, Mg. Găsiți un loc în acest rând pentru potasiu și fluor. Explicați răspunsul. 
3. Cum se schimbă starea de oxidare a carbonului la arderea metanului CH мет cu formarea monoxidului de carbon (IV) și a apei? Explicați răspunsul.
Opțiunea 4
1. Determinați starea de oxidare a atomilor elementelor chimice din următorii compuși: H₂SO₄, SO₂, NO₂, BF₃, H₂S.
2. Către atomii a ceea ce elemente chimice perechile comune de electroni sunt deplasate, în moleculele următorilor compuși: H₂O, PCl₃, H₃N, H₂S, CO₂? Dați un răspuns motivat.
3. Se schimbă stările de oxidare ale atomilor când se formează apă substanțe simple - hidrogen și oxigen? Explicați răspunsul.


