Η ηλεκτροπαραγωγικότητα είναι η ιδιότητα ενός χημικού στοιχείου για την προσέλκυση ηλεκτρονίων στο άτομο του από άτομα άλλων στοιχείων με τα οποία αυτό το στοιχείο σχηματίζει χημικό δεσμό σε ενώσεις.
Όταν σχηματίζεται ένας χημικός δεσμός μεταξύ ατόμων διαφορετικών στοιχείων, το κοινό σύννεφο ηλεκτρονίων μετατοπίζεται σε ένα πιο ηλεκτροαρνητικό άτομο, λόγω του οποίου ο δεσμός γίνεται ομοιοπολικά πολικός, και με μεγάλη διαφορά στις ηλεκτροναρτητικότητα, ιοντικό.
Η ηλεκτροπαραγωγικότητα λαμβάνεται υπόψη κατά τη σύνταξη χημικών τύπων: σε δυαδικές ενώσεις, το σύμβολο του πιο ηλεκτροαρνητικού στοιχείου γράφεται στο πίσω μέρος.
Η ηλεκτροπαραγωγικότητα αυξάνεται από αριστερά προς τα δεξιά για στοιχεία κάθε περιόδου και μειώνεται από πάνω προς τα κάτω για στοιχεία της ίδιας ομάδας PS.
Σθένος στοιχείο είναι η ιδιότητα των ατόμων του να συνδυαστεί με έναν ορισμένο αριθμό άλλων ατόμων.
Διακρίνετε μεταξύ στοιχειομετρικού, ηλεκτρονικού σθένους και αριθμού συντονισμού. Θα εξετάσουμε μόνο το στοιχειομετρικό σθένος.
Στοιχειομετρική Το σθένος δείχνει πόσα άτομα ενός άλλου στοιχείου συνδέονται από ένα άτομο αυτού του στοιχείου. Η μονάδα σθένους λαμβάνεται ως σθένος υδρογόνου, από τότε το υδρογόνο είναι πάντα μονοσθενές. Για παράδειγμα, στις ενώσεις HCl, H2O, NH3 (η σωστή ορθογραφία της αμμωνίας Η3Ν χρησιμοποιείται ήδη σε σύγχρονα βιβλία), το CH4 χλώριο είναι μονοσθενές, το οξυγόνο είναι δισθενές, το άζωτο είναι τρισθενές και ο άνθρακας είναι τετρασθενής.
Το στοιχειομετρικό σθένος του οξυγόνου είναι συνήθως 2. Δεδομένου ότι σχεδόν όλα τα στοιχεία σχηματίζουν ενώσεις με οξυγόνο, είναι βολικό να το χρησιμοποιήσετε ως πρότυπο για τον προσδιορισμό του σθένους ενός άλλου στοιχείου. Για παράδειγμα, στις ενώσεις Na2O, CoO, Fe2O3, το νάτριο SO3 είναι μονοσθενές, το κοβάλτιο είναι δισθενές, ο σίδηρος είναι τρισθενής, το θείο είναι εξασθενές.
Στις αντιδράσεις οξειδοαναγωγής, θα είναι σημαντικό για εμάς να προσδιορίσουμε τις καταστάσεις οξείδωσης των στοιχείων.
Κατάσταση οξείδωσης ένα στοιχείο μιας ουσίας ονομάζεται στοιχειομετρικό σθένος της, λαμβανόμενο με ένα σύμβολο συν ή πλην.
Τα χημικά στοιχεία υποδιαιρούνται σε στοιχεία σταθερή σθένος στοιχεία μεταβλητού σθένους.
1.3.3. Ουσίες μοριακής και μη μοριακής δομής. Τύπος πλέγματος κρυστάλλου. Η εξάρτηση των ιδιοτήτων των ουσιών από τη σύνθεση και τη δομή τους.
Ανάλογα με την κατάσταση των ενώσεων στη φύση, χωρίζονται σε μοριακά και μη μοριακά. ΣΕ μοριακές ουσίες Τα μικρότερα δομικά σωματίδια είναι μόρια. Αυτές οι ουσίες έχουν πλέγμα μοριακών κρυστάλλων. Σε μη μοριακές ουσίες, τα μικρότερα δομικά σωματίδια είναι άτομα ή ιόντα. Το κρυσταλλικό πλέγμα τους είναι ατομικό, ιοντικό ή μεταλλικό.
Ο τύπος του κρυσταλλικού πλέγματος καθορίζει σε μεγάλο βαθμό τις ιδιότητες των ουσιών. Για παράδειγμα, μέταλλα με μεταλλικό πλέγμα τύπου κρυστάλλου, διαφέρουν από όλα τα άλλα στοιχεία υψηλή πλαστικότητα, ηλεκτρική και θερμική αγωγιμότητα... Αυτές οι ιδιότητες, καθώς και πολλές άλλες - ελαστικότητα, μεταλλική λάμψη κ.λπ. λόγω ενός ειδικού τύπου δεσμού μεταξύ μεταλλικών ατόμων - μεταλλική σύνδεση. Πρέπει να σημειωθεί ότι οι ιδιότητες που είναι εγγενείς στα μέταλλα εμφανίζονται μόνο στη συμπυκνωμένη κατάσταση. Για παράδειγμα, ο άργυρος σε αέρια κατάσταση δεν έχει τις φυσικές ιδιότητες των μετάλλων.
Ένας ειδικός τύπος δεσμού σε μέταλλα - μεταλλικός - οφείλεται σε έλλειψη ηλεκτρονίων σθένους, επομένως είναι κοινά σε ολόκληρη τη δομή του μετάλλου. Το απλούστερο μοντέλο της δομής των μετάλλων υπέθεσε ότι το κρυσταλλικό πλέγμα των μετάλλων αποτελείται από θετικά ιόντα που περιβάλλονται από ελεύθερα ηλεκτρόνια, η κίνηση των ηλεκτρονίων γίνεται χαοτικά, όπως τα μόρια αερίων. Ωστόσο, ένα τέτοιο μοντέλο, ενώ εξηγεί ποιοτικά πολλές ιδιότητες των μετάλλων, αποδεικνύεται ανεπαρκές στην ποσοτική επαλήθευση. Η περαιτέρω ανάπτυξη της θεωρίας της μεταλλικής κατάστασης οδήγησε στη δημιουργία θεωρία ζώνης μετάλλων, που βασίζεται στις έννοιες της κβαντικής μηχανικής.
Στους κόμβους του κρυσταλλικού πλέγματος υπάρχουν κατιόντα και μεταλλικά άτομα, και τα ηλεκτρόνια κινούνται ελεύθερα κατά μήκος του κρυσταλλικού πλέγματος.
Μια χαρακτηριστική μηχανική ιδιότητα των μετάλλων είναι πλαστική ύλη, λόγω των ιδιαιτεροτήτων της εσωτερικής δομής των κρυστάλλων τους. Η πλαστικότητα θεωρείται ως η ικανότητα των σωμάτων υπό την επίδραση εξωτερικών δυνάμεων να υποστούν παραμόρφωση, η οποία παραμένει ακόμη και μετά τον τερματισμό της εξωτερικής επιρροής. Αυτή η ιδιότητα των μετάλλων τους επιτρέπει να διαμορφώνονται σε διαφορετικά σχήματα κατά τη διάρκεια της σφυρηλάτησης, να τυλίγονται σε φύλλα ή να σύρονται σε σύρμα.
Η πλαστικότητα των μετάλλων οφείλεται στο γεγονός ότι, κάτω από εξωτερική επίδραση, τα στρώματα ιόντων που σχηματίζουν το κρυσταλλικό πλέγμα μετατοπίζονται το ένα στο άλλο χωρίς ρήξη. Αυτό συμβαίνει ως αποτέλεσμα του γεγονότος ότι τα εκτοπισμένα ηλεκτρόνια, λόγω της ελεύθερης αναδιανομής, συνεχίζουν να επικοινωνούν μεταξύ των ιοντικών στρωμάτων. Υπό μηχανική δράση σε ένα στερεό με ατομικό πλέγμα, μεμονωμένα στρώματα μετατοπίζονται και η πρόσφυση μεταξύ τους σπάει λόγω ρήξης ομοιοπολικούς δεσμούς.
ιόντα, τότε αυτές οι ουσίες σχηματίζονται ιοντικός τύπος κρυσταλλικού πλέγματος.

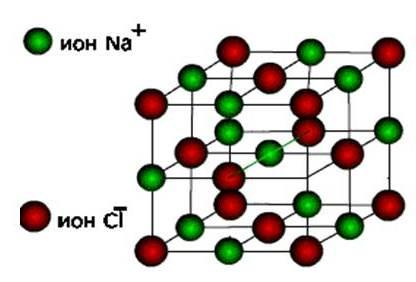
Αυτά είναι άλατα, καθώς και οξείδια και υδροξείδια τυπικών μετάλλων. Αυτές είναι σκληρές, εύθραυστες ουσίες, αλλά η κύρια ποιότητά τους : διαλύματα και τήγματα αυτών των ενώσεων μεταφέρουν ηλεκτρικό ρεύμα.
Εάν οι τοποθεσίες του κρυσταλλικού πλέγματος είναι άτομα, τότε αυτές οι ουσίες σχηματίζονται ατομικός τύπος κρυσταλλικού πλέγματος(διαμάντι, βόριο, οξείδια πυριτίου από αλουμίνιο και πυρίτιο). Πολύ σκληρό και πυρίμαχο σε ιδιότητες, αδιάλυτο στο νερό.
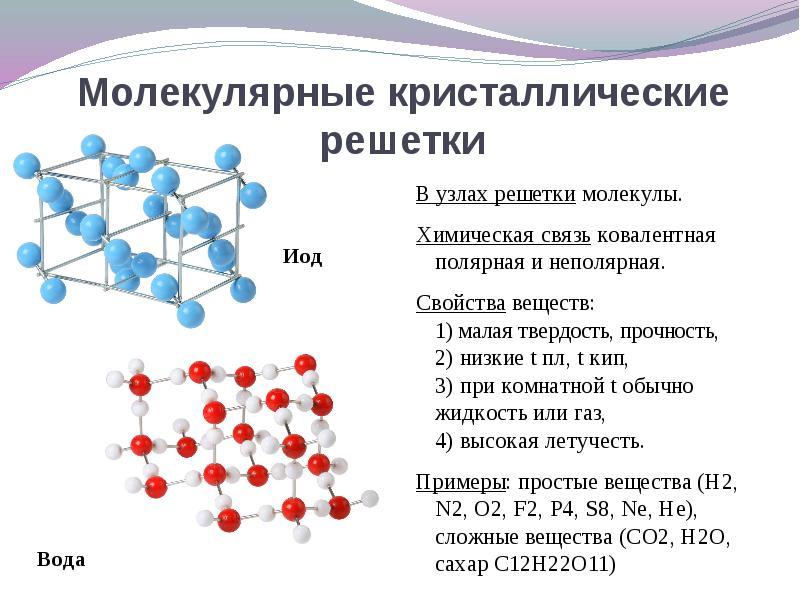
Εάν οι τοποθεσίες του κρυσταλλικού πλέγματος είναι μόρια, τότε αυτές οι ουσίες σχηματίζονται (υπό κανονικές συνθήκες αέρια και υγρά: О 2, HCl, I 2 οργανική ύλη).
Είναι ενδιαφέρον να σημειωθεί το μεταλλικό γάλλιο, το οποίο λιώνει σε θερμοκρασία 30 o C. Αυτή η ανωμαλία εξηγείται από το γεγονός ότι τα μόρια Ga2 βρίσκονται στους κόμβους του κρυσταλλικού πλέγματος, και οι ιδιότητές του στις οποίες γίνονται παρόμοιες με ουσίες με πλέγμα μοριακών κρυστάλλων.
Παράδειγμα.Όλα τα μη μέταλλα της ομάδας έχουν μη μοριακή δομή:
1) άνθρακας, βόριο, πυρίτιο. 2) φθόριο, βρώμιο, ιώδιο
3) οξυγόνο, θείο, άζωτο 4) χλώριο, φώσφορο, σελήνιο.
Σε μη μοριακές ουσίες, τα μικρότερα δομικά σωματίδια είναι άτομα ή ιόντα. Το κρυσταλλικό πλέγμα τους είναι ατομικό, ιοντικό ή μεταλλικό
Πότε απόφαση αυτή η ερώτηση είναι πιο εύκολο να πάει από το αντίθετο. Εάν οι τοποθεσίες του κρυσταλλικού πλέγματος είναι μόρια, τότε αυτές οι ουσίες σχηματίζονται μοριακός τύπος κρυσταλλικού πλέγματος(υπό κανονικές συνθήκες αέρια και υγρά: O2, HCl, επίσης I 2, ρομβικό θείο S 8, λευκός φωσφόρος P4, οργανικές ουσίες). Σύμφωνα με τις ιδιότητές τους, αυτές είναι εύθραυστες ενώσεις χαμηλής τήξης.
Στη δεύτερη απάντηση υπάρχει αέριο φθόριο, στο τρίτο - αέρια οξυγόνου και αζώτου, στο τέταρτο - αέριο χλώριο. Αυτό σημαίνει ότι αυτές οι ουσίες έχουν πλέγμα μοριακών κρυστάλλων και μοριακή δομή.
ΣΕ πρώτα Η απάντηση είναι ότι όλες οι ουσίες είναι στερεές ενώσεις υπό κανονικές συνθήκες και σχηματίζουν ατομικό πλέγμα, πράγμα που σημαίνει ότι έχουν μη μοριακή δομή.
Σωστή απάντηση:1) άνθρακας, βόριο, πυρίτιο
- Το λιγότερο ηλεκτροαρνητικό χημικό στοιχείο είναι
- σίδερο
- μαγνήσιο
- ασβέστιο
Πρέπει να δοθεί προσοχή στη φράση "λιγότερο ηλεκτροαρνητική", δηλαδή το στοιχείο με τις μεγαλύτερες μεταλλικές ιδιότητες. Αυτό το επιχείρημα θα μας επιτρέψει να αποκλείσουμε το άζωτο από τις πιθανές απαντήσεις, ως μη μέταλλο, και να επικεντρωθούμε στο ασβέστιο ως τα πιο δραστικά από τα μέταλλα που προτείνονται στην εργασία. Απάντηση: 4.
- Ο πιο πολικός χημικός δεσμός σε ένα από τα μόρια
- CCl 4
- CBr 4
Γνώση των κανονικοτήτων των αλλαγών στην ηλεκτροαρνητικότητα στις περιόδους και τις ομάδες του Περιοδικού Πίνακα του D.I. Απάντηση: 2.
- Στα μόρια του υδροχλωρίου και του χλωρίου, ο χημικός δεσμός, αντίστοιχα
- ιοντικό και ομοιοπολικό πολικό
- ιοντικό και ομοιοπολικό μη πολικό
- ομοιοπολικό πολικό και ομοιοπολικό μη πολικό
- υδρογόνο και ομοιοπολικό μη πολικό
Η λέξη κλειδί για την γρήγορη και σωστή ολοκλήρωση αυτής της εργασίας είναι "αναλόγως." Στις προτεινόμενες παραλλαγές, μόνο μία από τις απαντήσεις ξεκινά με τις λέξεις "ομοιοπολικό πολικό", δηλαδή, ένα χαρακτηριστικό δεσμού του υδροχλωρίου. Απάντηση: 3.
- Η κατάσταση οξείδωσης του μαγγανίου σε μια ένωση της οποίας ο τύπος είναι K2 MnO4 είναι
Η γνώση των κανόνων για τον υπολογισμό των καταστάσεων οξείδωσης των στοιχείων με τον τύπο θα σας επιτρέψει να επιλέξετε τη σωστή απάντηση. Απάντηση: 3.
- Το θείο στο αλάτι έχει τη χαμηλότερη κατάσταση οξείδωσης
- θειικό κάλιο
- θειώδες κάλιο
- θειούχο κάλιο
- όξινο θειικό κάλιο
Προφανώς, η γρήγορη ολοκλήρωση αυτής της εργασίας θα διευκολυνθεί με τη μετάφραση των ονομάτων των αλάτων σε τύπους. Δεδομένου ότι το θείο είναι ένα στοιχείο της ομάδας VIA, η χαμηλότερη κατάσταση οξείδωσης είναι -2. Αυτή η τιμή αντιστοιχεί σε μια ένωση με τον τύπο K2S - θειούχο κάλιο. Απάντηση: 3.
- Η κατάσταση οξείδωσης +5 του ατόμου χλωρίου στο ιόν
- C1O - 4
- Γ1Ο -
- C1O - 3
- C1O - 2
Κατά την εκτέλεση αυτής της εργασίας, θα πρέπει να προσέχετε το γεγονός ότι η κατάσταση δεν δίνει ηλεκτρικά ουδέτερες ενώσεις, αλλά ιόντα χλωρίου με αρνητικό φορτίο μονάδας ("-"). Δεδομένου ότι το άθροισμα των καταστάσεων οξείδωσης των ατόμων στο ιόν είναι ίσο με το φορτίο του ιόντος, το συνολικό αρνητικό φορτίο των ατόμων οξυγόνου στο επιθυμητό ιόν πρέπει να είναι -6 (+5 - 6 \u003d -1). Απάντηση: 3.
- Η κατάσταση οξείδωσης -3 άζωτο έχει σε καθεμία από τις δύο ενώσεις
- NF 3 ΚΑΙ NH 3
- NH4Cl και N 2 O 3
- NH4Cl και NH3
- HNO 2 και NF 3
Για να προσδιορίσετε τη σωστή απάντηση, πρέπει να διαιρέσετε διανοητικά τις επιλογές απάντησης σε αριστερή και δεξιά υπο-στήλη. Στη συνέχεια, επιλέξτε εκείνη στην οποία οι ενώσεις έχουν μια απλούστερη σύνθεση - στην περίπτωσή μας, αυτή είναι η σωστή υπο-στήλη των δυαδικών ενώσεων. Η ανάλυση θα μας επιτρέψει να αποκλείσουμε τις απαντήσεις 2 και 4, καθώς στο άζωτο οξειδίου και φθορίου έχει θετική κατάσταση οξείδωσης, όπως ένα λιγότερο ηλεκτροαρνητικό στοιχείο. Αυτό το επιχείρημα μας επιτρέπει να αποκλείσουμε την απάντηση 1, καθώς η πρώτη ουσία σε αυτό είναι το ίδιο φθοριούχο άζωτο. Απάντηση: 3.
- Σε ουσίες μοριακή δομή δεν ισχύουν
- διοξείδιο του άνθρακα
- μεθάνιο
- υδροχλωρίδιο
- ανθρακικό ασβέστιο
Πρέπει να δοθεί προσοχή στην αρνητική κρίση που είναι εγγενής στην κατάσταση της ανάθεσης. Επειδή οι αέριες ουσίες υπό κανονικές συνθήκες έχουν δικτυωτό πλέγμα μοριακών κρυστάλλων σε στερεά κατάσταση, οι επιλογές 1-3 δεν πληρούν την κατάσταση εργασίας. Η εκχώρηση ανθρακικού ασβεστίου στα άλατα επιβεβαιώνει και πάλι τη σωστή απάντηση. Απάντηση: 4.
- Είναι σωστές οι ακόλουθες κρίσεις σχετικά με τις ιδιότητες των ουσιών και τη δομή τους;
Α. Τα υγρά πλυντήρια στεγνώνουν στον παγετό επειδή ουσίες μοριακής δομής είναι ικανές εξάχνωσης (εξάχνωση).
Β. Τα υγρά πλυντήρια στεγνώνουν στο κρύο επειδή τα μόρια του νερού έχουν χαμηλό μοριακό βάρος.
- μόνο το Α είναι αλήθεια
- μόνο το Β είναι αλήθεια
- και οι δύο κρίσεις είναι σωστές
- και οι δύο κρίσεις δεν είναι σωστές
Η γνώση φυσικές ιδιότητες ουσίες μοριακής δομής μας επιτρέπουν να αποφασίσουμε ότι ο λόγος για το στέγνωμα των βρεγμένων ρούχων στο κρύο είναι η ικανότητα του πάγου να εξαχνωθεί και όχι η διπολική δομή των μορίων του νερού. Απάντηση: 1.
- Κάθε μία από τις ουσίες έχει μοριακή δομή, οι τύποι των οποίων δίνονται στη σειρά
- CO 2, HNO 3, CaO
- Na 2 S, Br 2, NO 2
- H 2 SO 4, Cu, O 3
- SO 2, I 2, HCl
Δεδομένου ότι οι προτεινόμενες επιλογές περιέχουν τρεις ουσίες η καθεμία, είναι λογικό να διαιρούνται διανοητικά αυτές οι επιλογές σε τρεις κάθετους πυλώνες. Η ανάλυση καθενός από αυτά, ξεκινώντας με ουσίες με απλούστερη σύνθεση (μεσαίος πυλώνας), θα μας επιτρέψει να αποκλείσουμε την απάντηση 3, καθώς περιέχει χαλκό μέταλλο, το οποίο έχει μεταλλικό κρυσταλλικό πλέγμα. Μια παρόμοια ανάλυση της σωστής υπο-στήλης θα μας επιτρέψει να αποκλείσουμε την απάντηση 1, καθώς περιέχει ένα οξείδιο μετάλλου αλκαλικής γαίας (ιοντικό πλέγμα). Από τις δύο υπόλοιπες επιλογές, η επιλογή 2 πρέπει να αποκλειστεί, καθώς περιέχει ένα άλας αλκαλιμετάλλου - θειούχο νάτριο (ιοντικό πλέγμα). Απάντηση: 4.
Εργασίες αυτο-μελέτης
- Η κατάσταση οξείδωσης +5 άζωτο δείχνει στην ένωση, ο τύπος της οποίας είναι
- Ν 2 Ο 5
- Ν 2 Ο 4
- Ν 2 Ο
- Η κατάσταση οξείδωσης του χρωμίου σε μια ένωση της οποίας ο τύπος (NH4) 2Cr2O7 είναι
- Η κατάσταση οξείδωσης του αζώτου μειώνεται σε μια σειρά ουσιών, οι τύποι των οποίων
- NH 3, NO 2, KNO 3
- Ν2Ο4, ΚΝΟ2, ΝΗ4ΟΙ
- Ν2, Ν2Ο, ΝΗ 3
- HNO 3, HNO 2, NO 2
- Η κατάσταση οξείδωσης του χλωρίου αυξάνεται σε έναν αριθμό ουσιών, οι τύποι των οποίων
- НСlO, OlO 4, КСlO 3
- 2l 2, С1 2 O 7, КСlO 3
- Ca (C1O) 2, KClO 3, HClO 4
- КСl, КСlO 3, КСlO
- Ο πιο πολικός χημικός δεσμός στο μόριο
- αμμωνία
- υδρόθειο
- υδροβρωμίδιο
- υδροφθόριο
- Ουσία με έναν ομοιοπολικό μη πολικό δεσμό
- λευκό φωσφόρο
- φωσφίδιο αργιλίου
- χλωριούχος φωσφόρος (V)
- φωσφορικό ασβέστιο
- Οι τύποι για ουσίες με μόνο ιονικούς δεσμούς γράφονται στη σειρά
- χλωριούχο νάτριο, χλωριούχο φωσφόρο (V), φωσφορικό νάτριο
- οξείδιο του νατρίου, υδροξείδιο του νατρίου, υπεροξείδιο του νατρίου
- δισουλφίδιο του άνθρακα, καρβίδιο του ασβεστίου, οξείδιο του ασβεστίου
- φθοριούχο ασβέστιο, οξείδιο ασβεστίου, χλωριούχο ασβέστιο
- Το πλέγμα ατομικών κρυστάλλων έχει
- οξείδιο του νατρίου
- οξείδιο του ασβεστίου
- οξείδιο του θείου (IV)
- οξείδιο αργιλίου
- Ιωνική σύνδεση κρυσταλλικού πλέγματος σχηματίζεται από την αλληλεπίδραση του χλωρίου με
- φώσφορος
- βάριο
- υδρογόνο
- γκρί
- Είναι σωστές οι ακόλουθες κρίσεις σχετικά με το χλωριούχο αμμώνιο;
A. Χλωριούχο αμμώνιο - μια ουσία ιοντικής δομής, που σχηματίζεται λόγω ομοιοπολικών πολικών και ιοντικών δεσμών.
Β. Το χλωριούχο αμμώνιο είναι μια ουσία ιοντικής δομής και συνεπώς στερεό, πυρίμαχο και μη πτητικό.
- μόνο το Α είναι αλήθεια
- μόνο το Β είναι αλήθεια
- και οι δύο κρίσεις είναι σωστές
- και οι δύο κρίσεις είναι λανθασμένες
08. Ηλεκτροπαραγωγικότητα, κατάσταση οξείδωσης, οξείδωση και μείωση
Ας συζητήσουμε την έννοια των εξαιρετικά ενδιαφέρων εννοιών που υπάρχουν στη χημεία και, όπως συμβαίνει συχνά στην επιστήμη, είναι αρκετά συγκεχυμένη και χρησιμοποιείται ανάποδα. Θα αφορά την «ηλεκτροαναρτητικότητα», την «κατάσταση οξείδωσης» και τις «αντιδράσεις οξειδοαναγωγής».
Τι σημαίνει αυτό - η ιδέα χρησιμοποιείται ανάποδα;
Θα προσπαθήσουμε να σας ενημερώσουμε σταδιακά.
Ηλεκτροπαραγωγικότητα μας δείχνει τις ιδιότητες οξειδοαναγωγής ενός χημικού στοιχείου. Δηλαδή, η ικανότητά του να παίρνει ή να δίνει δωρεάν φωτόνια. Και επίσης εάν αυτό το στοιχείο είναι πηγή ή απορροφητής ενέργειας (αιθέρας). Γιανγκ ή Γιν.
Κατάσταση οξείδωσης Είναι μια ιδέα παρόμοια με την ηλεκτροπαραγωγικότητα. Χαρακτηρίζει επίσης τις ιδιότητες οξειδοαναγωγής του στοιχείου. Υπάρχει όμως η ακόλουθη διαφορά μεταξύ τους.
Η ηλεκτροπαραγωγικότητα δίνει το χαρακτηριστικό ενός μεμονωμένου στοιχείου. Από μόνη της, έξω από το να το βρείτε στη σύνθεση οποιασδήποτε χημικής ένωσης. Ενώ η κατάσταση οξείδωσης χαρακτηρίζει την ικανότητα οξειδοαναγωγής της ακριβώς όταν το στοιχείο είναι μέρος ενός μορίου.
Ας μιλήσουμε λίγο για το ποια είναι η ικανότητα οξειδώσεως και ποια είναι η ικανότητα αποκατάστασης.
Οξείδωση Είναι η διαδικασία μεταφοράς ελεύθερων φωτονίων (ηλεκτρονίων) σε άλλο στοιχείο. Η οξείδωση δεν είναι καθόλου η απομάκρυνση των ηλεκτρονίων, όπως πιστεύεται τώρα στην επιστήμη ... Όταν ένα στοιχείο οξειδώνει ένα άλλο στοιχείο, ενεργεί όπως οξύ ή οξυγόνο (εξ ου και το όνομα "οξείδωση"). Η οξείδωση σημαίνει συμβολή στην καταστροφή, αποσύνθεση, καύση στοιχείων ... Η ικανότητα οξείδωσης είναι η ικανότητα να προκαλεί την καταστροφή των μορίων από την ενέργεια που μεταφέρεται σε αυτά (ελεύθερα φωτόνια). Να θυμάστε ότι η ενέργεια καταστρέφει πάντα την ύλη.
Είναι εκπληκτικό πόσο καιρό υπήρξαν αντιφάσεις στη λογική της επιστήμης που κανείς δεν πρόσεξε.
Για παράδειγμα: «Τώρα γνωρίζουμε ότι οξειδωτικός παράγοντας είναι μια ουσία που αποκτά ηλεκτρόνια, και ένας αναγωγικός παράγοντας είναι μια ουσία που τους δίνει μακριά» (Εγκυκλοπαίδεια ενός νεαρού χημικού, άρθρο «Αντιδράσεις Redox)».
Και εκεί, δύο παράγραφοι παρακάτω: "Ο ισχυρότερος οξειδωτής είναι το ηλεκτρικό ρεύμα (ροή αρνητικά φορτισμένων ηλεκτρονίων)" (ibid.).
Εκείνοι. το πρώτο απόσπασμα λέει ότι το οξειδωτικό είναι αυτό που δέχεται ηλεκτρόνια, και το δεύτερο είναι το οξειδωτικό που εγκαταλείπει.
Και τέτοια λανθασμένα, αντιφατικά συμπεράσματα σε κάνουν να απομνημονεύεις σε σχολεία και ινστιτούτα!
Είναι γνωστό ότι οι καλύτεροι οξειδωτικοί παράγοντες είναι μη μέταλλα. Επιπλέον, όσο μικρότερος είναι ο αριθμός περιόδου και όσο μεγαλύτερος είναι ο αριθμός ομάδας, τόσο πιο έντονες είναι οι ιδιότητες του οξειδωτικού παράγοντα. Αυτό δεν προκαλεί έκπληξη. Συζητήσαμε τους λόγους για αυτό σε ένα άρθρο αφιερωμένο στην ανάλυση του περιοδικού πίνακα, στο δεύτερο μέρος, όπου μιλήσαμε για το χρώμα των νουκλεονίων. Από την ομάδα 1 έως 8, το χρώμα των νουκλεονίων στα στοιχεία αλλάζει σταδιακά από βιολετί σε κόκκινο (αν λάβουμε επίσης υπόψη το μπλε χρώμα των στοιχείων d- και f). Ο συνδυασμός κίτρινων και κόκκινων σωματιδίων διευκολύνει την απελευθέρωση συσσωρευμένων ελεύθερων φωτονίων. Τα κίτρινα συσσωρεύονται, αλλά διατηρούν ασθενώς. Και τα κόκκινα συμβάλλουν στον αντίκτυπο. Το να εκπέμπει φωτόνια είναι η διαδικασία οξείδωσης. Αλλά όταν μερικά είναι κόκκινα, τότε δεν υπάρχουν σωματίδια ικανά να συσσωρεύουν φωτόνια. Γι 'αυτό τα στοιχεία της ομάδας 8, ευγενή αέρια, δεν είναι οξειδωτικοί παράγοντες, σε αντίθεση με τους γείτονές τους, αλογόνα.
Ανάκτηση Είναι η αντίθετη διαδικασία στην οξείδωση. Σήμερα, στην επιστήμη, πιστεύεται ότι όταν ένα χημικό στοιχείο δέχεται ηλεκτρόνια, μειώνεται. Αυτή η άποψη είναι αρκετά κατανοητή (αλλά δεν γίνεται αποδεκτή). Κατά τη μελέτη της δομής των χημικών στοιχείων, διαπιστώθηκε ότι εκπέμπουν ηλεκτρόνια. Κατέληξαν στο συμπέρασμα ότι τα ηλεκτρόνια είναι μέρος των στοιχείων. Αυτό σημαίνει ότι η μεταφορά ηλεκτρονίων σε ένα στοιχείο είναι ένα είδος αποκατάστασης της χαμένης δομής του.
Ωστόσο, στην πραγματικότητα, αυτό δεν ισχύει.
Τα ηλεκτρόνια είναι δωρεάν φωτόνια. Δεν είναι νουκλεόνια. Δεν αποτελούν μέρος του σώματος του στοιχείου. Προσελκύονται, προέρχονται από έξω, και συσσωρεύονται στην επιφάνεια των νουκλεονίων και μεταξύ τους. Αλλά η συσσώρευσή τους δεν οδηγεί καθόλου στην αποκατάσταση της δομής ενός στοιχείου ή ενός μορίου. Αντιθέτως, αυτά τα φωτόνια που εκπέμπονται από τον αιθέρα τους (ενέργεια), αποδυναμώνουν και καταστρέφουν τους δεσμούς μεταξύ των στοιχείων. Και αυτή είναι μια διαδικασία οξείδωσης, αλλά όχι μείωση.
Η αποκατάσταση ενός μορίου, στην πραγματικότητα, είναι η λήψη ενέργειας από αυτό (στην περίπτωση αυτή, δωρεάν φωτόνια) και όχι η επικοινωνία. Λαμβάνοντας φωτόνια, το αναγωγικό στοιχείο συμπυκνώνει την ουσία - την αποκαθιστά.
Οι καλύτεροι αναγωγικοί παράγοντες είναι μέταλλα. Αυτό το ακίνητο προκύπτει φυσικά από την ποιοτική και ποσοτική τους σύνθεση - τα πεδία έλξης είναι τα μεγαλύτερα και υπάρχουν πάντα πολλά ή αρκετά σωματίδια στην επιφάνεια μπλε χρώματος.
Μπορείτε ακόμη να συμπεράνετε τον ακόλουθο ορισμό των μετάλλων.
Μέταλλο Είναι ένα χημικό στοιχείο, τα επιφανειακά στρώματα των οποίων πρέπει να περιέχουν μπλε σωματίδια.
ΚΑΙ μη μέταλλο - Αυτό είναι ένα στοιχείο, στη σύνθεση των επιφανειακών στρωμάτων των οποίων δεν υπάρχουν ή σχεδόν καθόλου μπλε φωτόνια, και υπάρχουν πάντα κόκκινα.
Μέταλλα με την ισχυρή τους έλξη αφαιρούν τέλεια τα ηλεκτρόνια. Και έτσι είναι αποκαταστάτες.
Ας δώσουμε έναν ορισμό των εννοιών «ηλεκτροαρατηρητικότητα», «κατάσταση οξείδωσης», «αντιδράσεις οξειδοαναγωγής», που μπορούν να βρεθούν σε εγχειρίδια χημείας.
« Κατάσταση οξείδωσης - το υπό όρους φορτίο ενός ατόμου σε μια ένωση, υπολογιζόμενο με την υπόθεση ότι αποτελείται μόνο από ιόντα. Κατά τον ορισμό αυτής της έννοιας, συμβατικά θεωρείται ότι τα ηλεκτρόνια σύνδεσης (σθένους) μεταφέρονται σε περισσότερα ηλεκτροαρνητικά άτομα, και συνεπώς οι ενώσεις αποτελούνται, όπως ήταν, από θετικά και αρνητικά φορτισμένα ιόντα. Η κατάσταση οξείδωσης μπορεί να είναι μηδέν, αρνητική ή θετική, η οποία συνήθως τοποθετείται πάνω από το σύμβολο στοιχείου στην κορυφή.
Η μηδενική τιμή της κατάστασης οξείδωσης αποδίδεται στα άτομα των στοιχείων που βρίσκονται σε ελεύθερη κατάσταση ... Μια αρνητική τιμή της κατάστασης οξείδωσης έχει εκείνα τα άτομα προς τα οποία μετατοπίζεται το σύννεφο ηλεκτρονίων σύνδεσης (ζεύγος ηλεκτρονίων). Για το φθόριο σε όλες τις ενώσεις του, είναι -1. Τα άτομα που δίνουν ηλεκτρόνια σθένους σε άλλα άτομα έχουν θετική κατάσταση οξείδωσης. Για παράδειγμα, για τα μέταλλα αλκαλίων και αλκαλικών γαιών, είναι, αντίστοιχα, +1 και +2. Σε απλά ιόντα, είναι ίσο με το φορτίο του ιόντος. Στις περισσότερες ενώσεις, η κατάσταση οξείδωσης των ατόμων υδρογόνου είναι + 1, αλλά στα μεταλλικά υδρίδια (οι ενώσεις τους με υδρογόνο) και άλλες, είναι –1. Για το οξυγόνο, η κατάσταση οξείδωσης είναι -2, αλλά, για παράδειγμα, σε συνδυασμό με φθόριο θα είναι +2, και σε ενώσεις υπεροξειδίου -1. ...
Το αλγεβρικό άθροισμα των καταστάσεων οξείδωσης των ατόμων σε μια ένωση είναι μηδέν και σε ένα σύμπλοκο ιόν, το φορτίο του ιόντος. ...
Η υψηλότερη κατάσταση οξείδωσης είναι η υψηλότερη θετική τιμή της. Για τα περισσότερα στοιχεία, είναι ίσος με τον αριθμό ομάδας στο περιοδικό σύστημα και είναι ένα σημαντικό ποσοτικό χαρακτηριστικό ενός στοιχείου στις ενώσεις του. Η μικρότερη τιμή της κατάστασης οξείδωσης ενός στοιχείου που εμφανίζεται στις ενώσεις του ονομάζεται συνήθως η χαμηλότερη κατάσταση οξείδωσης. όλα τα υπόλοιπα είναι ενδιάμεσα "(Εγκυκλοπαιδικό Λεξικό Νέου Χημικού, άρθρο" Οξείδωση ").
Εδώ είναι οι βασικές πληροφορίες σχετικά με αυτήν την ιδέα. Συνδέεται στενά με έναν άλλο όρο, την ηλεκτροαρνητικότητα.
« Ηλεκτροπαραγωγικότητα - αυτή είναι η ικανότητα ενός ατόμου σε ένα μόριο να προσελκύσει ηλεκτρόνια που εμπλέκονται στο σχηματισμό ενός χημικού δεσμού "(Encyclopedic Dictionary of a Young Chemist, άρθρο" Electronegativity ").
«Οι αντιδράσεις Redox συνοδεύονται από μια αλλαγή στην κατάσταση οξείδωσης των ατόμων που απαρτίζουν τα αντιδραστήρια, ως αποτέλεσμα της μετακίνησης ηλεκτρονίων από το άτομο ενός από τα αντιδραστήρια (αναγωγικός παράγοντας) στο άτομο του άλλου. Οι αντιδράσεις μείωσης της οξείδωσης συμβαίνουν ταυτόχρονα οξείδωση (απελευθέρωση ηλεκτρονίων) και μείωση (προσθήκη ηλεκτρονίων) "(Chemical Encyclopedic Dictionary, ed. Από IL Knunyants, άρθρο" Αντιδράσεις Redox ").
Κατά τη γνώμη μας, υπάρχουν πολλά λάθη κρυμμένα σε αυτές τις τρεις έννοιες.
Πρωτα απο ολα Πιστεύουμε ότι ο σχηματισμός ενός χημικού δεσμού μεταξύ δύο στοιχείων δεν είναι καθόλου διαδικασία κοινωνικοποίησης των ηλεκτρονίων τους. Ένας χημικός δεσμός είναι ένας βαρυτικός δεσμός. Τα ηλεκτρόνια, που υποτίθεται ότι πετούν γύρω από τον πυρήνα, είναι ελεύθερα φωτόνια που συσσωρεύονται στην επιφάνεια των νουκλεονίων μέσα στο σώμα ενός στοιχείου και μεταξύ τους. Για να προκύψει σύνδεση μεταξύ δύο στοιχείων, τα ελεύθερα φωτόνια τους δεν χρειάζεται να περιστρέφονται μεταξύ των στοιχείων. Αυτό δεν συμβαίνει. Στην πραγματικότητα, το βαρύτερο στοιχείο αφαιρεί (προσελκύει) ελεύθερα φωτόνια από το ελαφρύτερο και τα διατηρεί (πιο συγκεκριμένα, από μόνο του). Και η ζώνη του ελαφρύτερου στοιχείου, από την οποία αφαιρέθηκαν αυτά τα φωτόνια, γίνεται σχεδόν γυμνή. Λόγω αυτού που η έλξη σε αυτήν τη ζώνη εκδηλώνεται σε μεγαλύτερο βαθμό. Και το ελαφρύτερο στοιχείο προσελκύεται από το βαρύτερο. Έτσι προκύπτει ένας χημικός δεσμός.
κατα δευτερον , η σύγχρονη χημεία βλέπει την ικανότητα των στοιχείων να προσελκύουν ηλεκτρόνια στον εαυτό τους παραμορφωμένη - ανάποδα Πιστεύεται ότι όσο μεγαλύτερη είναι η ηλεκτροαρνητικότητα ενός στοιχείου, τόσο περισσότερο μπορεί να προσελκύσει ηλεκτρόνια στον εαυτό του. Και το φθόριο και το οξυγόνο υποτίθεται ότι το κάνουν καλύτερα - προσελκύουν ηλεκτρόνια άλλων ανθρώπων. Όπως και άλλα στοιχεία των ομάδων 6 και 7.
Στην πραγματικότητα, αυτή η γνώμη δεν είναι τίποτα περισσότερο από μια αυταπάτη. Βασίζεται στην εσφαλμένη αντίληψη ότι όσο μεγαλύτερος είναι ο αριθμός της ομάδας, τόσο βαρύτερα είναι τα στοιχεία. Και επίσης, τόσο μεγαλύτερο είναι το θετικό φορτίο του πυρήνα. Αυτό είναι μαλακίες. Οι επιστήμονες εξακολουθούν να μην ενοχλούν καν να εξηγήσουν τι, από την άποψή τους, αποτελεί «χρέωση». Απλά, όπως στην αριθμολογία, μέτρησαν όλα τα στοιχεία στη σειρά και κατέθεσαν το ποσό της χρέωσης σύμφωνα με τον αριθμό. Υπέροχη πεζοπορία!
Είναι επίσης σαφές σε ένα παιδί ότι το αέριο είναι ελαφρύτερο από το πυκνό μέταλλο. Πώς πιστεύεται ότι στη χημεία τα αέρια είναι καλύτερα να προσελκύσουν ηλεκτρόνια στον εαυτό τους;
Πυκνά μέταλλα, φυσικά, είναι καλύτερα να προσελκύσουν ηλεκτρόνια.
Οι χημικοί επιστήμονες, φυσικά, μπορούν να διατηρήσουν τον όρο «ηλεκτροαραγωγικότητα» σε χρήση, καθώς είναι τόσο συχνός. Ωστόσο, θα πρέπει να αλλάξουν το νόημά τους στο ακριβώς αντίθετο.
Ηλεκτροπαραγωγικότητα Είναι η ικανότητα ενός χημικού στοιχείου σε ένα μόριο να προσελκύει ηλεκτρόνια στον εαυτό του. Και, φυσικά, αυτή η ικανότητα εκφράζεται καλύτερα σε μέταλλα από ό, τι σε μη μέταλλα.
Όσον αφορά τους ηλεκτρικούς πόλους στο μόριο, τότε, πράγματι, αρνητικός πόλος - πρόκειται για μη μεταλλικά στοιχεία που δίνουν ηλεκτρόνια, με χαμηλότερα πεδία έλξης. ΚΑΙ θετικός - αυτά είναι πάντα στοιχεία με πιο έντονες μεταλλικές ιδιότητες, με μεγάλα πεδία έλξης.
Ας χαμογελάμε μαζί.
Ηλεκτροπαραγωγικότητα - αυτή είναι μια άλλη προσπάθεια να περιγραφεί η ποιότητα ενός χημικού στοιχείου, μαζί με την ήδη υπάρχουσα μάζα και φορτίο. Όπως συμβαίνει συχνά, επιστήμονες από ένα άλλο επιστημονικό πεδίο, σε αυτήν την περίπτωση, η χημεία, σαν να μην εμπιστεύονταν τους συναδέλφους του φυσικού, αλλά απλώς επειδή κάθε άτομο, που κάνει ανακαλύψεις, πηγαίνει με τον δικό του τρόπο, και όχι μόνο να εξερευνά την εμπειρία άλλων.
Έτσι συνέβη αυτή τη φορά.
Η μάζα και το φορτίο δεν έκαναν τίποτα για να βοηθήσουν τους χημικούς να καταλάβουν τι συμβαίνει στα άτομα όταν αλληλεπιδρούν μεταξύ τους - και εισήχθη η ηλεκτροναγνητικότητα - η ικανότητα ενός στοιχείου να προσελκύσει ηλεκτρόνια που εμπλέκονται στο σχηματισμό ενός χημικού δεσμού. Πρέπει να παραδεχτούμε ότι η ιδέα αυτής της έννοιας διατυπώνεται πολύ σωστά. Με τη μόνη τροπολογία που αντικατοπτρίζει την πραγματικότητα σε ανεστραμμένη μορφή. Όπως έχουμε ήδη πει, είναι καλύτερο να προσελκύσουμε ηλεκτρόνια σε μέταλλα και όχι σε μέταλλα - λόγω των ιδιαιτεροτήτων του χρώματος των επιφανειακών νουκλεονίων. Τα μέταλλα είναι οι καλύτεροι αναγωγικοί παράγοντες. Τα μη μέταλλα είναι οξειδωτικοί παράγοντες. Τα μέταλλα αφαιρούνται, τα μη μέταλλα δίνονται. Μέταλλα - Γιν, μη μέταλλα - Γιανγκ.
Ο εσωτερισμός έρχεται στη βοήθεια της επιστήμης σε θέματα κατανόησης των μυστικών της Φύσης.
Σχετικά με κατάσταση οξείδωσης , τότε είναι μια καλή προσπάθεια να κατανοήσουμε πώς γίνεται η κατανομή των ελεύθερων ηλεκτρονίων μέσα σε μια χημική ένωση - ένα μόριο.
Εάν μια χημική ένωση είναι ομοιογενής - δηλαδή, είναι απλή, η δομή της αποτελείται από στοιχεία του ίδιου τύπου - τότε όλα είναι σωστά, πράγματι η κατάσταση οξείδωσης οποιουδήποτε στοιχείου στην ένωση είναι μηδέν. Επειδή δεν υπάρχουν οξειδωτικοί παράγοντες και ούτε αναγωγικοί παράγοντες σε αυτήν την ένωση. Και όλα τα είδη είναι ίσης ποιότητας. Κανείς δεν αφαιρεί ηλεκτρόνια, κανείς δεν τα δίνει. Είτε πρόκειται για πυκνή ουσία, είτε υγρό, ή αέριο, δεν έχει σημασία.
Η κατάσταση οξείδωσης, όπως και η ηλεκτροαρνητικότητα, αποδεικνύει την ποιότητα ενός χημικού στοιχείου - μόνο στο πλαίσιο ενός χημικού στοιχείου. Η κατάσταση οξείδωσης προορίζεται να συγκρίνει την ποιότητα των χημικών στοιχείων στην ένωση. Κατά τη γνώμη μας, η ιδέα είναι καλή, αλλά η εφαρμογή της δεν είναι απολύτως ικανοποιητική.
Είμαστε κατηγορηματικά εναντίον ολόκληρης της θεωρίας και της έννοιας της δομής των χημικών στοιχείων και των δεσμών μεταξύ τους. Λοιπόν, αν μόνο επειδή ο αριθμός των ομάδων, σύμφωνα με τις ιδέες μας, θα πρέπει να είναι μεγαλύτερος από 8. Αυτό σημαίνει ότι ολόκληρο το σύστημα καταρρέει. Και όχι μόνο αυτό. Γενικά, η μέτρηση του αριθμού των ηλεκτρονίων στα άτομα «από τη μία πλευρά» δεν είναι κατά κάποιο τρόπο σοβαρή.
Σύμφωνα με την τρέχουσα ιδέα, αποδεικνύεται ότι τα μικρότερα συμβατικά φορτία αποδίδονται στα ισχυρότερα οξειδωτικά - το φθόριο έχει φορτίο -1 σε όλες τις ενώσεις, το οξυγόνο είναι -2 σχεδόν παντού. Και για πολύ ενεργά μέταλλα - αλκαλική και αλκαλική γη - αυτά τα φορτία, αντίστοιχα, +1 και +2. Δεν είναι καθόλου λογικό. Αν και, επαναλαμβάνουμε, κατανοούμε πολύ καλά το γενικό σχήμα σύμφωνα με το οποίο έγινε - όλα για χάρη 8 ομάδων στον πίνακα και 8 ηλεκτρονίων στο εξωτερικό επίπεδο ενέργειας.
Τουλάχιστον, η τιμή αυτών των χρεώσεων για αλογόνα και οξυγόνο θα έπρεπε να ήταν η μεγαλύτερη με το σύμβολο μείον. Και στα μέταλλα αλκαλίων και αλκαλικών γαιών είναι επίσης μεγάλο, μόνο με το σύμβολο συν.
Σε κάθε χημική ένωση Υπάρχουν στοιχεία που δίνουν ηλεκτρόνια - οξειδωτικά, μη μέταλλα, αρνητικό φορτίο και στοιχεία που δίνουν ηλεκτρόνια - αναγωγικοί παράγοντες, μέταλλα, θετικό φορτίο. Με αυτόν τον τρόπο συγκρίνονται τα στοιχεία, συσχετίζονται μεταξύ τους και προσπαθούν να προσδιορίσουν την κατάσταση οξείδωσης.
Ωστόσο, για να μάθετε με αυτόν τον τρόπο, η κατάσταση οξείδωσης, κατά τη γνώμη μας, δεν αντικατοπτρίζει με ακρίβεια την πραγματικότητα. Θα ήταν πιο σωστό να συγκρίνουμε την ηλεκτροαρνητικότητα των στοιχείων σε ένα μόριο. Σε τελική ανάλυση, η ηλεκτροπαραγωγικότητα είναι σχεδόν η ίδια με την κατάσταση οξείδωσης (χαρακτηρίζει την ποιότητα, μόνο ενός στοιχείου).
Μπορείτε να λάβετε την κλίμακα της ηλεκτροαρατηρίας και να υποβάλετε τις τιμές της στον τύπο για κάθε στοιχείο. Και τότε θα είναι άμεσα ορατό ποια στοιχεία σταματούν ηλεκτρόνια και ποια απομακρύνονται. Το στοιχείο του οποίου η ηλεκτροπαραγωγικότητα στην ένωση είναι μεγαλύτερη - ο αρνητικός πόλος - δωρίζει ηλεκτρόνια. Και εκείνος του οποίου η ηλεκτροπαραγωγικότητα είναι η μικρότερη - ο θετικός πόλος, παίρνει ηλεκτρόνια.
Εάν υπάρχουν, για παράδειγμα, 3 ή 4 στοιχεία σε ένα μόριο, τίποτα δεν αλλάζει. Ρυθμίζουμε επίσης τις τιμές της ηλεκτροπαραγωγικότητας και συγκρίνουμε.
Ωστόσο, δεν πρέπει να ξεχάσετε να σχεδιάσετε ένα μοντέλο της δομής του μορίου. Πράγματι, σε οποιαδήποτε ένωση, εάν δεν είναι απλή, δηλαδή δεν αποτελείται από έναν τύπο στοιχείων, τα μέταλλα και τα μη μέταλλα συνδέονται μεταξύ τους, πρώτα απ 'όλα. Τα μέταλλα λαμβάνουν ηλεκτρόνια από μη μέταλλα και συνδέονται σε αυτά. Και τα ηλεκτρόνια 2 ή περισσότερων στοιχείων με πιο έντονες μεταλλικές ιδιότητες μπορούν ταυτόχρονα να απομακρύνουν ένα στοιχείο ενός μη μεταλλικού στοιχείου. Έτσι προκύπτει ένα πολύπλοκο, πολύπλοκο μόριο. Αλλά αυτό δεν σημαίνει ότι σε ένα τέτοιο μόριο τα μεταλλικά στοιχεία θα συνάψουν ισχυρό δεσμό μεταξύ τους. Ίσως να βρίσκονται σε αντίθετες πλευρές μεταξύ τους. Εάν στη συνέχεια, θα προσελκύονται. Αλλά ένας ισχυρός δεσμός σχηματίζεται μόνο εάν το ένα στοιχείο είναι πιο μεταλλικό από το άλλο. Είναι απαραίτητο ένα στοιχείο να επιλέγει ηλεκτρόνια - να τα αφαιρεί. Διαφορετικά, το στοιχείο δεν θα εκτεθεί - απελευθέρωση από ελεύθερα φωτόνια στην επιφάνεια. Το πεδίο έλξης δεν θα εκδηλωθεί πλήρως και δεν θα υπάρξει ισχυρή σύνδεση. το περίπλοκο θέμα - εκπαίδευση χημικοί δεσμοίκαι δεν θα αναφερθούμε λεπτομερώς σε αυτό το άρθρο.
Πιστεύουμε ότι έχουμε καλύψει με αρκετή λεπτομέρεια το θέμα που αφιερώνεται στην ανάλυση των εννοιών της «ηλεκτροναγικότητας», της «οξειδωτικής κατάστασης», της «οξείδωσης» και της «μείωσης» και σας παρέχουμε πολλές ενδιαφέρουσες πληροφορίες.
Από το βιβλίο Guided Dreams συγγραφέας Mir ElenaΑποκατάσταση «Όταν γεννιέται το Ενιαίο Σύστημα της Εξατομίκευσης, η ουσία και η ζωή χωρίζονται σε δύο. Από τώρα και στο εξής, εκτός αν επιτευχθεί η τελική ειρήνη, η ουσία και η ζωή δεν θα ξαναδούν ποτέ. " William, «Το μυστικό του χρυσού λουλουδιού» Μετά το κολέγιο
Από το βιβλίο Το βιβλίο των μυστικών. Το απίστευτο προφανές στη Γη και πέρα συντάκτης Vyatkin Arkady DmitrievichΟ μαζοχισμός ως ένας ακραίος βαθμός εθελοντικού βαμπίρ Με αυτή την έννοια, ο μαζοχισμός είναι παρόμοιος με την αλληλεξάρτηση. Οι μασσοχολόγοι είναι άνθρωποι που δέχονται ευχάριστες αισθήσεις από τη σωματική και ψυχική τους ταλαιπωρία. Με άλλα λόγια, τους αρέσει να ξυλοκοπούνται, να επιπλήσσονται, να εκφοβίζονται
Από το βιβλίο Βαμπίρ στη Ρωσία. Όλα όσα πρέπει να γνωρίζετε για αυτά! συντάκτης Μπάουερ ΑλέξανδροςΠώς να προσδιορίσετε το επίπεδο απώλειας αίματος Όταν ένα βαμπίρ πίνει αίμα, πίνει μισό λίτρο έως ενάμισι λίτρο αίματος κάθε φορά. Το ανθρώπινο σώμα περιέχει μόνο πέντε έως έξι λίτρα αίματος, επομένως αυτή η απώλεια αίματος δεν είναι απαραίτητα απειλητική για τη ζωή. Ωστόσο, ένα βαμπίρ μπορεί
Από το βιβλίο Μοντελοποίηση του μέλλοντος σε ένα όνειρο συγγραφέας Mir ElenaΑνάκαμψη Μετά την αποφοίτησή μου, εργαζόμενος ως μηχανικός σε κλειστή επιχείρηση, συνειδητοποίησα ότι δεν ήμουν στη θέση μου, γι 'αυτό αποφάσισα να αλλάξω το επάγγελμά μου και μπήκα στη σχολή αυτοσχεδιασμού τζαζ και αργότερα στο κλασικό τμήμα της μουσικής σχολής.
Από το βιβλίο Golden Rules of Feng Shui. 10 εύκολα βήματα για επιτυχία, ευεξία και μακροζωία συντάκτης Ogudin Valentin LeonidovichΒαθμός αρνητικής επίδρασης εξωτερικών αντικειμένων Τα εξωτερικά αντικείμενα έχουν τη μεγαλύτερη αρνητική επίδραση, που βρίσκονται ακριβώς μπροστά από την είσοδο του σπιτιού. Όσο περισσότερο βρίσκονται σε γωνία προς την είσοδο, τόσο ασθενέστερη γίνεται η επιρροή τους.
συγγραφέας Shure EduardΠρώτος βαθμός: Μαγειρική. Το κήρυγμα στο Όρος και η Βασιλεία του Θεού Το έργο του Χριστού ξεκινά με ένα Γαλιλαίο ειδύλλιο και την ανακοίνωση του «βασιλείου του Θεού». Αυτή η πρόβλεψη μας δείχνει τις δημοφιλείς διδασκαλίες του. Ταυτόχρονα, είναι μια προετοιμασία για πιο υπέροχο
Από το βιβλίο Divine Evolution. Από τη Σφίγγα στον Χριστό συγγραφέας Shure EduardΟ δεύτερος βαθμός έναρξης (καθαρισμός). Θαυματουργές θεραπείες. Χριστιανική θεραπεία Σε όλα τα αρχαία μυστήρια, η ηθική και διανοητική προετοιμασία ακολουθήθηκε από τον καθαρισμό της ψυχής, η οποία θα έπρεπε να αναζωογονήσει νέα όργανα σε αυτήν και στη συνέχεια να της δώσει την ικανότητα
Από το βιβλίο The Riddle of the Great Sphinx συγγραφέας Barbarene GeorgesΑποκατάσταση του αγάλματος Η πραγματική ηλικία της Μεγάλης Σφίγγας χρονολογείται από την αρχή της Αδαμικής εποχής. Τουλάχιστον είναι σύγχρονος των πυραμίδων, το σύνολο του οποίου, όπως θα δούμε, ολοκληρώθηκε με τον εαυτό του. Η εικόνα της Μεγάλης Σφίγγας έχει εκτεθεί τους τελευταίους αιώνες
Από το βιβλίο Healing the Soul. 100 τεχνικές διαλογισμού, θεραπευτικές ασκήσεις και χαλάρωση συντάκτης Rajneesh Bhagwan ShriΕπαναφορά του ρυθμού ... Ρυθμίστε την ίδια ώρα για να κοιμηθείτε - αν κάθε βράδυ είναι έντεκα, τότε έντεκα. Αυτό είναι το πρώτο: ξεκινήστε μια συγκεκριμένη ώρα και σύντομα το σώμα θα μπορέσει να εισέλθει σε αυτόν τον ρυθμό. Μην αλλάξετε αυτή τη φορά, διαφορετικά θα συγχέετε το σώμα. Σώμα
συγγραφέας Kuzmishin E.L.Μαθητευόμενος βαθμός Είσοδος σε μαθητευόμενους βαθμούς Διακόσμηση του κιβωτίου και των άμφων Οι τοίχοι και η οροφή του κουτιού πρέπει να κρέμονται με μπλε και λευκό ύφασμα χωρίς επιχρυσωμένο. Πάνω από το κεφάλι του Λατρευτικού Δασκάλου είναι ένα τρίγωνο που περιβάλλεται από λάμψη με το όνομα που αναγράφεται στο κέντρο του
Από το βιβλίο του Cagliostro και του Αιγυπτιακού Τεκτονισμού συγγραφέας Kuzmishin E.L.Είσοδος στο βαθμό του μαθητευόμενου Διακόσμηση του Στέμματος και Άμφια Οι τοίχοι και η οροφή του Καταφύγιου θα κρεμαστούν με μπλε και λευκό ύφασμα χωρίς επιχρύσωση. Πάνω από το κεφάλι του Σεβάσμιου Κυρίου είναι ένα τρίγωνο που περιβάλλεται από λάμψη με το όνομα "Ιεχωβά" χαραγμένο στο κέντρο του, κεντημένο
Από το βιβλίο Αυτοβιογραφία ενός Γιόγκι συντάκτης Yogananda ParamahansaΚεφάλαιο 23 Παίρνω πτυχίο πανεπιστημίου - Αγνοείτε τους φιλοσοφικούς ορισμούς του βιβλίου σας, χωρίς αμφιβολία να βασίζεστε σε κάποια διακριτική «διαίσθηση» για να σας καθοδηγήσει στις εξετάσεις σας. Αλλά αν δεν επειγόντως στραφείτε σε μια πιο επιστημονική μέθοδο, τότε πρέπει
Από το βιβλίο της Καμπάλα. Άνω κόσμος. Η αρχή του τρόπου συντάκτης Λάτμαν Μάικλ7.5. Ο Βαθμός της Πραγματοποίησης του Κακού Όπως εξηγείται στο άρθρο «Δίνοντας το Τορά», η ευχαρίστηση και η ευδαιμονία καθορίζονται από τον βαθμό ομοιότητας με τον Δημιουργό στις ιδιότητες, ενώ η ταλαιπωρία και η ανυπομονησία καθορίζονται από τον βαθμό διαφοράς από τον Δημιουργό. Κατά συνέπεια, ο εγωισμός είναι αηδιαστικός και αφόρητα οδυνηρός για εμάς,
Επιλογή 1
1. Προσδιορίστε την κατάσταση οξείδωσης των ατόμων των χημικών στοιχείων στις ακόλουθες ενώσεις: HNO₃, NO₂, H₃N, SO2, N₂O.
2. Χρησιμοποιώντας τον περιοδικό πίνακα, τακτοποιήστε τα ακόλουθα στοιχεία με τη σειρά της μείωσης της ηλεκτροπαραγωγικότητας: O, N, Be, B, Li, C. Προσδιορίστε πού πρέπει να βρίσκονται το φθόριο και το νάτριο σε αυτήν τη σειρά. Εξηγήστε την απάντηση. 
3. Πώς αλλάζει η κατάσταση οξείδωσης ενός ατόμου θείου κατά την οξείδωση του SO2 σε SO2; Εξηγήστε την απάντηση.
Επιλογή 2
1. Προσδιορίστε την κατάσταση οξείδωσης των ατόμων των χημικών στοιχείων στις ακόλουθες ενώσεις: CO₂, H₃PO₄, SiH₄, P₂O₅, Mg₂Si.
2. Στην κατεύθυνση των ατόμων των οποίων χημικό στοιχείο το γενικό ηλεκτρονικά ζεύγη, στα μόρια των ακόλουθων ενώσεων: BF3, PCl₃, CS2, CCl₄, HBr? Δώστε μια αιτιολογημένη απάντηση.
3. Η κατάσταση οξείδωσης του άνθρακα αλλάζει κατά τη διάρκεια του σχηματισμού ανθρακικό οξύ H₂CO₃ κατασκευασμένο από διοξείδιο του άνθρακα και νερό; Εξηγήστε την απάντηση.
Επιλογή 3
1. Προσδιορίστε την κατάσταση οξείδωσης των ατόμων των χημικών στοιχείων στις ακόλουθες ενώσεις: Cl2, NaClO, CaCl2, HF, SO2, Cl2O2.
2. Χρήση περιοδικό σύστημα χημικά στοιχεία, τακτοποιήστε τα ακόλουθα στοιχεία σε αύξουσα σειρά της ηλεκτροαναγονικότητάς τους: P, Al, Cl, Na, S, Mg. Βρείτε ένα σημείο σε αυτήν τη σειρά για κάλιο και φθόριο. Εξηγήστε την απάντηση. 
3. Πώς αλλάζει η κατάσταση οξείδωσης του άνθρακα κατά την καύση του μεθανίου CH2 με το σχηματισμό μονοξειδίου του άνθρακα (IV) και νερού; Εξηγήστε την απάντηση.
Επιλογή 4
1. Προσδιορίστε την κατάσταση οξείδωσης των ατόμων των χημικών στοιχείων στις ακόλουθες ενώσεις: H₂SO₄, SO₂, NO₂, BF₃, H₂S.
2. Προς τα άτομα του τι χημικά στοιχεία Τα κοινά ζεύγη ηλεκτρονίων μετατοπίζονται, στα μόρια των ακόλουθων ενώσεων: H2O, PCl3, H2N, H2S, CO2; Δώστε μια αιτιολογημένη απάντηση.
3. Αλλάζουν οι καταστάσεις οξείδωσης των ατόμων όταν σχηματίζεται νερό απλές ουσίες - υδρογόνο και οξυγόνο; Εξηγήστε την απάντηση.


