Електричеството се нарича свойство на химичния елемент за привличане на електроните към атома от други елементи, с които този елемент образува химическа връзка в връзките.
Когато химическата връзка се образува между атомите с различни елементи, общият електронен облак се измества до по-електрически атом, поради което връзката става ковалентно полярна, и с голяма разлика на електроросителя - йон.
Електричеството се взема предвид при писането на химични формули: символът на най-електрификационния елемент се записва в двоичните връзки.
Електричеството се увеличава в посоката отляво надясно за елементи от всеки период и намалява по посока отгоре надолу за елементите на една и съща група PS.
Valence. Елементът се нарича свойство на своите атоми да бъде свързан с определен брой други атоми.
Има стоихиометрични, електронни валентни и координационни номера. Ще разгледаме само стехиометричната валентност.
Стехиометрични Valence показва колко атома на друг елемент прилепват атом на този елемент. На единица валентност, приета валентност на водород, защото Водородът винаги е моновалентен. Например, в НС1, Н20, NH3 съединения (правилното писане на амоняк Н3Н вече се използва в съвременни ръководства), СН 4 хлор е моновалентен, кислороден двувалентен, азотен тривалентен и въглероден тетравалентен.
Стоихиометричната валентност на кислород обикновено е равна на 2. Тъй като почти всички елементи образуват съединения с кислород, е удобно да се използва като препратка, за да се определи валентността на друг елемент. Например, в съединения Na2O, COO, Fe2O3, така че 3 натриев еднолентен, кобалт бивалент, желязото е тривалентен, сяра шестнадесетичен.
При окислителни и възстановителни реакции ще бъде важно за нас да определим степените на окислението на елементите.
Степен на окисление Елементът в веществото се нарича своята стехиометрична валентност, взета с плюс знак или минус.
Химичните елементи са разделени на елементи постоянна валентност Валентни променливи елементи.
1.3.3. Молекулни и нееластични вещества. Вид на кристалната решетка. Зависимостта на свойствата на веществата от техния състав и структура.
В зависимост от това кое състояние на съединението е в природата, те са разделени на молекулярно и не-егуриращо. В молекулни вещества Най-малките структурни частици са молекули. Тези вещества имат молекулярна кристална решетка. При неракули вещества, атомите или йони са най-малките структурни частици. Кристалната решетка е атомна, йон или метал.
Видът на кристалната решетка до голяма степен определя свойствата на веществата. Например металите имат метален тип кристална решеткасе различават от всички останали елементи висока пластичност, електрическа и топлопроводимост. Тези свойства, както и много други - коване, метален гланц и др. Поради специален вид комуникация между метални атоми - метална връзка. Трябва да се отбележи, че имотите, присъщи на металите, се проявяват само в кондензирано състояние. Например среброто в газообразно състояние няма физически свойства на металите.
Специален вид комуникация в металите е метален - поради недостига на валентни електрони, така че те са общи за цялата структура на метала. Най-простият модел на металната конструкция приема, че кристалната решетка на металите се състои от положителни йони, заобиколени от свободни електрони, движението на електроните се среща хаотични, като газови молекули. Този модел обаче качествено обяснява много свойства на металите, като количествена проверка се оказва недостатъчна. По-нататъшното развитие на теорията на металното състояние доведе до създаването теория на металитекоето се основава на изпълненията на квантовата механика.
В възлите на кристалната решетка има катиони и метални атоми, а електроните се движат свободно по кристалната решетка.
Характерното механично свойство на металите е пластмасапоради особеностите на вътрешната структура на техните кристали. Под пластичността способността на органите под действието на външни сили да се подложи на деформация, която остава и след прекратяване на външното влияние. Това свойство на металите им позволява да им дадат различна форма при рязане, да се вози метални в листове или да го издърпат в тел.
Пластичността на металите се дължи на факта, че с външните ефекти на слоевете на йони, образуващи кристалната решетка, изместен спрямо един с друг, без да се счупва. Това се случва в резултат на факта, че движещите се електрони, поради свободното преразпределение, продължават да комуникират между йонните слоеве. В механичния ефект върху твърдото вещество с ядрена решетка, нейните отделни слоя се изменят и адхезията между тях се счупва поради разкъсването ковалентни връзки.
йониТогава тези вещества йонна кристална решетка.

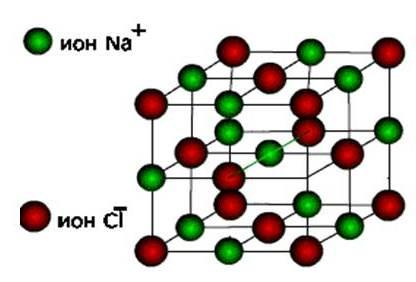
Това са соли, както и оксиди и хидроксиди на типични метали. Това са твърди, крехки вещества, но тяхното основно качество : Разтвори и топи на тези съединения провеждат електрически ток.
Ако в възлите на кристалната решетка се намират атомиТогава тези вещества атомен тип кристална решетка(Диамант, бор, силициев алуминий и силициеви оксиди). Според свойствата, много твърдо и огнеупорно, неразтворимо във вода.
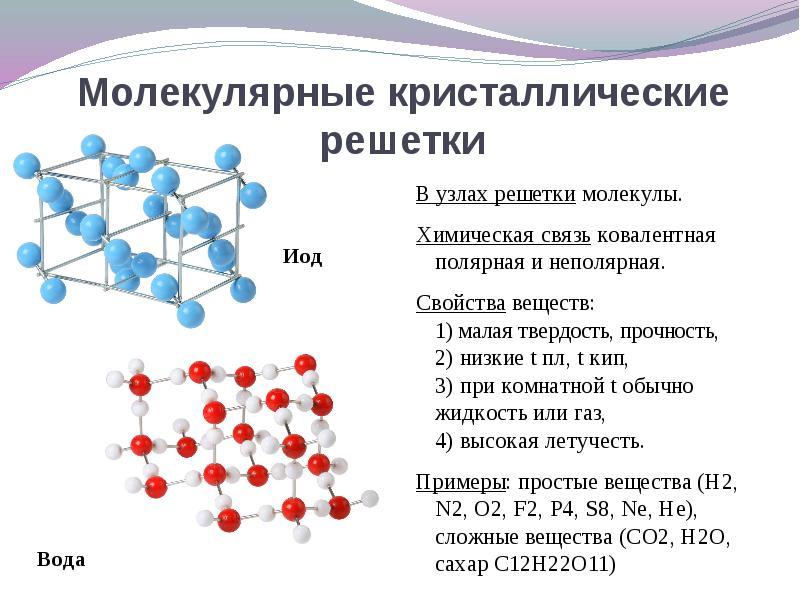
Ако в възлите на кристалната решетка се намират молекулиТези вещества (при нормални условия на газове и течности: О2, НС1; I 2 органични вещества).
Интересно е да се отбележи металът на галий, който се топи при температура 30 ° С. Тази аномалия се обяснява с факта, че молекулите на GA 2 и неговите свойства са разположени в сглобките на кристалната решетка, в която става подобно на веществата с молекулярна кристална решетка.
Пример.Немолекуларната структура има всички неметали на групата:
1) въглерод, бор, силиций; 2) флуор, бром, йод;
3) кислород, сяра, азот; 4) хлор, фосфор, селен.
В неластични вещества Най-малките структурни частици са атоми или йони. Кристалната решетка е атомна, йонна или метала
За решение Този въпрос е по-лесен за преминаване от обратното. Ако в възлите на кристалната решетка се намират молекулиТогава тези вещества молекулен тип кристална решетка(при нормални условия на газове и течности: О2, НС1; също I 2, ромбично сяра S 8, бял фосфор Р 4, органични вещества). Чрез свойства, те са крехки ниско топящи се съединения.
Във втория отговор има флуорен газ, в третия кислород, азот, в четвъртия хлорен газ. Така че тези вещества имат молекулна кристална решетка и молекулна структура.
В първо Отговорете на всички вещества - твърди съединения при нормални условия и образувайте ядрена решетка, което означава, че има неетика.
Правилен отговор:1) въглерод, бор, силиций
- Най-малко електрификацията е химическият елемент.
- желязо
- магнезий
- калций
Трябва да се обърне внимание на израза "най-малко електроелогически", т.е. елемента с най-големите метални свойства. Този аргумент ще елиминира от възможните отговори на Azot като не-метал, и да се задържа на калций, като най-активните от металите, предложени в задачата. Отговор: 4.
- Най-полярната химическа връзка в една от молекулите
- Cl 4.
- 4.
Познаването на моделите на промени в електронната моня в периодите и групите от периодичната система ди Менделеев дава възможност да се изключи от списъка на квадрикуларните съединения на въглероден метан СН 4 и от останалите халиди за спиране на CF4, както и на Съединение с въглерод с най-електрификацията на всички химически елементи - флуор. Отговор: 2.
- В хлоридни молекули и съответно химическа комуникация на хлор
- йонийски и ковалентен полярен
- йонични и ковалентни не-полярни
- колентна полярна и ковалентна неполярна
- водород и ковалентен не-полярен
Ключовата дума за бързото и правилното изпълнение на тази задача е думата "съответно". В предложените версии само един от отговорите започва с думите "ковалентен полярен", т.е. връзките, характерни за хлоргон. Отговор: 3.
- Степента на окисление на манган в съединението, формулата от която до 2 mN04 е еднаква
Познаването на правилата за изчисляване на степените на окисление на елементите по формулата ще ви позволят да изберете правилния отговор. Отговор: 3.
- Най-малката степен на окисление има сяра в сол
- сулфатски калий
- серен калий
- сулфиден калий
- калиев хидросулфат
Очевидно бързото изпълнение на тази задача ще бъде да се преведат имената на солите във формулата. Тъй като сярата е елемент от групата чрез, тогава най-малка степен на окисление е -2. Тази стойност съответства на съединение с формула K2S-калиев сулфид. Отговор: 3.
- Степента на окисление е +5 хлорен атом има в йон
- C1O - 4.
- C1O -
- C1O - 3.
- C1O - 2.
Когато изпълнявате тази задача, трябва да обърнете внимание на факта, че в състоянието няма електронни съединения, а хлорните йони с един отрицателен заряд ("-"). Тъй като сумата на степените на окисляването на атомите в йона е равна на заряда на йона, общият отрицателен заряд на кислородните атоми в шарнирния йон трябва да бъде -6 (+5 - 6 \u003d -1). Отговор: 3.
- Степента на окисление -3 азот има във всяка от двете връзки
- NF 3 и NH3
- NH4Cl и N2O3
- NH4C и NH3
- HNO 2 и NF 3
За да определите правилния отговор, е необходимо да се разделят умствените опции за отговори на ляво и дясно звуков сигнал. След това изберете този, в който съединенията имат по-прост състав - в нашия случай, това е дясната част на двоичното съединение. Анализът ще елиминира отговорите 2 и 4, като в оксид и флуорид в азот положителната степен на окисление, както в по-малко електрифициращ елемент. Този аргумент дава възможност да се изключи и реагира 1, тъй като е първото вещество - всички същите азотни флуорид. Отговор: 3.
- На веществата на молекулната структура не включват
- въглероден двуокис
- метан
- хлорород
- калциев карбонат
Трябва да обърнете внимание на негативната преценка, установена в състоянието на заданието. Тъй като газообразните вещества при нормални условия имат молекулна кристална решетка в твърдо състояние, условието за присвояване 1-3 не съответства на състоянието на състоянието. Приписването на калциев карбонат към солите отново потвърждава правилния отговор. Отговор: 4.
- Са следните решения за свойствата на веществата и тяхната структура?
А. Мокро бельо изсъхва при замръзване, защото веществата на молекулната структура са способни да сублимацията (сублимацията).
Б. Мокро бельо изсъхва при замръзване, защото водните молекули имат ниско молекулно тегло.
- вярно е само А.
- само вдясно Б.
- и двете решения са верни
- и двамата решения не са верни.
Знание физически свойства Веществата на молекулната структура правят да се реши, че причината за сушенето на пране в замръзване е способността на лед до сублимация, а не диполната структура на водните молекули. Отговор: 1.
- Молекулната структура има всяка от веществата, чиито формули са дадени в реда
- CO 2, HNO 3, SAO
- Na2 S, BR 2, № 2
- H 2 SO 4, CU, O 3
- SO 2, I 2, NSL
Тъй като предложените варианти съдържат три вещества, е логично да се разделят тези версии на три вертикални звукови сигнала. Анализът на всеки от тях, започвайки с вещества от по-прост състав (средно podstolbik), ще елиминира отговора 3, тъй като съдържа метална мед, която има метална кристална решетка. Подобен анализ на правилния звуков сигнал ще направи възможно елиминирането на отговора 1, тъй като съдържа оксид на металния метал (йонна решетка). От двете останали опции е необходимо да се изключи вариант 2, тъй като съдържа сол на алкален метал - натриев сулфид (йонна решетка). Отговор: 4.
Задачи за независима работа
- Степента на окисление е +5 азотни експонати в съединението, формулата на която
- N 2 O 5
- N 2 O 4
- N 2 O.
- Степента на окисление на хром в съединението, формулата на която (NH4) 2 CR2O7 е равна на
- Степента на окисляване на азота намалява в ред вещества, формулите на които
- NH3, No 2, KNO 3
- N 2O 4, KNO 2, NH4CL
- N2, N2O, NH3
- HNO 3, HNO 2, № 2
- Степента на окисление на хлора се увеличава в редица вещества, формулите
- NSLO, NSLO 4, KSLO 3
- C1, C1 2O 7, KSLO 3
- Са (C1O) 2, KSLO 3, NSLO 4
- KSL, KSLO 3, KSLO
- Най-полярната химическа комуникация в молекулата
- амоняк
- серододорд.
- бромомодород
- fluorodorod.
- Вещество с ковалентна неполярна връзка
- бял фосфор
- алуминиев фосфид
- фосфор хлорид (V)
- калциев фосфат
- Формули на вещества само с йонна връзка, записана подред
- натриев хлорид, фосфор хлорид (V), натриев фосфат
- натриев оксид, натриев хидроксид, натриев пероксид
- серулърд, калциев карбид, калциев оксид
- калциев флуорид, калциев оксид, калциев хлорид
- Атомна кристална решетка има
- натриев оксид
- калциев оксид
- серен оксид (IV)
- алуминиев оксид
- Връзка с йонийски кристална решетка образувани, когато хлорът взаимодейства с
- фосфор
- бариев
- водород
- грей
- Са следните решения за амониевия хлорид?
А. Амониев хлорид е субстанцията на йонната структура, образувана от ковалентни полярни и йонични връзки.
Б. Амониев хлорид - веществото на йонната структура и следователно твърдо, огнеупорно и не-летливо.
- вярно е само А.
- само вдясно Б.
- и двете решения са верни
- и двете решения са неправилни
08. Електричество, окислителна степен, окисление и възстановяване
Нека обсъдим значението на изключително интересни концепции, които съществуват в химията, а често се случва в науката, достатъчно объркваща и се използва в обърната форма. Тя ще бъде за "електрическагативност", "степента на окисление" и "редокс реакции".
Какво означава това - концепцията се използва в обърната форма?
Ще се опитаме постепенно да разкажем за това.
Електричество Демонстрират нас на редакциите на химичния елемент. Това е способността му да взема или да даде безплатни фотони. И то също е източник или енергиен абсорбатор (етер). Ян или ин.
Степен на окисление - Това е концепция, подобна на концепцията за "електричество". Той също така характеризира редокс свойствата на елемента. Но между тях има следващата разлика.
Електричеството дава характеристика на отделен елемент. Сам по себе си, извън намирането му в химическо съединение. Докато степента на окисление характеризира нейните окислителни и възстановителни способности именно, когато елементът е част от всяка молекула.
Нека поговорим малко за това каква е способността да се окислява и каква е способността да се възстанови.
Окисление - Това е процесът на прехвърляне към друг елемент от свободните фотони (електрони). Окисляването изобщо не изключва електроните, както се счита за в науката. . Когато елементът окислява друг елемент, той действа като киселина или кислород (следователно името "окисление"). Окислява - означава да се насърчи унищожаването, разпадането, горещите елементи . Способността да се окислява е способността да предизвика разрушаването на молекулите от предаваната от тях енергия (свободни фотони). Не забравяйте, че енергията винаги унищожава веществото.
Изненадващо, колко време в науката има противоречия в логиката, които не са забележими от никого.
Тук, например: "Сега знаем, че окислителният агент е вещество, което електроните придобива, и редуциращият агент е веществото, което им дава" (енциклопедия на младия химик, изделие "окисление и реакция)".
И веднага, два параграфа по-долу: "Най-силният окислител е електрически ток (поток от отрицателно заредени електрони)" (пак там).
Тези. първият цитат заявява, че окислителният агент е какъв е електроните, а във втория окислителен разговор какво дава.
И подобни погрешни заключения, които противоречат взаимно, са принудени да запомнят в училищата и институтите!
Известно е, че най-добрите окислители са неметали. Освен това, по-малкият номер на периода и по-голям номер на групата, са изразени по-силни свойствата на окислителя. Това не е изненадващо. Разкрихме причините за това в статия, посветена на анализа на периодичната система, във втората част, където говореха за цвета на нуклените. От 1-ва група до 8 цветът на нуклените в елементите постепенно се променя от лилаво до червено (ако смятате, че синьото на D- и F-елементи). Комбинацията от жълти и червени частици улеснява връщането на натрупаните безплатни фотони. Жълт се натрупва, но държи слабо. И червеният допринася за връщането. Поставете фотоните - това е процесът на окисление. Но когато някои са червени, тогава няма частици, които могат да натрупват фотони. Ето защо елементи от 8 групи, благородни газове, а не окислителни агенти, за разлика от техните съседи, халоген.
Възстановяване - Това е процес, противоположен на окислението. Сега, в науката, се смята, че когато химическият елемент получава електрони, той е възстановен. Тази гледна точка е напълно възможно да се разбере (но не да приеме). Когато изучавате структурата на химическите елементи, е открито, че те излъчват електрони. Заключи, че електроните са част от елементите. Това означава, че прехвърлянето на електрони е, вид, възстановяване на загубената му структура.
Всъщност всичко е погрешно.
Електроните са безплатни фотони. Те не са нуклеони. Те не са част от тялото на елемента. Те са привлечени чрез навлизане навън и се натрупват на повърхността на нуклените и между тях. Но тяхното натрупване изобщо не възстановява структурата на елемента или молекулата. Обратно, тези фотони, излъчвани от тях етер (енергия), отслабват и унищожават връзките между елементите. И това е процесът на окисление, но не и възстановяване.
Възстановете молекулата, в действителност, - вземете енергия от нея (в този случай, безплатни фотони) и не докладвайте. Избор на фотони, възстановяването на елемента компакти съдържа веществото - възстановява го.
Най-добрите редуциращи агенти са метали. Това свойство естествено следва от техния качествен и количествен състав - техните области на привличане са най-големият и на повърхността задължително има много или достатъчно частици. на син цвят.
Можете дори да изтеглите следното определяне на металите.
Метален - Това е химичен елемент, в състава на повърхностните слоеве, от които има непременно сини частици.
НО неметален - Това е елемент, в състава на повърхностните слоеве, от които няма или почти без фотони на синьо и непременно има червено.
Металите със силното им привличане перфектно вземат електрони. И затова те са редуциращи агенти.
Ние даваме дефиницията на понятията за "електричество", "степента на окисление", "редокс реакции", които могат да бъдат намерени в учебниците по химия.
« Степен на окисление - условното зареждане на атома в съединението, изчислено въз основа на предположението, че се състои само от йони. При определянето на тази концепция обикновено се смята, че електроните на свързването (валентността) отиват в повече електрически атоми и следователно съединенията се състоят от това, тъй като са от положителни и отрицателно заредени йони. Степента на окисление може да има нула, отрицателни и положителни стойности, които обикновено се поставят върху символа на елемента отгоре.
Нулевата стойност на степента на окисление се приписва на атомите на елементите в свободното състояние ... Отрицателната стойност на степента на окисление има тези атоми, към които се измества облакът на свързващия електронен (електронен двойка). Флуор във всичките му връзки е равно на -1. Положителна степен на окисление има атоми, които дават валентни електрони на други атоми. Например, алкални и алкални земни метали, тя е съответно +1 и +2. В обикновените йони тя е равна на обвинението на йона. В повечето съединения степента на окисление на водородните атоми е + 1, но в хидридите на металите (съединения с водород) и други - е равно на -1. За кислород, степента на окисление -2 е характерна, но например, в съединение с флуор, той ще бъде +2, а в пероксидационни връзки -1. ...
Алгебричната сума на окисляването на атомите в съединението е нула и в сложния йон - зарядността на йона. ...
Най-високата степен на окисление е най-голямата положителна стойност. За повечето елементи тя е равна на номера на групата в периодичната система и е важна количествена характеристика на елемента в нейните връзки. Най-малката стойност на степента на окисление на елемента, която се среща в нейните съединения, е обичайно да се нарича по-ниска степен на окисление; Всички други - междинен "(енциклопедичен речник на младия химик, статия" степен на окисление ").
Ето основната информация, свързана с тази концепция. Тя е тясно свързана с друг термин - "електричество".
« Електричество - Това е способността на атом в молекулата да привлече електрони, участващи в образуването на химическа връзка "(енциклопедичен речник на младежкия химик, статия" електричество ").
"Редукционните реакции са придружени от промяна в степента на окисление на атомите, които са част от реагиращите вещества, в резултат на движещи се електрони от атома на един от реагентите (редуциращ агент) към другия атом. При окислителни и редуциращи реакции, окисление (електронно връщане) и възстановяване (добавяне на електрон) (химически енциклопедичен речник) (химически енциклопедичен речник ED. I.L. Knunyantz, статия "окисление и редуциращи реакции").
Според нас има доста грешки в тези три понятия.
Първо Ние вярваме, че формирането на химическа връзка между двата елемента изобщо не е процес на социализация на техните електрони. Химическата връзка е гравитационна връзка. Електроните, които се твърдят, че летят около ядрото, са безплатни фотони, натрупващи се на повърхността на нуклените в тялото на елемента и между тях. За да може между два елемента да се извърши връзка, техните безплатни фототатори не трябва да се изпълняват между елементите. Това не се случва. Всъщност, по-тежкият елемент слиза (привлича) безплатни фотони с по-лек и ги оставя (по-точно, на себе си). И зоната на по-лекия елемент, с която тези фотони са били отстранени по един или друг начин. Поради това привличането в тази зона се проявява в по-голяма степен. И по-лесният елемент е привлечен от тежко. Така възниква химическата връзка.
Второ , Съвременната химия вижда способността на елементите да привлекат електрони, изкривени - обърнат. Смята се, че по-голямата електричество на елемента, толкова повече той може да привлече електрони. А флуорът с кислород го прави най-добре - те привличат други електрони за себе си. Както и други елементи 6 и 7 групи.
Всъщност това мнение е не повече от заблуда. Тя се основава на погрешното изглед, като че ли е по-тежкият номер на групата. И също така, толкова по-голям е положителният заряд на ядрото. Това е глупост. Учените дори не се безпокоят, за да обяснят, че от тяхната гледна точка е "такса". Просто, както в нумерологията, те преизчисли всички елементи в ред и са подписани в съответствие с броя на стойностите на зареждане. Голям поход!
Това е ясно и дете, което газът е по-лек от гъст метал. Как се случи това в химията се счита, че газовете са по-добре привличащи електрони?
Глътки метали, разбира се, те са по-добре привличащи електрони.
Учените - химици, разбира се, могат да оставят концепцията за "електричество" в курса, тъй като е толкова често срещана. Те обаче ще трябва да променят смисъла си в противоположната директна.
Електричество - Това е способността на химичния елемент в молекулата да привлече електрони. И, разбира се, в металите, тази способност е по-добре изразена от неметалите.
Що се отнася до електрическите стълбове в молекулата, тогава наистина, отрицателен полюс - Това са неметални елементи, които дават електрони с по-малки области на привличане. НО положителен - Винаги е елементи с по-изразени метални свойства, с големи области на привличане.
Усмих се заедно.
Електричество - Това е друг, друг опит да се опише качеството на химичния елемент, заедно с вече съществуващите претегляния и зареждане. Както често се случва, учените от различна област на науката, в този случай, химия, сякаш не се доверяват на колегите си към физиците, а по-скоро, просто защото всеки човек, което прави открития, е по свой собствен начин, а не по свой собствен начин, а не просто проучване на опита на другите.
Така се случи този път.
Масата и обвинението не помогнаха на химиците да разберат какво се случва в атомите, когато са взаимодействащи помежду си - и е въведена електроразядност - способността на елемента да привлича електрони, участващи в образуването на химическа връзка. Трябва да се признае, че идеята за тази концепция е много вярна. С единственото изменение, което отразява реалността в обърната форма. Както казахме, най-добре е да се привличат метални електрони, а не на неметали - по силата на характеристиките на цвета на повърхностните нуклеони. Металите са най-добрите редуциращи агенти. Немесели - окислителни средства. Са взети метали, неметалите дават. Метали - ин, Nemmetalla - Ян.
Езотеричният идва да помогне на науката по въпросите на разбирането на тайните на природата.
Относно степен на окисляване Това е добър опит да се разбере как се наблюдава разпределението на свободните електрони в химичното съединение - молекули.
Ако химичното съединение е равномерно - това е просто, неговата структура се състои от елементи от същия тип - тогава всичко е вярно, наистина степента на окисление на всеки елемент в съединението е нула. Тъй като в тази връзка няма окислители и няма рестарти. И всички елементи са равни по качество. Никой не взема електроните, никой не дава. Дали е плътно вещество или течност, или газ - без значение.
Степента на окисление, както и електрическата активност, демонстрира качеството на химичния елемент - само в рамките на химичния елемент. Степента на окисление е предназначена за сравняване на качеството на химичните елементи в съединението. Според нас идеята е добра, но нейното прилагане не е доста удовлетворено.
Ние категорично се противопоставяме на цялата теория и концепция за структурата на химическите елементи и връзките между тях. Е, ако само защото броят на групите, според нашите идеи, трябва да бъде повече от 8. и следователно цялата система се срине. Да, а не само това. Като цяло, преизчисляването на броя на електроните в "пръстите" атомите не са сериозни.
В съответствие с настоящата концепция, се оказва, че най-силните окислители са присвоени най-малките условни заряди - флуорът има заряда -1 във всички съединения, кислород почти навсякъде -2. И в много активни метали - алкална и алкална пръст - тези заряди съответно +1 и +2. В крайна сметка, това е абсолютно логично. Въпреки че повтаряме, разбираме общата схема много добре, в съответствие с това, с което е направено - всичко за 8 групи в таблицата и 8 електрона на външното енергийно ниво.
Въпреки това, най-малко, величината на тези такси в халоген и кислород трябваше да бъде най-голямата с минус знак. И алкални и алкални земни метали също са големи, само с плюс знак.
Във всеки химично съединение Има елементи, които дават на електрони - окислителни агенти, неметали, отрицателни заряди и елементи, които приемат електрони - редуциращи агенти, метали, положителна заряда. Това е точно начинът за сравняване на елементите, да ги свържете помежду си и да се опитате, определяйки степента на окисление.
Въпреки това, за да разберем по този начин степента на окисление, според нас, не отразява точно реалността. Би било по-правилно да се сравнява електричеството на елементите в молекулата. В крайна сметка, електричеството е почти същата като степента на окисление (характеризира качеството, само отделен елемент).
Можете да вземете електрическата скала и да го поставите във формулата за всеки елемент. И тогава ще се види веднага, кои елементи са дадени електрони и които са взети. Този елемент, чиято електричество в съединението е най-високият - отрицателен полюс, дава електрони. И тази, чиято електричество е най-малката - положителна полюс, взема електроните.
Ако елементи, признайте, 3 или 4 в молекулата, нищо не се променя. Всички също поставят величината на електрическатагургия и сравнете.
Въпреки че не трябва да се забравя да се начертаят модела на структурата на молекулата. Наистина, във всяко съединение, ако не е просто, то не се състои от един вид елементи, са свързани помежду си, преди всичко, метали и неметали. Металите избират електрони в неметали и се свързват с тях. И в един елемент от неметал, електроните 2 могат да бъдат избрани едновременно или по-голям брой елементи с по-изразени метални свойства. Така се случва комплексната молекула. Но това не означава, че в такава молекула метални елементи ще дойдат в твърда връзка и един с друг. Може би ще бъдат разположени от противоположни страни един от друг. Ако наблизо - те ще привлекат. Но твърдата връзка се образува само ако един елемент е по-метален от другия. Не забравяйте да направите един елемент, изберете електроните - отстранени. В противен случай елементът няма да се случи - освобождаване от безплатни фотони на повърхността. Полето привличане няма да се прояви добре и няма да има трайна връзка. то комплексна тема - Образование химически връзки.И ние няма да разкажем подробно в тази статия.
Ние вярваме, ние силно запалваме темата, посветена на анализа на концепциите за "електричество", "окислителна степен", "окисление" и "възстановяване" и придават на вниманието ви много любопитна информация.
От книгата управлява мечтите авторът на Световната ЕленаВъзстановяване "Когато се роди един единствен признак на инди-Appeam, същността и животът е разделен на две. От този момент, ако последният свят не достигне, същността и животът никога повече няма да се виждат. " Уилям, "Мистерия на златното цвете" след Института
От книгата книгата на тайните. Невероятно очевидно на земята и чужбина Автор Vyatkin Arkady Dmitievich.Мазохизмът като изключителна степен на доброволен венец в този смисъл мазохизъм е подобен на телекомуникациите. Мазохистите са хора, които получават приятни усещания от собственото си физическо и психическо страдание. С други думи, те харесват, когато бият, увиват, мак
От книгата вампири в Русия. Всичко, което трябва да знаете за тях! Автор Бауер АлександърКак да се определи степента на загуба на кръв, когато вампирът пие кръв, след това напитки веднага от половин литър до един и половина литра кръв. Човешкото тяло съдържа само пет или шест литра кръв, така че такава загуба на кръв не е непременно опасна за живота. Въпреки това, вампирът може
От книгата моделиране на бъдещето в съня авторът на Световната ЕленаВъзстановяване след разпространението на института, работещо като инженер в затворена компания, осъзнах, че не съм на мястото си, затова реших да променя професията и да вляза в джаз училище за импровизация, а по-късно в музикалното училище за класическия офис .
От книгата "Златни правила Фенгшуй". 10 прости стъпки към успеха, благосъстоянието и дълголетието Автор Рудин Валентин ЛеонидовичСтепента на отрицателно въздействие на външните обекти Най-голямото отрицателно влияние на външните обекти са били непосредствено преди влизане в къщата. Но колкото повече се намират под ъгъл до входа, толкова по-слаб става тяхното влияние. Целта е директно
от автора Eduard CureПърва степен: готвене. Негорската проповед и царството на Божия случай на Христос започва с Галилея идилия и обявяването на "Божието царство". Тази прогноза ни показва до популярните му инструкции. В същото време това е подготовка за по-повишен
От книгата Божествена еволюция. От Сфинкс към Христос от автора Eduard CureВтора степен на започване (почистване). Чудесно изцеление. Християнската терапия във всички древни мистерии за морална и интелектуална подготовка трябваше да почиства душата, която трябва да съживи новите органи в нея и впоследствие да го даде възможност
От книгата Голяма сфинска загадка Автор Барбарен ЖоржВъзстановяване на статуята Действителната възраст на голям сфинкс се връща в началото на Ерата на Адам. Поне той е съвременна пирамида, ансамбълът, който той, както ще видим, го завърши. Образът на голям сфинкс е бил подложен на изтичане на векове
От книгата за изцеление на душата. 100 медитативни техники, лечебни упражнения и релаксация Автор Ражня Бхагън ШрийВъзстановяване на ритъма ... Инсталирайте същото време, за да си лягате - ако всяка вечер е единадесет, това означава, че единадесет. Това е първото: да получите определено време и скоро тялото ще може да влезе в този ритъм. Не променяйте този път, в противен случай ще изберете тялото. Тяло
от автора Kuzmishin E. L.Степен на студентска рецепция в студентската степен. Декорацията на ложата и домейните и тавана на ложата трябва да се пече синьо и бяло без позлатяване. Над главата на експертния майстор се намира заобиколен от блясък на триъгълник с името в центъра му
От книгата на калиостра и египетската масонство от автора Kuzmishin E. L.Приемане в студентската степен. Декорацията на ложите и домейните и тавана на ложата трябва да се окачат със синьо и бяло вещество без позлатяване. Над главата на експертния майстор се намира заобиколен от блясък на триъгълник с името "Йехова", бродирано в центъра му
От книгата Автобиография Йога Автор Йогананда ПарамаансаГлава 23 Получавам университетска степен - пренебрегвате философските определения от учебника без съмнение отчитането на това, че някаква не-закръглена "интуиция" ще ви държи през всички изпити. Но ако спешно не се консултирате с по-научен метод, тогава ще трябва
От книгата на Кабала. Най-високият свят. Началото на пътя Автор Lightman Michael.7.5. Степента на информираност за злото, както е изяснена в статията "Болус", удоволствие и блаженство се определя от степента на сходство на Създателя според свойствата и страданието и нетърпението - степента на различия от създателя. В съответствие с това егоизмът е отвращение и непоносимо боя,
Опция 1
1. Определете степента на окисление на атомите на химични елементи в следните връзки: HNO₃, NO2, HSN, S02, N20.
2. Възползвайки се от периодичната таблица, поставете следните елементи, за да намалите електрическата активност: O, N, BE, B, Li, C. Определете къде трябва да бъдат разположени флуор и натрий в този ред. Обясни отговора. 
3. Как степента на окисление на серната атом се променя, когато SO1 към SOH? Отговорът обясни отговора.
Вариант 2.
1. Определете степента на окисление на атомите на химични елементи в следните връзки: CO₂, H₃PO₄, SIH₄, P₂O₅, MGSSI.
2. в посоката на атомите, от които химическият елемент се измества от генерал електронни двойки, Молекули на следните връзки: BF₃, PCL₃, CS2, Ccl₄, HBR? Дайте разумен отговор.
3. дали степента на въглеродни окислява се по време на образуването възнакова киселина H2CO₃ въглероден диоксид и вода? Отговорът обясни отговора.
Вариант 3.
1. Определете степента на окисление на атомите на химични елементи в следните връзки: CL₂, NaClo, CaCl2, HF, SO., CL₂O₇.
2. използване периодична система Химични елементи, позиционират следните елементи от порядъка на тяхната електрическагабилност: р, ал, С1, Na, S, mg. Намерете калий и флуор в този ред. Отговорът обясни отговора. 
3. Как се променя степента на въглеродна окисление при изгаряне на метан CH₄ с образуването на въглероден оксид (IV) и вода? Отговорът обясни отговора.
Вариант 4.
1. Определете степента на окисление на атомите на химични елементи в следните връзки: H2SO1, SO2, NO2, BF2, HsS.
2. Към атомите, от които химически елементи Показва общи електронни двойки, в молекулите на следните връзки: H20, PCL₃, H₃n, HsS, CO₂? Дайте разумен отговор.
3. дали степените на окисление на атомите се променят, когато водата се променя от прости вещества - водород и кислород? Отговорът обясни отговора.


