Elektrická energia sa nazýva vlastnosť chemického prvku, aby prilákala elektróny do svojho atómu z atómov iných prvkov, s ktorými tento prvok tvorí chemickú väzbu v spojení.
Keď je chemická väzba vytvorená medzi atómami rôznych prvkov, všeobecný elektronický oblak sa posúva na viac elektrón-negatívny atóm, čo je dôvod, prečo sa pripojenie stáva kovalentným polárnym a s veľkým rozdielom elektronickej emisie.
Elektrická energia sa berie do úvahy pri písaní chemických vzorcov: symbol najviac elektronegatívneho prvku je zaznamenaný v binárnych spojoch.
Elektrická energia sa zvyšuje v smere zľava doprava na prvky každého obdobia a zníženie smeru zhora nadol do dna pre prvky tej istej skupiny PS.
Valencia Prvok sa nazýva vlastnosť jeho atómov, ktoré majú byť pripojené k určitému počtu iných atómov.
Existujú stechiometrické, elektronické valenčné a koordinačné číslo. Zoberme len stechiometrické valence.
Stechiometrický Valencia ukazuje, koľko atómov iného prvku pripisuje atóm tohto prvku. Na jednotku valencie prijala valenciu vodíka, pretože Vodík je vždy monovalentný. Napríklad v HCl, H20, NH3 zlúčeniny (správne písanie amoniak H3N sa už používa v moderných príručkách), CH4 chlór je monovalentný, kyslík bivalentný, trivalentný a uhlík tetravalenten.
Stochiometrické valencie kyslíka sa zvyčajne rovná 2. Pretože takmer všetky prvky tvoria zlúčeniny s kyslíkom, je vhodné použiť ho ako odkaz na určenie valencie iného prvku. Napríklad v zlúčeninách Na20, COO, Fe203, SO3 Monovalentné sodné, kobaltové bivalentné, železo je trivalentné, síry hexavalentný.
V oxidačných a reštaurátorských reakciách bude dôležité, aby sme určili stupne oxidácie prvkov.
Stupeň oxidácie Prvok v látke sa nazýva jeho stechiometrické valencie, zhotovené s podpisom plus alebo mínus.
Chemické prvky sú rozdelené do prvkov trvalé valencie Valenčné variabilné prvky.
1.3.3. Molekulárne a neelastické látky. Typ kryštálovej mriežky. Závislosť vlastností látok z ich zloženia a štruktúry.
V závislosti od toho, ktorý stav zlúčeniny je v prírode, sú rozdelené do molekulárnej a neekulovej. V molekulárne látky Najmenšie konštrukčné častice sú molekuly. Tieto látky majú molekulárnu kryštálovú mriežku. V non-mekulárnych látok sú atómy alebo ióny najmenšie konštrukčné častice. Kryštálová mriežka je atómová, iónová alebo kovová.
Typ kryštálovej mriežky do značnej miery určuje vlastnosti látok. Napríklad kovy s kovový typ kryštálovej mriežkysa líšia od všetkých ostatných prvkov vysoká plasticita, elektrická a tepelná vodivosť. Tieto vlastnosti, ako aj mnoho ďalších - kovanie, kovový lesk atď. Vzhľadom na špeciálny typ komunikácie medzi atómami kovov - kovové pripojenie. Treba poznamenať, že vlastnosti, ktoré sú obsiahnuté kovmi, sa prejavujú len v kondenzovanom stave. Napríklad striebro v plynnom stave nemá fyzikálne vlastnosti kovov.
Špeciálny typ komunikácie v kovoch je kovový - kvôli nedostatku valenčných elektrónov, takže sú spoločné pre celú štruktúru kovu. Najjednoduchší model kovovej konštrukcie predpokladá, že kryštalická mriežka kovov pozostáva z pozitívnych iónov obklopených voľnými elektrónmi, pohyb elektrónov sa vyskytuje chaotické, podobné molekuly plynu. Takýto model však kvalitatívne vysvetľujúci mnohé vlastnosti kovov, s kvantitatívnou kontrolou, sa uvádza, že je nedostatočné. Ďalší rozvoj teórie kovového stavu viedol k vytvoreniu teória zóny kovovktorý je založený na výkonoch kvantovej mechaniky.
V uzloch krištáľovej mriežky sú katióny a atómy kovov a elektróny sa voľne pohybujú pozdĺž kryštálovej mriežky.
Charakteristická mechanická vlastnosť kovov je plastovýVzhľadom na zvláštnosti vnútornej štruktúry svojich kryštálov. Pod plasticitou, schopnosť orgánov pod pôsobením vonkajších síl podstúpiť deformáciu, ktorá zostáva a po ukončení vonkajšieho vplyvu. Táto vlastnosť kovov im umožňuje dať im iný formulár pri rezaní, jazdiť kov na plechy alebo ho vytiahnite do drôtu.
Plasticita kovov je spôsobená tým, že s vonkajšími účinkami vrstiev iónov tvoriacich kryštálovú mriežku, posunuli navzájom bez toho, aby sa porušili. K tomu dochádza v dôsledku skutočnosti, že pohybujúce sa elektróny v dôsledku voľného redistribúcie naďalej komunikujú medzi iónovými vrstvami. V mechanickom účinku na pevnej látke s jadrovou mriežkou sú jeho samostatné vrstvy posunuté a adhézia medzi nimi je rozbitá kvôli roztrhnutiu kovalentné väzby.
iónyPotom tieto látky tvoria iónový typ krištáľovej mriežky.

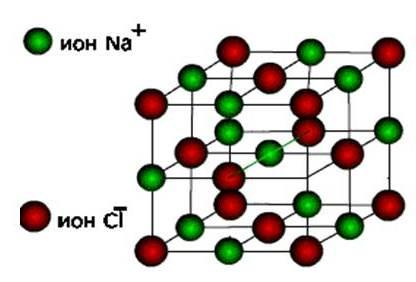
Sú to soli, ako aj oxidy a hydroxidy typických kovov. Jedná sa o pevné, krehké látky, ale ich hlavná kvalita : Riešenia a taveniny týchto zlúčenín vykonávajú elektrický prúd.
Ak sa nachádzajú v uzloch kryštálovej mriežky atómyPotom tieto látky tvoria atómový typ kryštálovej mriežky(Diamond, Bor, kremíkové hliníkové a oxidy kremíka). Podľa vlastností, veľmi pevných a žiaruvzdorných, nerozpustných vo vode.
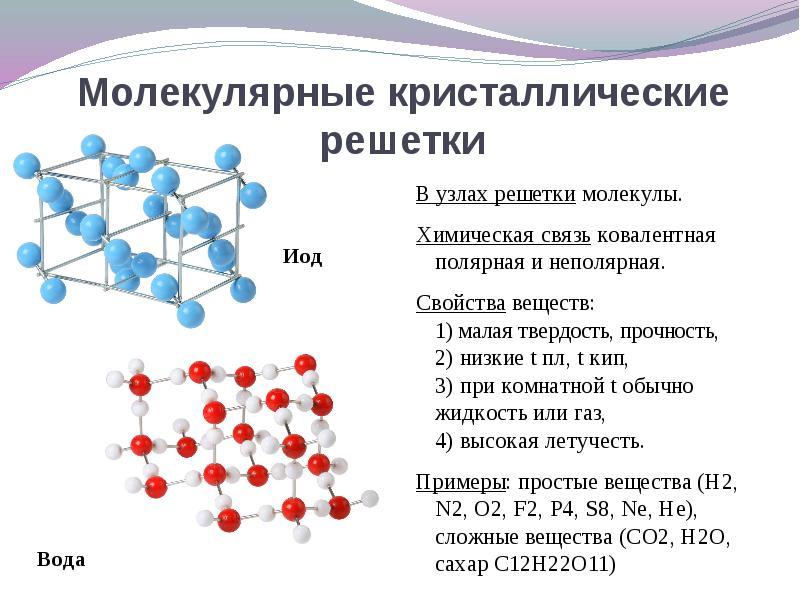
Ak sa nachádzajú v uzloch kryštálovej mriežky molekulyTieto látky tvoria (za normálnych podmienok plynov a kvapalín: 02, HCl; i 2 organické látky).
Je zaujímavé poznamenať, že kov gálium, ktorý sa roztopí pri teplote 30 ° C. Táto anomália je vysvetlená tým, že molekuly GA2 a jeho vlastnosti sú umiestnené v zostáv kryštálovej mriežky, ktoré sú podobné látky molekulárna kryštalická mriežka.
Príklad.Nemolekulárna štruktúra má všetky nekovy skupiny:
1) uhlík, bór, kremík; 2) fluór, bróm, jód;
3) kyslík, síra, dusík; 4) chlór, fosfor, selén.
V non-elastické látky Najmenšie konštrukčné častice sú atómy alebo ióny. Kryštálová mriežka je atómová, iónová alebo kovová
Pre riešenie Táto otázka je ľahšie ísť z opaku. Ak sa nachádzajú v uzloch kryštálovej mriežky molekulyPotom tieto látky tvoria molekulárny typ kryštálovej mriežky(za normálnych podmienok plynov a kvapalín: 02, HCI; tiež I2, kosoštvorcová sulfur S 8, biele fosforu P4, organické látky). Podľa vlastností sú to krehké látky s nízkou teplotou topenia.
V druhej odpovedi existuje fluórovací plyn, v treťom plynovom kyslíku, dusíku, v štvrtom plyne chlóru. Takže tieto látky majú molekulárnu kryštálovú mriežku a molekulárnu štruktúru.
V najprv Odpovedzte na všetky látky - pevné zlúčeniny za normálnych podmienok a tvoria jadrovú mriežku, čo znamená, že existuje neetický.
Správna odpoveď:1) uhlík, bor, silikón
- Najmenej elektronegatívny je chemický prvok.
- železo
- horčík
- vápnik
Pozornosť by sa mala venovať výrazu "najmenej elektronegatívne", t.j. prvok s najväčšími kovovými vlastnosťami. Tento argument odstráni z možných odpovedí AZOT ako non-metall, a prebývať na vápniku, ako najaktívnejší z kovov navrhovaných v tejto úlohe. Odpoveď: 4.
- Najviac polárna chemická väzba v jednej z molekúl
- Cl4.
- St. 4.
Znalosť vzorov zmien zmien únosnosti elektrónov v obdobiach a skupinách periodického systému DI MENDELEEV umožňuje vylúčiť zo zoznamu štvorkolitých zlúčenín uhlíkového metánu CH 4 a zo zostávajúcich halogenidov na zastavenie v CF4, ako na Zlúčenina uhlíka s najviac elektronegatívom všetkých chemických prvkov - fluór. Odpoveď: 2
- V chloridových molekulách a chlorickej chemickej komunikácii
- iónový a kovalentný polárny
- iónový a kovalentný nepolárny
- kovalentný polárny a kovalentný nepolárny
- vodík a kovalentný nepolárny
Kľúčové slovo pre rýchle a správne vykonanie tejto úlohy je slovo "resp.". V navrhovaných verziách začína len jedna z odpovedí slovami "kovalentný polárny", t.j. Dlhopisy charakteristické pre chlorodor. Odpoveď: 3.
- Stupeň oxidácie mangánu v zlúčenine, vzorec, ktorý na 2 ml 4, je rovnaký
Znalosť pravidiel pre výpočet stupňov oxidácie prvkov podľa vzorca vám umožní vybrať správnu odpoveď. Odpoveď: 3.
- Najmenší stupeň oxidácie má síru v soli
- sulfát draslík
- sulfit draslík
- sulfid draslík
- hydrosulfát draselný
Je zrejmé, že rýchle plnenie tejto úlohy bude preložiť názvy solí vo vzorci. Pretože síra je prvok skupiny cez, potom je jeho najmenší stupeň oxidácie -2. Táto hodnota zodpovedá zlúčenine vzorcom K2 S - sulfid draselný. Odpoveď: 3.
- Stupeň oxidácie je +5 atóm chlóru má v ióne
- C1O - 4.
- C1O -
- C1O - 3.
- C1O - 2.
Pri vykonávaní tejto úlohy by ste mali venovať pozornosť tomu, že neexistujú žiadne elektronické zlúčeniny v stave, ale ióny chlóru s jedným záporným nábojom ("-"). Vzhľadom k tomu, súčet stupňov oxidácie atómov v ióne sa rovná náboja iónov, celkový záporný náboj atómov kyslíka v kĺbovom ióne by mal byť -6 (+5 - 6 \u003d -1). Odpoveď: 3.
- Stupeň oxidácie -3 dusíka má v každom z dvoch pripojení
- Nf 3 a NH3
- NH4CI a N 2 O 3
- NH 4 CL a NH3
- HNO 2 a NF3
Ak chcete určiť správnu odpoveď, je potrebné mentálne rozdeliť možnosti odpovedí na ľavé a pravé pípnutie. Potom vyberte ten, v ktorom majú zlúčeniny jednoduchšiu kompozíciu - v našom prípade je to pravá binárna zlúčenina. Analýza odstráni reakcie 2 a 4, ako oxid a fluorid v dusíku pozitívny stupeň oxidácie, ako v menej elektronegatívnom prvku. Tento argument umožňuje vylúčiť a reagovať 1, pretože ide o prvú látku - všetky rovnaké fluorid dusíka. Odpoveď: 3.
- Na látky molekulovej štruktúry nezahŕňajú
- oxid uhličitý
- metán
- chlororod
- uhličitan vápenatý
Mali by ste venovať pozornosť negatívnemu úsudku, ktorý je uvedený v podmienkach zadania. Vzhľadom k tomu, plynné látky za normálnych podmienok majú molekulárnu kryštalickú mriežku v pevnom stave, podmienka priradenia 1-3 nezodpovedá podmienke stavu. Atribúty uhličitanu vápenatého na soli opäť potvrdzuje správnu odpoveď. Odpoveď: 4.
- Sú nasledujúce rozsudky o vlastnostiach látok a ich štruktúry?
A. Mokré spodné prádlo schne mrazu, pretože látky molekulárnej štruktúry sú schopné sublimácie (sublimácia).
B. Mokré spodné prádlo schne mrazu, pretože molekuly vody majú nízku molekulovú hmotnosť.
- tRUE LEN A.
- len B.
- oba sú pravdivé
- obe rozsudky nie sú pravdivé.
Znalosť fyzikálne vlastnosti Látky molekulárnej štruktúry umožňuje rozhodnúť, že príčinou sušenia sušenej bielizne v mrazu je schopnosť ľadu sublimácii, a nie dipólovú štruktúru molekúl vody. Odpoveď: 1.
- Molekulárna štruktúra má každú z látok, ktorej vzory sú uvedené v rade
- CO 2, HNO 3, SAO
- Na 2 S, Br 2, NO 2
- H 2 SO 4, CU, O 3
- SO 2, I 2, NSL
Keďže navrhované možnosti obsahujú tri látky, je logické, aby sa tieto verzie mentálne rozdelili na tri vertikálne pípnutia. Analýza každého z nich, počnúc lámami zjednodušnej kompozície (priemerná Podstolbik), odstráni odpoveď 3, pretože obsahuje kovovú medi, ktorá má kovovú kryštalickú mriežku. Podobná analýza pravého pípnutia umožní eliminovať odpoveď 1, pretože obsahuje oxid kovového kovu (iónový mriežka). Z dvoch zostávajúcich možností je potrebné vylúčiť možnosť 2, pretože obsahuje soli alkalického kovu - sulfid sodný (iónová mriežka). Odpoveď: 4.
Úlohy pre nezávislú prácu
- Stupeň oxidácie je +5 dusík vykazuje v zlúčenine, ktorého vzorec, ktorého vzorec
- N 2 O 5
- N 2 O 4
- N 2 O.
- Stupeň oxidácie chrómu v zlúčenine, vzorec, ktorý (NH4) 2 Cr207, sa rovná
- Stupeň oxidácie dusíka sa znižuje v rade látok, ktorého vzorky
- NH3, NO 2, KNO 3
- N2O4, KNO2, NH4CI
- N2, N 2 O, NH3
- HNO 3, HNO 2, NO 2
- Stupeň oxidácie sa zvyšuje chlóru v mnohých látkach, vzorkách
- NSLO, NSLO 4, KSLO 3
- CL2, C1 2 O 7, KSLO 3
- CA (C1O) 2, KSLO 3, NSLO 4
- KSL, KSLO 3, KSLO
- Najviac polárna chemická komunikácia v molekule
- amoniak
- serovodorod.
- bromomodorod
- fluorodorod
- Látka s kovalentnou nepolárnou väzbou
- biely fosfor
- hliníkový fosfid
- chlorid fosforu (V)
- fosforečnan vápenatý
- Formuly látok len s iónovým väzbou zaznamenaným v rade
- chlorid sodný, chlorid fosforečný (v), fosforečnan sodný
- oxid sodný, hydroxid sodný, peroxid sodný
- seruplerod, karbid vápenatý, oxid vápenatý
- fluorid vápenatý, oxid vápenatý, chlorid vápenatý
- Atómová kryštalická mriežka má
- oxid sodný
- oxid vápenatý
- oxid sírový (IV)
- oxid hlinitý
- Pripojenie s iónovým kryštálová mriežka vytvorené, keď chlór interaguje s
- fosfor
- bárium
- vodík
- šedý
- Sú nasledujúce rozsudky o chloridoch amónneho?
A. Chlorid amónny je iónová štruktúra látka tvorená kovalentnými polárnymi a iónovými väzbami.
B. Chlorid amónny - látka iónovej štruktúry, a teda pevná, žiaruvzdorná a neprchavá.
- tRUE LEN A.
- len B.
- oba sú pravdivé
- obe rozsudky sú nesprávne
08. Elektrická energia, oxidácia, oxidácia a obnova
Poďme diskutovať o zmysle mimoriadne zaujímavých konceptov, ktoré existujú v chémii, a tak často sa deje vo vede, dostatočne mätúce a používané v obrátenej forme. Bude to o "elektronegativity", "stupeň oxidácie" a "redox reakcií".
Čo to znamená - koncepcia sa používa v obrátenej forme?
Pokúsime sa o tom postupne povedať.
Elektrina Ukážte nám redox vlastnosti chemického prvku. To znamená, že jeho schopnosť vziať si alebo dať voľné fotóny. A je to aj zdroj alebo absorbér energie (éter). Yang alebo yin.
Stupeň oxidácie - Toto je koncept podobný koncepte "elektronegativity". Taktiež charakterizuje redox vlastnosti prvku. Ale medzi nimi je ďalší rozdiel.
Elektrická energia poskytuje charakteristiku samostatného prvku. Sám, z toho, že ho nájde v chemickej zlúčenine. Zatiaľ čo stupeň oxidácie charakterizuje svoje oxidačné a regeneratívne schopnosti presne, keď je prvok súčasťou akejkoľvek molekuly.
Povedzme trochu o tom, čo je schopnosť oxidovať, a čo je schopnosť obnoviť.
Oxidácia - Toto je proces prevodu na iný prvok voľných fotónov (elektrónov). Oxidácia nie je vylúčená vôbec elektrónov, ako sa teraz považuje za vo vede. . Keď prvok oxiduje ďalší prvok, pôsobí ako kyselina alebo kyslík (teda názov "oxidácia"). Oxidačné - to znamená podporovať deštrukciu, rozpadu, horiace prvky . Schopnosť oxidovať je schopnosť spôsobiť zničenie molekúl energiou prenášaným nimi (voľné fotóny). Pamätajte, že energia vždy ničí látku.
Prekvapivo, ako dlho vo vede existujú protirečenia v logike, nie je viditeľné nikomu.
Tu, napríklad: "Teraz vieme, že oxidačným činidlom je látka, ktorá získava elektróny, a redukčné činidlo je látkou, ktorá im dáva" (encyklopédia mladého chemika, článku "oxidácia a reakcia)".
A okamžite, dva body nižšie: "Najsilnejší oxidač je elektrický prúd (prúd negatívne nabitých elektrónov)" (ibid.).
Tí. prvá citácia uvádza, že oxidačným činidlom je, aké elektróny trvá, a v druhom okysličovadlom, čo dáva.
A podobné chybné závery, ktoré sa navzájom odporujú, sú nútení zapamätať si v školách a inštitúciách!
Je známe, že najlepšie oxidanty sú nekovové. Okrem toho, že menšie číslo obdobia a viac skupinového čísla, tým silnejšie sú vyjadrené vlastnosti oxidačného činidla. To nie je prekvapujúce. Dôvody pre to v článku venované analýze periodického systému, v druhej časti, kde hovorili o farbe nukleónov. Z prvej skupiny do 8 sa farba nukleónov v prvkach postupne mení z fialovej na červenú (ak uvažujete o modrej farbe D- a F-Elements). Kombinácia žltých a červených častíc uľahčuje návrat kumulovaných voľných fotónov. Žltá hromadí, ale zadržať slabo. A červená prispieva k návratu. Dajte fotóny - toto je proces oxidácie. Ale keď sú niektoré červené, potom nie sú žiadne častice, ktoré môžu hromadiť fotóny. Preto prvky 8 skupín, šľachtických plynov, nie oxidačných činidiel, na rozdiel od ich susedov, halogén.
Reštaurovanie - Toto je proces oproti oxidácii. Teraz, vo vede, je veril, že keď chemický prvok prijíma elektróny, obnoví sa. Tento názor je celkom možné pochopiť (ale nie prijať). Pri štúdiu štruktúry chemických prvkov sa zistilo, že emitujú elektróny. Dospelo k záveru, že elektróny sú súčasťou prvkov. To znamená, že prenos elektrónov elementu je, druh, obnovenie jeho stratenej štruktúry.
V skutočnosti je však všetko nesprávne.
Elektrony sú voľné fotóny. Nie sú to nukleóny. Nie sú súčasťou tela prvku. Sú priťahovaní vstupom vonku a hromadia na povrchu nukleónov a medzi nimi. Ich akumulácia však nie je vôbec obnoviť štruktúru prvku alebo molekuly. Naproti tomu tieto fotóny emitované éterom (energia) oslabujú a zničili prepojenia medzi prvkami. A toto je proces oxidácie, ale nie zotavenie.
Obnovte molekulu, v skutočnosti, - vezmite energiu z nej (v tomto prípade, bezplatné fotóny) a nie hlásiť. Výber fotónov, regenerátor prvok kompaktuje látku - obnovuje.
Najlepšie redukčné činidlá sú kovy. Táto nehnuteľnosť prirodzene vyplýva z ich kvalitatívnych a kvantitatívnych zložení - ich oblasti príťažlivosti je najväčší a na povrchu nevyhnutne existuje mnoho alebo dostatok častíc. modrej farby.
Môžete dokonca vybrať nasledujúce určenie kovov.
Kovový - Toto je chemický prvok, v zložení povrchových vrstiev, ktorých sú nevyhnutne modré častice.
ALE nekovový - Toto je prvok, v zložení povrchových vrstiev, ktorého nie sú žiadne alebo takmer žiadne fotóny modrej a nevyhnutne sú červené.
Kovy s ich silnou atrakciou dokonale vezmite elektróny. A preto sú redukčné činidlá.
Uvádzame definíciu pojmov "elektronická hmotnosť", "stupeň oxidácie", "Redox Reakcie", ktoré možno nájsť v učebniciach v chémii.
« Stupeň oxidácie - podmienečný náboj atóm v zlúčenine vypočítaný na základe predpokladu, že sa skladá len z iónov. Pri určovaní tohto konceptu sa konvenčne predpokladá, že elektróny spojiva (valencia) idú na viac elektronegatívnych atómov, a preto zlúčeniny pozostávajú z pozitívnych a negatívne nabitých iónov. Stupeň oxidácie môže mať nulové, negatívne a kladné hodnoty, ktoré sú zvyčajne nastavené na symbol prvku zhora.
Nulová hodnota stupňa oxidácie sa pripisuje atómom prvkov v voľnom stave ... Záporná hodnota stupňa oxidácie má tieto atómy, na ktoré sa posunie spojivového elektrónového mraku (elektrónový pár). Fluór vo všetkých jej pripojeniach je rovný -1. Pozitívny stupeň oxidácie má atómy, ktoré dávajú valenčné elektróny na iné atómy. Napríklad alkalické a alkalické zemné kovy, je to +1 a +2. V bežných iónoch sa rovná náboja iónu. Vo väčšine zlúčenín je stupeň oxidácie atómov vodíka + 1, ale v hydridoch kovov (zlúčeniny s vodíkom) a iné - je rovná -1. V prípade kyslíka je charakteristický stupeň oxidácie -2, ale napríklad v zlúčenine s fluórom bude +2, a v peroxidácii -1. ...
Algebraický súčet oxidácie atómov v zlúčenine je nula a v komplexnom ióne - náboj iónov. ...
Najvyšší stupeň oxidácie je najväčšou pozitívnou hodnotou. Pre väčšinu prvkov sa rovná číslom skupiny v periodickom systéme a je dôležitou kvantitatívnou vlastnosťou prvku vo svojich pripojeniach. Najmenšia hodnota stupňa oxidácie prvku, ktorá sa vyskytuje vo svojich zlúčeninách, je zvyčajná, že sa nazýva nižší stupeň oxidácie; Všetky ostatné - medziprodukt "(encyklopédový slovník mladého chemika, článku" Stupeň oxidácie ").
Tu sú základné informácie týkajúce sa tohto konceptu. Sú úzko súvisí s iným termínom - "elektrina".
« Elektrina - Toto je schopnosť atómu v molekule prilákať elektróny zapojené do tvorby chemickej väzby "(encyklopédový slovník mládežníckeho chemika, článok" elektrina ").
"Redox reakcie sú sprevádzané zmenou stupňa oxidácie atómov, ktoré sú súčasťou reakčných látok, v dôsledku pohyblivých elektrónov z atómu jedného z činidiel (redukčné činidlo) k druhému atómu. S oxidačnými a redukčnými reakciami, oxidácia (return elektrónov) a regenerácia (elektronika) sa vyskytujú (ekologický encyklopédový slovník) (chemický encyklopédový slovník ed. I.l. Knunyantz, článok "Redox Reakcia").
Podľa nášho názoru existuje v týchto troch konceptoch pomerne niekoľko chýb.
Najprv , Veríme, že tvorba chemického spojenia medzi týmito dvoma prvkami nie je vôbec proces socializácie ich elektrónov. Chemická väzba je gravitačné spojenie. Elektrony, údajne lietajúce po jadre, sú bezplatné fotóny akumulujúce na povrchu nukleónov v tele prvku a medzi nimi. Aby bolo možné medzi dvoma prvkami, spojenie vzniklo, ich voľné fotóny nemusia behať medzi prvkami. To sa nestane. V skutočnosti, Ťažší prvok vzlietne (priťahuje) voľné fotóny s ľahšími a zanechávajú ich (presnejšie, na seba). A zóna ľahšieho prvku, s ktorou boli tieto fotóny odstránené, na jeden alebo iný. Vzhľadom k tomu, ktorá atrakcia v tejto zóne sa prejavuje vo väčšej miere. A ľahší prvok je priťahovaný k silne. Takže chemická väzba vzniká.
Po druhé Moderná chémia vidí schopnosť prvkov prilákať elektróny skreslené - obrátené. Predpokladá sa, že čím väčšia je elektronegativita prvku, tým viac je schopný prilákať elektróny sám. A fluór s kyslíkom údajne robí to najlepšie - priťahujú ostatné elektróny. Rovnako ako iné prvky 6 a 7 skupín.
V skutočnosti toto stanovisko nie je viac ako ilúzia. Je založený na chybnom pohľade, akoby viac skupinového čísla, tvrdšie položky. A tiež čím väčší je pozitívny náboj jadra. Toto je kecy. Vedci sa ani neruší, že z ich pohľadu je "poplatok". Jednoducho, ako v numerológii, prepočítali všetky prvky v poriadku a boli podpísané v súlade s počtom hodnôt účtu. Veľká túra!
Toto je jasné a dieťa, že plyn je ľahší ako hustý kov. Ako sa to stalo, že v chémii sa domnieva, že plyny sú lepšie priťahujúce elektróny?
Husté kovy, samozrejme, sú lepšie priťahovať elektróny.
Vedci-chemikov, samozrejme, môžu ponechať koncepciu "elektronegance" v kurze, pretože je to tak bežné. Budú však musieť zmeniť svoj význam na opačnú priamu.
Elektrina - Toto je schopnosť chemického prvku v molekule prilákať elektróny. A samozrejme, pri kovoch, táto schopnosť je lepšie vyjadrená ako nekovové.
Čo sa týka elektrických pólov v molekule, potom, negatívny pól - Toto sú nekovové prvky, ktoré dávajú elektróny s menšími oblasťami atrakcie. ALE pozitívny - Vždy je to prvky s výraznejšími kovovými vlastnosťami, s veľkými oblasťami atrakcie.
Sa usmievajú.
Elektrina - Toto je ďalší, ďalší pokus o opis kvality chemického prvku spolu s už existujúcim vážením a náplňou. Keď sa často stáva, vedci z inej oblasti vedy, v tomto prípade, chémia, as, ak nie sú dôverovať svojimi kolegami pre fyzikov, ale skôr jednoducho preto, že každá osoba, takže objavy, je vlastnou cestou, a nie len skúmajú skúsenosti iných.
Tak sa to stalo.
Hmotnosť a nabíjanie nepomohlo žiadnych chemikov, aby pochopili, čo sa deje v atómoch, keď sa navzájom interagovali, a elektronaget bol zavedený - schopnosť prvku prilákať elektróny podieľajúce sa na tvorbe chemickej väzby. Treba si uvedomiť, že myšlienka tohto konceptu je položená veľmi pravdivá. S jediným pozmeňujúcim a doplňujúcim návrhom, ktorý odráža realitu v obrátenej forme. Ako sme povedali, je najlepšie prilákať kovové elektróny, namiesto nekovových kovov - na základe vlastností farby povrchových jadier. Kovy sú najlepšie redukčné činidlá. Nekovy - oxidačné činidlá. Kovy sa odoberajú, neovplyvnenia. Kovy - Yin, Nemmetalla - Yang.
Esoteric prichádza na pomoc vedy vo veciach pochopenia tajomstva prírody.
Týkajúci sa oxidácia To je dobrý pokus pochopiť, ako sa distribúcia voľných elektrónov vyskytuje v chemickej zlúčenine - molekuly.
Ak je chemická zlúčenina rovnomerne - to znamená, že je to jednoduchá, jej štruktúra sa skladá z prvkov rovnakého typu - potom je všetko pravdivé, naozaj stupeň oxidácie akéhokoľvek prvku v zlúčenine je nula. Keďže v tejto súvislosti neexistujú žiadne oxidanty a žiadne reboters. A všetky prvky sú rovnaké. Nikto berie elektróny, nikto nedáva. Či už ide o hustú látku alebo tekutú, alebo plyn - bez ohľadu na to.
Stupeň oxidácie, ako aj elektronegativity, demonštruje kvalitu chemického prvku - len v rámci chemického prvku. Stupeň oxidácie je navrhnutý tak, aby porovnával kvalitu chemických prvkov v zlúčenine. Podľa nášho názoru je myšlienka dobrá, ale jej implementácia nie je celkom uspokojujúca.
Sme kategoricky proti celej teórii a koncepcii štruktúry chemických prvkov a spojenia medzi nimi. No, ak by mal byť len preto, že počet skupín podľa našich myšlienok by mal byť viac ako 8. A preto sa celý systém zrúti. Áno, a nie len to. Všeobecne platí, že prepočítajte počet elektrónov v atómoch "prstov" nie je nejako vážne.
V súlade s aktuálnou koncepciou sa ukázalo, že najsilnejší oxidátory sú priradené najmenšie podmienečné návyky - fluór má náboj -1 vo všetkých zlúčeninách, kyslík takmer všade -2. A vo veľmi aktívnych kovoch - alkalických a alkalických zemín - tieto náboje, +1 a +2. Koniec koncov, nie je úplne logické. Aj keď sa opakujeme, veľmi dobre rozumieme všeobecnej schéme, v súlade s ktorými bola vykonaná - všetko v záujme 8 skupín v tabuľke a 8 elektrónov na úrovni vonkajšej energie.
Avšak, minimálna veľkosť týchto poplatkov v halogénom a kyslíku mala byť najväčšia s mínusovým znakom. A alkalické a alkalické zemské kovy sú tiež veľké, len s podpisom plus.
V hocijakom chemická zlúčenina Existujú prvky, ktoré dávajú elektróny - oxidačné činidlá, nekovové, negatívne návyky a prvky, ktoré berú elektróny - redukčné činidlá, kovy, pozitívny náboj. To je presne tak, ako porovnávať prvky, ich navzájom sa vzťahujú a skúste určiť ich stupeň oxidácie.
Avšak, aby som zistil, že stupeň oxidácie, podľa nášho názoru, nie je úplne presne odráža realita. Bolo by vhodnejšie porovnať elektronibilitu prvkov v molekule. Koniec koncov, elektronegativita je takmer rovnaká ako stupeň oxidácie (charakterizuje kvalitu, len samostatný prvok).
Môžete si vziať meradlo elektriny a dať ho do vzorca pre každý prvok. A potom sa bude okamžite vidieť, ktoré prvky majú elektróny, a ktoré sa užívajú. Tento prvok, ktorého elektrónogativita v zlúčenine je najvyššia - negatívna pól, poskytuje elektróny. A ten, ktorých elektronika je najmenší - pozitívny pól, berie elektróny.
Ak položky, priznanie, 3 alebo 4 v molekule, nič sa nezmení. Všetky tiež dali veľkosť elektronickej pomoci a porovnávať.
Hoci by sa nemalo zabudnúť na čerpanie modelu štruktúry molekuly. V skutočnosti, v akejkoľvek zlúčenine, ak nie je jednoduché, to znamená, že nie je pozostáva z jedného typu prvkov, sú navzájom spojené, predovšetkým kovy a nekovové kovy. Kovy zvoľte elektróny v nekovových kovoch a viažu sa na ne. A v jednom prvku nekovových, elektrónov 2 je možné zvoliť súčasne alebo väčší počet prvkov s výraznejšími kovovými vlastnosťami. Takže komplex, komplexná molekula dochádza. To však neznamená, že v takejto molekule sa kovové prvky dostanú v pevnom spojení a navzájom. Možno sa nachádzajú na opačných stranách od seba. Ak je v blízkosti - priťahujú. Tuhé spojenie je však vytvorené len vtedy, ak je jeden prvok viac kovový ako druhý. Uistite sa, že jeden prvok vyberte elektróny - odstránené. V opačnom prípade sa prvok nestane - výnimka z voľných fotónov na povrchu. Pole ATTRACTION sa nevenuje dobre a nebudú odolné spojenie. na to komplexná téma - vzdelávanie chemické väzbyA o tom nepovedieme v tomto článku.
Veríme, veľmi osvetlené tému venovanú analýze koncepcií "elektronickej hmotnosti", "oxidácia", "oxidácie" a "reštaurovanie" a poskytli vašu pozornosť veľa zvedavých informácií.
Z knihy spravovaných snov Autor sveta ElenaReštaurovanie "Keď sa narodí jednotné znamenie indiozeam, podstata a životnosť je rozdelená do dvoch. Z tohto bodu, ak konečný svet nedosiahne, podstata a život sa už nikdy neuvidia. " William, "tajomstvo zlatého kvetu" po inštitúte
Z knihy Kniha tajomstiev. Neuveriteľné zrejmé na Zemi av zahraničí Autor Vyatkin Arkady DmitrievichMasochizmus ako extrémny stupeň dobrovoľného upírstva v tomto zmyslovom masochizme je podobný telekomunikácii. Mazochisti sú ľudia, ktorí dostávajú príjemné pocity z vlastného fyzického a duševného utrpenia. Inými slovami, tak sa to páči, keď porazia, nadobudnú, falošnú
Z knihy upírov v Rusku. Všetko, čo o nich potrebujete vedieť! Autor Bauer AlexanderAko určiť stupeň straty krvi, keď upír pije krv, potom nápoje naraz od pol litra na jeden a pol litre krvi. Ľudské telo obsahuje len päť alebo šesť litrov krvi, takže takáto strata krvi nie je nevyhnutne nebezpečná pre život. Avšak, upír môže
Z knihy modelovania budúcnosti vo sne Autor sveta ElenaReštaurovanie po distribúcii ústavu, práca ako inžinier v uzavretej spoločnosti som si uvedomil, že som nebol na mojom mieste, takže som sa rozhodol zmeniť povolanie a vstúpil do jazzovej školy improvizácie, a neskôr v hudobnej škole pre klasickú kanceláriu .
Zo knihy Zlaté pravidlá Fengshui. 10 jednoduchých krokov k úspechu, blahobyt a dlhovekosť Autor Rudin Valentin LeonidovichStupeň negatívneho vplyvu externých objektov Najväčší negatívny vplyv externých objektov majú bezprostredne pred vstupom do domu. Čím viac sa nachádzajú v uhle k vchodu, slabšie sa stáva ich vplyvom. Objekt je priamo
autorom Eduard CurePrvý stupeň: Varenie. Kázňa NAGORNY A KRÁTNOSTI KRÁTNEHO KRÁZU KRÁZKU začína Galilee Idyll a oznámením "Božieho kráľovstva". Táto predpoveď nás označuje na svoje populárne pokyny. Zároveň je to prípravok na zvýšenej úrovni
Z knihy božskej evolúcie. Od Sphinx do Krista autorom Eduard CureDruhý stupeň iniciácie (čistenie). Nádherné hojenie. Kresťanská terapia vo všetkých dávnych tajomstvách za morálnu a intelektuálnu prípravu by mala čistiť dušu, ktorá by mala v ňom oživiť nové orgány a následne ho dávať
Z knihy Big Sfinx Riddle Autor Barbaren GeorgesReštaurovanie sochy Skutočný vek veľkého sphinxu sa vracia do začiatku Adamovej éry. Aspoň on je súčasná pyramída, z ktorých je súbor, ktorý uvidíme, dokončil ho. Obraz veľkého sphynxu bol podrobený storočiam uplynutých
Z knihy hojenia duše. 100 meditatívnych techník, liečivých cvičení a relaxácie Autor Rajnisko Bhagwan SriReštaurovanie rytmu ... Nainštalujte rovnaký čas ísť do postele - ak je každý večer jedenásť, to znamená, že jedenásť. Toto je prvé: Získajte určitý čas, a čoskoro telo bude môcť vstúpiť do tohto rytmu. Nemeníte tento čas, inak si vyberiete telo. Telo
Autorom Kuzmishin E. L.Stupeň recepcie študenta do študenta. Dekorácie Lodge a domény a stropom chaty by mali byť pečené modré a biele záležitosť bez pozlátenia. Nad hlavou expertného majstra sa nachádza obklopený leskom trojuholníka s menom v jeho centre
Z knihy Caliosostro a egyptskej slobodomurárstva Autorom Kuzmishin E. L.Recepcia v študenta. Výzdoba chát a domén a stropom chaty by mali byť zavesené s modrou a blovou záležitosťou bez pozlátenia. Nad hlavou expertného majstra sa nachádza obklopený leskom trojuholníka s názvom "Jehovah", vyšívaný v jeho centre
Z knihy autobiografia jóga Autor Yogananda paramyansaKapitola 23 Dostávam vysokoškolský titul - Ignorujete filozofické definície z učebnice nepochybne počítaním na tom, že niektoré nezabezpečené "intuícia" vás bude držať prostredníctvom všetkých skúšok. Ale ak ste naliehavo neoznačili vedeckú metódu, potom budem musieť
Z knihy Kabbalah. Najvyšší svet. Začiatok cesty Autor Lightman Michael.7.5. Stupeň informovanosti o zla, ako sa objasnil v článku "Trusting", potešenie a blaženosti sú určené stupňom podobnosti Stvoriteľa podľa vlastností, a utrpenie a netrpezlivosť - stupeň rozdielov od Stvoriteľa. V súlade s tým je egoizmus nechutný pre nás a neznesiteľne farbu,
možnosť 1
1. Určite stupeň oxidácie atómov chemických prvkov v nasledujúcich pripojeniach: HNO, NO2, H₃N, S02, N '.
2. Využitie periodickej tabuľky umiestnite nasledujúce prvky, aby sa znížila elektronegativita: O, N, BE, B, Li, C. Určiť, kde by sa v tomto riadku nachádza fluór a sodík. Vysvetlite odpoveď. 
3. Ako sa stupeň oxidácie atómu síry zmení, keď SO2 na SO₃? Odpovedať Vysvetlite odpoveď.
Možnosť 2.
1. Určite stupeň oxidácie atómov chemických prvkov v nasledujúcich pripojeniach: CO₂, H₃PO₄, SIH₄, P0NO, MG2SI.
2. V smere atómov, ktorých chemický prvok sa posunujú všeobecným elektronické páry, Molekuly nasledujúcich pripojení: BF₃, PCL₃, CS2, CCL₄, HBR? Poskytnúť primeranú odpoveď.
3. či sa miera oxidácie uhlíka počas tvorby kyselina koalická HscO3 oxid uhličitý a voda? Odpovedať Vysvetlite odpoveď.
Možnosť 3.
1. Určite stupeň oxidácie atómov chemických prvkov v nasledujúcich pripojeniach: Cl₂, NACLO, CAKL₂, HF, SO, CL20NO.
2. Použitie periodický systém Chemické prvky, umiestnite nasledujúce prvky v poradí zvyšovania ich elektronibility: p, al, Cl, na, s, s, mg. Nájdite draslík a fluór v tomto rade. Odpovedať Vysvetlite odpoveď. 
3. Ako sa miera oxidácie uhlíka zmení pri spaľovaní metánu chit s tvorbou oxidu uhličitého (IV) a vody? Odpovedať Vysvetlite odpoveď.
Možnosť 4.
1. Určite stupeň oxidácie atómov chemických prvkov v nasledujúcich pripojeniach: H2S04, S02, N02, BF₃, H2S.
2. Smerom k atómom chemické prvky Zobrazuje všeobecné elektronické páry, v molekulách nasledujúcich pripojení: H20, PCL₃, H₃N, H₂S, CO2? Poskytnúť primeranú odpoveď.
3. Či sa zmenili stupňa oxidácie atómov, keď sa voda zmení jednoduché látky - vodík a kyslík? Odpovedať Vysvetlite odpoveď.


