חשמל נקרא רכושו של האלמנט הכימי כדי למשוך את האלקטרונים לאטום שלה מאטומים של אלמנטים אחרים שבהם אלמנט זה יוצר קשר כימי בקשרים.
כאשר הקשר הכימי נוצר בין אטומים של אלמנטים שונים, ענן אלקטרוני כללי משמרת אטום אלקטרון-שלילי יותר, ולכן הקשר הופך לקוטבית קוטבית, ובהבדל גדול של אלקטרונית - יון.
חשמל נלקח בחשבון בעת \u200b\u200bכתיבת נוסחאות כימיות: סמל האלמנט electronegative ביותר נרשם בקשרים בינאריים.
חשמל עולה בכיוון משמאל לימין לאלמנטים של כל תקופה ופוחתת בכיוון מלמעלה למטה עבור אלמנטים של קבוצת PS זהה.
תעריפים האלמנט נקרא רכוש אטומים שלה להיות מחובר למספר מסוים של אטומים אחרים.
ישנם stoichiometric, ערכיות אלקטרונית מספר תיאום. אנו נשקול רק Valence stoichiometric.
Stoichiometric Valence מראה כמה אטומים של אלמנט אחר מייחס אטום של אלמנט זה. ליחידה של valence אימצה ערכו של מימן, כי מימן הוא תמיד monovalent. לדוגמה, ב HCL, H 2 O, NH 3 תרכובות (כתיבה נכונה של אמוניה H 3 N כבר בשימוש במדריכים מודרניים), CH 4 כלור הוא monovalent, חמצן bivalent, חנקן trivalent ו פחמן tetravalenten.
Valence stoichiometric של חמצן הוא בדרך כלל שווה 2. מאז כמעט כל אלמנטים צורה תרכובות עם חמצן, זה נוח להשתמש בו כהתייחסות כדי לקבוע את הערכיות של אלמנט אחר. לדוגמה, ב תרכובות NA 2 O, COO, FE 2 O 3, כך 3 סודיום מונוולנט, קובלט Bivalent, ברזל הוא trivalent, גופרית hexavalent.
בתגובות חמצוניות ושקירות, זה יהיה חשוב לנו לקבוע את דרגות האלמנטים חמצון.
מידה של חמצון האלמנט בחומר נקרא Valence stoichiometric שלה, נלקח עם סימן פלוס או מינוס.
אלמנטים כימיים מחולקים אלמנטים valence קבוע אלמנטים משתנים valence.
1.3.3. חומרים מולקולריים ולא אלסטיים. סוג של סריג קריסטל. התלות של המאפיינים של חומרים מהרכבם ומבנהם.
תלוי באיזה מצב של המתחם הוא בטבע, הם מחולקים מולקולרית ולא כביסה. ב חומרים מולקולריים החלקיקים המבניים הקטנים ביותר הם מולקולות. חומרים אלה יש סריג קריסטל מולקולרי. בחומרים שאינם מאלקולריים, אטומים או יונים הם החלקיקים המבניים הקטנים ביותר. סריג קריסטל הוא אטומי, יון או מתכת.
סוג של סריגי קריסטל קובע במידה רבה את המאפיינים של חומרים. לדוגמה, מתכות שיש סוג מתכת של סריג קריסטלשונים מכל האלמנטים האחרים פלסטיות גבוהה, מוליכות חשמלית תרמית. נכסים אלה, כמו גם רבים אחרים - חישול, מבריק מתכת, וכו ' בשל סוג מיוחד של תקשורת בין אטומי מתכת - חיבור מתכת. יש לציין כי הנכסים הטמונים במתכות מתבטאים רק במצב מרוכז. לדוגמה, כסף במצב גזי אין תכונות פיזיות של מתכות.
סוג מיוחד של תקשורת במתכות הוא מתכתי - בשל מחסור של אלקטרונים Valence, ולכן הם נפוצים כל המבנה של המתכת. המודל הפשוט ביותר של מבנה המתכת הניח כי הסריג הגבישי של מתכות מורכב יונים חיוביים מוקפים אלקטרונים בחינם, תנועת האלקטרונים מתרחשת כאוטי, כמו מולקולות גז. עם זאת, מודל כזה, סביר איכותי מאפיינים רבים של מתכות, עם בדיקה כמותית מתברר להיות מספיק. פיתוח נוסף של התיאוריה של מדינת המתכת הובילה ליצירה תיאוריית אזור המתכותאשר מבוסס על ההופעות של מכניקת הקוונטים.
בצמתים של סריגי הקריסטל יש קטיונים ואטומי מתכת, והאלקטרונים נעו בחופשיות לאורך הסריג הקריסטל.
המאפיין המכני האופייני של מתכות פלסטיקבשל המוזרויות של המבנה הפנימי של הגבישים שלהם. תחת הפלסטיות, יכולתם של גופים לפי פעולה של כוחות חיצוניים לעבור דפורפורמציה, שנותרה ואחרי הפסקת ההשפעה החיצונית. נכס זה של מתכות מאפשר להם לתת להם צורה אחרת בעת חיתוך, לרכוב מתכת לתוך סדינים או למשוך אותו לתוך חוט.
הפלסטיות של מתכות היא בשל העובדה כי עם ההשפעות החיצוניות של שכבות של יונים להרכיב את הסריג קריסטל, זז יחסית זה לזה בלי לשבור. זה קורה כתוצאה מכך כי העברת אלקטרונים בשל חלוקה חופשית ממשיכה לתקשר בין שכבות יון. באפקט המכני על מוצק עם גריל גרעיני, שכבותיו הנפרדות מועברות והדבקה ביניהם נשבר בשל הקרע קשרים קוולנטיים.
יוניםואז אלה טופס חומרים יון סוג של סריג קריסטל.

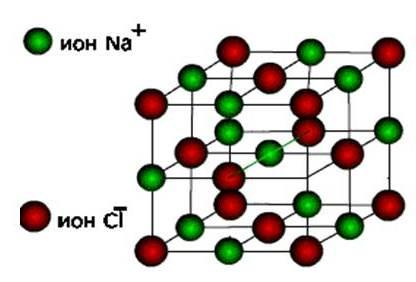
אלה מלחים, כמו גם תחמוצות hydroxides של מתכות אופייניות. אלה הם חומרים מוצקים, שבירים, אבל האיכות העיקרית שלהם : פתרונות נמס של תרכובות אלה לנהל זרם חשמלי.
אם בצמתים של הסריג קריסטל ממוקמים אטומיםואז אלה טופס חומרים סוג אטומי של סריג קריסטל(יהלום, בור, אלומיניום סיליקון תחמוצות סיליקון). לדברי הנכסים, מוצק מאוד עקשן, מסיס במים.
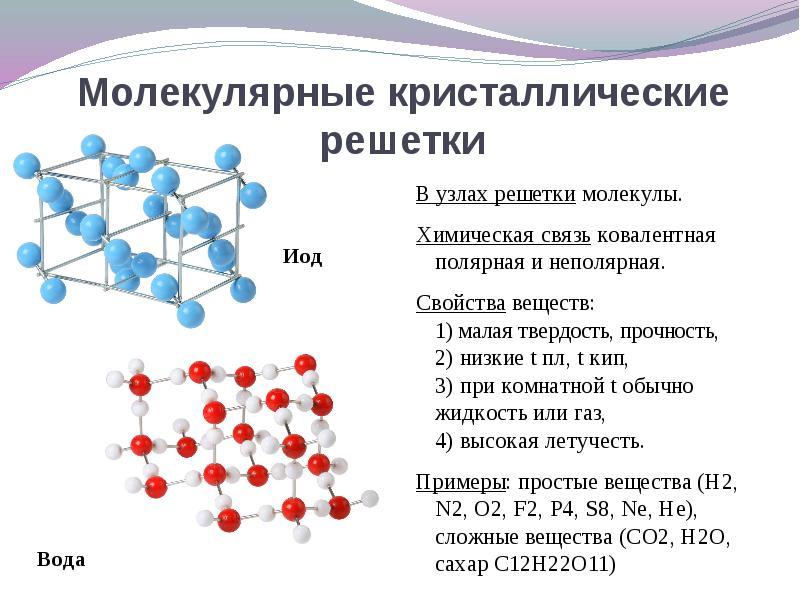
אם בצמתים של הסריג קריסטל ממוקמים מולקולותחומרים אלה טופס (בתנאים רגילים של גזים ונוזלים: O 2, HCl, אני 2 חומרים אורגניים).
מעניין לציין את המתכת של gallium, אשר נמס בטמפרטורה של 30 o ג 'אנומליה זה מוסבר על ידי העובדה כי GA 2 מולקולות המאפיינים שלה ממוקמים באסיפות של סריגי קריסטל שבו הוא הופך להיות דומה לחומרים לאחר סורג גבישי מולקולרי.
דוגמא.מבנה nemolecular יש את כל הלא מתכות של קבוצה:
1) פחמן, בורון, סיליקון; 2) פלואור, ברום, יוד;
3) חמצן, גופרית, חנקן; 4) כלור, זרחן, סלניום.
ב חומרים לא אלסטיים החלקיקים הקטנים ביותר הם אטומים או יונים. סריג קריסטל הוא אטומי, יונית או מתכת
ל פִּתָרוֹן שאלה זו קלה יותר לצאת מההיפך. אם בצמתים של הסריג קריסטל ממוקמים מולקולותואז אלה טופס חומרים סוג מולקולרית של סריג קריסטל(בתנאים רגילים של גזים ונוזלים: O 2, HCl, גם אני 2, סופרת גופרית S 8, זרחן לבן P 4, חומרים אורגניים). לפי נכסים, אלה הם תרכובות נמוכות שבריריות.
בתשובה השנייה יש גז פלואור, בחמצן השלישי - גזים, חנקן, בגז הרביעי - כלור. אז חומרים אלה יש סריג קריסטל מולקולרי ומבנה מולקולרי.
ב ראשון לענות על כל החומרים - תרכובות מוצקות בתנאים רגילים וליצור גריל גרעיני, כלומר, יש אי-מוסר.
תשובה נכונה:1) פחמן, בור, סיליקון
- הפחות electrongative הוא האלמנט הכימי.
- בַּרזֶל
- מגנזיום
- סִידָן
יש לשים לב לביטוי "לפחות electrongative", כלומר את האלמנט עם תכונות המתכת הגדולות. טיעון זה יחסל מתגובות AZOT אפשריים כאלי- metall, וכדי להתעכב על סידן, כמו הפעילים ביותר של המתכות המוצעות במשימה. תשובה: 4.
- הקשר הכימי הקוטבית ביותר באחד המולקולות
- Cl 4.
- רחוב 4.
הידע של דפוסי השינויים במונטיות אלקטרונים בתקופות ובקבוצות של מערכת תקופתית די מנד'לו (DI Mendeleev) מאפשרים לא לכלול מרשימת תרכובותיו של פחמן מתאן 4, ומהצטיינות הנותרים לעצור ב- CF 4, כמו ב תרכובת של פחמן עם electrongative ביותר של כל האלמנטים הכימיים - פלואורין. תשובה: 2.
- במולקולות כלוריד ותקשורת כימית כלור, בהתאמה
- יונית וקוטב קוולנטי
- ionic ו קוולנטית לא פולאר
- קוולנט קוטב וקוטב קוולנטי
- מימן וקוטב קוולנטי
מילת המפתח עבור ביצוע מהיר ונכון של משימה זו היא המילה "בהתאמה". בגרסאות המוצעות, רק אחת מהתשובות מתחילה במילים "קוטב קוולנטי", כלומר האגרות האופייניות לכלורוד. תשובה: 3.
- מידת החמצון של מנגן במתחם, נוסחה של אשר ל 2 MNO 4, שווה
הידע של הכללים לחישוב דרגות החמצון של אלמנטים על ידי הנוסחה יאפשר לך לבחור את התשובה הנכונה. תשובה: 3.
- מידת החמצון הקטנה ביותר יש גופרית במלח
- גופרתי אשלגן
- אשלגן גופרתי
- גופרתי אשלגן
- אשלגן hydrosulfate.
ברור, הגשמה מהירה של משימה זו תהיה לתרגם את שמות המלחים בנוסחה. מאז גופרית היא אלמנט של הקבוצה, אז מידת החמצון הקטנה ביותר היא -2. ערך זה מתאים למתחם עם הנוסחה K 2 S - אשלגן גופרתי. תשובה: 3.
- מידת החמצון היא +5 אטום כלור יש ב יון
- C1O - 4.
- C1o -
- C1O - 3.
- C1O - 2.
בעת ביצוע משימה זו, אתה צריך לשים לב לעובדה כי אין תרכובות אלקטרוניות במצב, אבל יונים כלור עם תשלום שלילי יחיד ("-"). מאז סכום של דרגות החמצון של אטומים ב יון שווה למטען של יון, סך הכל תשלום שלילי על אטומי החמצן ב יון מנותק צריך להיות -6 (+5 - 6 \u003d -1). תשובה: 3.
- מידת החמצון -3 של חנקן יש בכל אחד משני הקשרים
- NF 3 ו- NH 3
- Nh 4 cl ו n 2 o 3
- Nh 4 cl ו nh 3
- HNO 2 ו- NF 3
כדי לקבוע את התגובה הנכונה, יש צורך לחלק נפשית את האפשרויות עבור תשובות בצד שמאל וימין. לאחר מכן בחר את אחד שבו תרכובות יש הרכב פשוט יותר - במקרה שלנו, זהו תרכובת בינארית מתכווננת. הניתוח יבטל את התגובות 2 ו -4, כמו בתחמוצת ופלואוריד בחנקן את מידת החמצון החיובית, כמו אלמנט פחות electronegative. טענה זו מאפשרת לא לכלול ולהגיב 1, שכן הוא החומר הראשון - כל אותו פלואוריד חנקן. תשובה: 3.
- לחומרים של המבנה המולקולרי אינם כוללים
- פחמן דו חמצני
- מתאן
- chloroorod
- סידן פחמתי
אתה צריך לשים לב לשיקול דעת שלילי, הניח במצב ההקצאה. מאז החומרים הגזים בתנאים רגילים יש סורג גבישי מולקולרי במצב מוצק, תנאי המשימה 1-3 אינו תואם את מצב המצב. סידן פחמתי ייחוס מלחים שוב מאשר את התשובה הנכונה. תשובה: 4.
- האם הפסקאות הבאות לגבי המאפיינים של חומרים ומבנהם?
א. תחתונים רטובים מתייבשים בכפור, משום שחומרים המבנה המולקולרי מסוגלים לסובלימציה (סובלימציה).
ב. תחתונים רטובים מתייבש בכפור כי מולקולות מים יש משקל מולקולרי נמוך.
- נכון רק א.
- בדיוק ב.
- שניהם פסקי הדין נכונים
- שתי השיפוט הם לא נכונים.
יֶדַע תכונות גשמיות החומרים של המבנה המולקולרי מאפשרים להחליט כי הגורם ליבשות הכביסה היבשה בכפור היא היכולת של קרח לסובלימציה, ולא את מבנה הדיפל של מולקולות מים. תשובה 1.
- המבנה המולקולרי יש כל אחד מהחומרים, הנוסחאות של אשר ניתנת בשורה
- CO 2, HNO 3, SAO
- Na 2 s, br 2, לא 2
- H 2 אז 4, CU, O 3
- אז 2, אני 2, NSL
מאז האפשרויות המוצעות להכיל שלושה חומרים, זה הגיוני לחלק נפשית גירסאות אלה לשלושה צפצופים אנכיים. ניתוח של כל אחד מהם, החל חומרים של הרכב פשוט יותר (ממוצע Podstolbik), יבטל את התגובה 3, שכן הוא מכיל נחושת מתכת, שיש רשת גבישי מתכת. ניתוח דומה של צפצוף הנכון יאפשר לחסל את התגובה 1, כפי שהוא מכיל את תחמוצת מתכת המגרש מתכת (יון סריג). של שתי האפשרויות הנותרות, יש צורך להוציא את האפשרות 2, שכן היא מכילה מלח מתכת אלקלי - סתר סתר ספינת נתרן (יון סריג). תשובה: 4.
משימות לעבודה עצמאית
- מידת החמצון הוא +5 תערוכות חנקן במתחם, הנוסחה של אשר
- N 2 o 5
- N 2 o 4
- N 2 o.
- את מידת החמצון של כרום במתחם, הנוסחה של אשר (NH 4) 2 CR 2 O 7, שווה ל
- מידת החמצון של ירידות חנקן בשורה של חומרים, הנוסחאות של אשר
- Nh 3, לא 2, kno 3
- N 2 o 4, kno 2, nh 4 cl
- N 2, n 2 o, nh 3
- HNO 3, HNO 2, לא 2
- מידת החמצון של כלור עולה במספר חומרים, הנוסחאות
- NSLO, NSLO 4, KSLO 3
- CL 2, C1 2 O 7, KSLO 3
- CA (C1O) 2, KSLO 3, NSLO 4
- KSL, KSLO 3, KSLO
- תקשורת כימית פולארית ביותר במולקולה
- אַמוֹנִיָה
- serovodorod.
- ברומודורוד
- fluorodorod
- חומר עם קשר קוולנטי לא פולאר
- זרחן לבן
- פוספיד אלומיניום
- זרחן כלוריד (V)
- סידן פוספט
- נוסחאות של חומרים רק עם איון בונד נרשם בשורה
- נתרן כלוריד, זרחן כלוריד (V), פוספט נתרן
- נתרן תחמוצת, נתרן הידרוקסיד, חמצן נתרן
- serouberod, סידן קרביד, תחמוצת סידן
- סידן פלואוריד, תחמוצת סידן, סידן כלוריד
- אטומית קריסטל לסריג יש
- תחמוצת נתרן
- תחמוצת סידן
- גופרית תחמוצת (IV)
- תחמוצת אלומיניום
- חיבור עם Ionic. סריג קריסטל נוצר כאשר הכלור אינטראקציה עם
- זַרחָן
- בריום
- מֵימָן
- אפור
- האם פסקי הדין הבאים על אמוניום כלורי?
א 'אמוניום כלוריד הוא חומר המבנה היוני שנוצר על ידי הקוטב הקוטבית הקוטבית והייוונית.
ב אמוניום כלוריד - החומר של מבנה יון, ולכן מוצק, עקשן ולא תנודתי.
- נכון רק א.
- בדיוק ב.
- שניהם פסקי הדין נכונים
- שתי השיפוט הן שגויות
08. חשמל, תואר חמצון, חמצון ושחזור
בואו נדון במשמעות של מושגים מעניינים ביותר הקיימים בכימיה, וכפי שקרה לעתים קרובות במדע, מבלבל מספיק, ומשומשים בצורה הפוכה. זה יהיה על "electronegativity", "מידת החמצון" ו "Redox תגובות".
מה זה אומר - הרעיון משמש בצורה הפוכה?
ננסה לספר בהדרגה על כך.
חַשְׁמַל מדגים אותנו את המאפיינים של הרדוקציה של האלמנט הכימי. כלומר, היכולת שלו לקחת או לתת פוטונים חינם. וזה גם מקור או אנרגיה בולם (אתר). יאנג או יין.
מידה של חמצון - זהו מושג הדומה למושג "electronegativity". זה גם מאפיין את המאפיינים Redox של האלמנט. אבל ביניהם יש את ההבדל הבא.
חשמל נותן את המאפיין של אלמנט נפרד. כשלעצמו, מתוך מציאתו במתחם כימי. בעוד מידת החמצון מאפיינת את היכולות החמצונית והמקצועית שלה בדיוק כאשר האלמנט הוא חלק מכל מולקולה.
בואו נדבר קצת על מה היכולת לחמצן, ומה היכולת לשחזר.
חִמצוּן - זהו תהליך של העברת אלמנט אחר של פוטונים חינם (אלקטרונים). חמצון אינו כולל אלקטרונים בכלל, כמו עכשיו נחשב למדע. . כאשר האלמנט מחמצן אלמנט נוסף, הוא פועל כמו חומצה או חמצן (ומכאן השם "חמצון"). חמצון - זה אומר לקדם הרס, ריקבון, שריפת אלמנטים . היכולת לחמצן היא היכולת לגרום להרס של מולקולות על ידי האנרגיה המועברת על ידי אותם (פוטונים חינם). זכור כי אנרגיה תמיד הורסת את החומר.
באופן מפתיע, כמה זמן במדע יש סתירות ההיגיון, לא מורגש על ידי אף אחד.
כאן, למשל: "עכשיו אנחנו יודעים כי הסוכן החמצון הוא חומר שהאלקטרונים רוכשים, והפחתת הסוכן הוא החומר שנותן להם" (אנציקלופדיה של הכימאי הצעיר, מאמר "חמצון ותגובה").
ומיד, שתי פסקאות להלן: "החמצן החזק ביותר הוא זרם חשמלי (זרם של אלקטרונים טעונים שלילית)" (שם).
הָהֵן. הציטוט הראשון קובע כי סוכן חמצון הוא אילו אלקטרונים לוקח, ובשיחה של חמצון השני מה נותן.
ומסקנות שגויות דומות זה סותרות זו את זו נאלצות לשנן בבתי ספר ומוסדות!
זה ידוע כי החמצון הטוב ביותר הם לא מתכות. יתר על כן, הקטן יותר את מספר התקופה ואת מספר קבוצות יותר, ככל הנכס חזק של חמצון מתבטאים. זה לא מפתיע. פירקנו את הסיבות לכך במאמר המוקדש לניתוח המערכת התקופתית, בחלק השני, שם דיברו על צבע הגרעינים. מתוך הקבוצה הראשונה ל 8, צבע של נוקלאונים באלמנטים משתנה בהדרגה מן סגול לאדום (אם אתה מחשיב את הצבע הכחול של D ו- F אלמנטים). השילוב של חלקיקים צהובים ואדומים מאפשר את החזרת פוטונים חופשיים שנצברו. צהוב לצבור, אבל להחזיק חלושות. והאדום תורם לתשואה. שים פוטונים - זה תהליך של חמצון. אבל כאשר חלקם אדומים, אז אין חלקיקים שיכולים לצבור פוטונים. לכן אלמנטים של 8 קבוצות, גזים אצילים, לא סוכנים חמצון, בניגוד לשכניהם, הלוגן.
שִׁחזוּר - זהו תהליך הפוך לחמצון. עכשיו, במדע, הוא האמין כי כאשר האלמנט הכימי מקבל אלקטרונים, הוא משוחזר. נקודת מבט זו היא די אפשרית (אבל לא לקבל). כאשר לומדים את המבנה של אלמנטים כימיים, התברר כי הם פולטים אלקטרונים. למסקנה כי אלקטרונים הם חלק מהאלמנטים. משמעות הדבר היא כי העברת אלמנט אלקטרונים היא, סוג, שחזור של המבנה האבוד שלה.
עם זאת, למעשה, הכל לא בסדר.
אלקטרונים הם פוטונים בחינם. הם לא נוקלאונים. הם לא חלק מהגוף של האלמנט. הם נמשכים על ידי כניסה החוצה, וצבברו על פני השטח של הגרעינים וביניהם. אבל הצטברות שלהם היא בכלל לא לשחזר את המבנה של האלמנט או המולקולה. לעומת זאת, פוטונים אלה הנפלטים על ידי אותם אתר (אנרגיה) נחלשים ומשמידים את הקשרים בין האלמנטים. וזה תהליך של חמצון, אבל לא התאוששות.
לשחזר את המולקולה, במציאות, - לקחת ממנה אנרגיה (במקרה זה, פוטונים חינם), ולא לדווח. בחירת פוטונים, האלמנט שחזור מחלק את החומר - משחזר אותו.
סוכני הפחתת הטוב ביותר הם מתכות. נכס זה עוקב באופן טבעי מן ההרכב האיכותי שלהם כמותי - תחומי המשיכה שלהם הוא הגדול ביותר על פני השטח בהכרח יש הרבה או מספיק חלקיקים. של צבע כחול.
אתה יכול אפילו למשוך את הקביעה הבאה של מתכות.
מַתֶכֶת - זהו אלמנט כימי, בהרכב של שכבות פני השטח אשר יש בהכרח חלקיקים כחולים.
אבל אַל מַתֶכֶת - זהו אלמנט, בהרכב שכבות השטח של אשר אין או כמעט שום פוטונים של כחול, ובכרו בהכרח יש אדום.
מתכות עם אטרקציה חזקה שלהם מושלם לקחת אלקטרונים. ולכן הם צמצום סוכנים.
אנו נותנים את ההגדרה של המושגים של "electronegacity", "מידת החמצון", "תגובות Redox", אשר ניתן למצוא בספרי הלימוד בכימיה.
« מידה של חמצון - המטען המותנה של האטום במתחם שחושב על בסיס ההנחה שהוא מורכב רק יונים. בקביעת המושג הזה, הוא האמין באופן קונבנציונלי כי קלסרים (Valence) אלקטרונים הולכים אטומים אלקטרוניים יותר, ולכן תרכובות מורכבות כפי שהוא היו מ יונים חיובי ושלילי. מידת החמצון עשויה להיות אפס, ערכים שליליים וחיוביים, אשר נקבעים בדרך כלל על סמל האלמנט מלמעלה.
הערך האפס של מידת החמצון מיוחס לאטומים של אלמנטים במצב החופשי ... הערך השלילי של מידת החמצון יש את האטומים אשר ענן אלקטרונים קלסר (זוג אלקטרונים) הוא זז. פלואור בכל הקשרים שלו הוא שווה -1. מידה חיובית של חמצון יש אטומים לתת אלקטרונים Valence לאטומים אחרים. לדוגמה, מתכות אלקליין ואדמה אלקליין, היא בהתאמה +1 ו -2. ב יונים רגילים, הוא שווה למטען של יון. ברוב התרכובות, מידת החמצון של אטומי מימן היא + 1, אבל בהידריד של מתכות (תרכובות עם מימן) ואחרים - זה שווה ל -1. עבור חמצן, מידת החמצון -2 היא אופיינית, אבל, למשל, במתחם עם פלואור זה יהיה +2, ובחידות peroxidation -1. ...
סכום האלגברי של החמצון של אטומים במתחם הוא אפס, וב- יון מורכב - המטען של יון. ...
מידת החמצון הגבוהה ביותר היא הערך החיובי הגדול ביותר. עבור רוב האלמנטים, הוא שווה למספר הקבוצה במערכת התקופתית והוא מאפיין כמותי חשוב של האלמנט בקשריו. הערך הקטן ביותר של מידת החמצון של האלמנט, המתרחש בתרכובותיו, נהוג להיקרא מידה נמוכה יותר של חמצון; כל שאר - ביניים "(מילון אנציקלופדי של הכימאי הצעיר, מאמר" תואר של חמצון ").
הנה המידע הבסיסי הנוגע לתפיסה זו. זה קשור קשר הדוק למונח אחר - "חשמל".
« חַשְׁמַל - זוהי היכולת של אטום במולקולה כדי למשוך אלקטרונים המעורבים בהיווצרות של בונד כימי "(מילון אנציקלופדי של כימאי הנוער, מאמר" חשמל ").
"תגובות רדוקס מלווה בשינוי במידת החמצון של האטומים המהווים חלק מחומרים המגיבים, כתוצאה מהאלקטרונים העברת האטום של האטום האחר. עם תגובות חמצוניות והפחתת, חמצון (חזרה אלקטרונים) והתאוששות (תוספת אלקטרונים) מתרחשות (מילון אנציקלופדי כימי) (מילון אנציקלופדי כימי אד. I.L. Knunyantz, מאמר "Redox תגובה").
לדעתנו, יש לא מעט טעויות בשלושת המושגים האלה.
קוֹדֶם כֹּל , אנו מאמינים כי היווצרות של חיבור כימי בין שני האלמנטים אינה על כל תהליך הסוציאליזציה של האלקטרונים שלהם. הקשר הכימי הוא חיבור כבידה. אלקטרונים, לטוס לכאורה סביב הקרנל, הם פוטונים חופשיים המצטברים על פני השטח של הגרעינים בגוף האלמנט וביניהם. על מנת שבין שני אלמנטים התעוררה קשר, הפוטונים החופשיים שלהם אינם צריכים לרוץ בין האלמנטים. זה לא קורה. למעשה, אלמנט כבד ממריא (מושך) פוטונים חינם עם מצית, ומשאיר אותם (ליתר דיוק, על עצמך). ואת האזור של אלמנט קל יותר עם פוטונים אלה הוסרו, בדרך זו או אחרת. בגלל אילו אטרקציה באזור זה מתבטאת במידה רבה יותר. ואת האלמנט קל הוא נמשך בכבדות. אז מתעוררת הקשר הכימי.
שנית , הכימיה המודרנית רואה את היכולת של האלמנטים כדי למשוך אלקטרונים מעוותים - הפוך. הוא האמין כי גדול יותר electonegativity של האלמנט, יותר הוא מסוגל למשוך אלקטרונים לעצמו. ואת פלואור עם חמצן לכאורה עושה את זה הכי טוב - הם מושכים אלקטרונים אחרים לעצמם. כמו גם אלמנטים אחרים 6 ו 7 קבוצות.
למעשה, דעה זו היא לא יותר מאשר אשליה. הוא מבוסס על תצוגה שגויה, כאילו מספר הקבוצה יותר, הפריטים הקשים יותר. וגם, גדול יותר את האשמה החיובית של הגרעין. זה שטויות. מדענים אפילו לא להפריע להם להסביר כי מנקודת המבט שלהם הוא "תשלום". בפשטות, כמו בנומרולוגיה, הם חשבו על כל האלמנטים לפי הסדר, ונחתמו על פי מספר ערכי החיוב. טיול גדול!
זה ברור וילד כי הגז קל יותר מאשר מתכת צפופה. איך זה קרה כי בכימיה זה נחשב כי גזים טובים יותר למשוך אלקטרונים?
מתכות צפופות, כמובן, הם טובים יותר למשוך אלקטרונים.
מדענים - כימאים, כמובן, יכולים להשאיר את המושג "electronegance" בקורס, שכן הוא כל כך נפוץ. עם זאת, הם יצטרכו לשנות את משמעותו על ההפך הישיר.
חַשְׁמַל - זוהי היכולת של האלמנט הכימי במולקולה כדי למשוך אלקטרונים. וכמובן, במתכות, היכולת הזאת באה לידי ביטוי טוב יותר מאשר לא מתכות.
באשר לפולנים החשמליים במולקולה, אכן, אכן, מוט שלילי - אלה הם אלמנטים שאינם מתכת לתת אלקטרונים עם שדות קטנים יותר של משיכה. אבל חִיוּבִי - זה תמיד אלמנטים עם תכונות מתכתיות בולטות יותר, עם שדות גדולים של משיכה.
חיוך יחד.
חַשְׁמַל - זה עוד אחד, ניסיון נוסף לתאר את איכות האלמנט הכימי, יחד עם שקילה וקיים כבר קיים. כפי שקורה לעתים קרובות, מדענים מאזור מדע אחר, במקרה זה, כימיה, כאילו לא סומך עם עמיתיהם לפיסיקאים, אלא, פשוט בגלל כל אדם, עושה תגליות, הוא בדרכו שלה, ולא רק לחקור את החוויה של אחרים.
אז זה קרה הפעם.
המסה והשימוש לא עזרו לכימאים להבין מה קורה באטומים כאשר הם היו אינטראקציה אחד עם השני - ו electonegate הוצג - היכולת של האלמנט למשוך אלקטרונים המעורבים בהיווצרות של הקשר הכימי. זה צריך להיות מוכר כי הרעיון של מושג זה הוא מונח מאוד. עם התיקון היחיד שהוא משקף את המציאות בצורה הפוכה. כפי שאמרנו, עדיף למשוך אלקטרונים מתכת, ולא לא מתכות - מכוח המאפיינים של צבע של גרעיני פני השטח. מתכות הן סוכני צמצום הטוב ביותר. Nonmetals - חמצון סוכנים. מתכות נלקחים, לא מתכות לתת. מתכות - יין, נוממטלה - יאנג.
אזוטרי מגיע כדי לעזור למדע בענייני להבין את סודות הטבע.
בִּדְבַר תואר חמצון זהו ניסיון טוב להבין כיצד התפלגות של אלקטרונים בחינם מתרחשת בתוך המתחם הכימי - מולקולות.
אם המתחם הכימי הוא אחיד - כלומר, זה פשוט, המבנה שלו מורכב של אלמנטים מאותו סוג - אז הכל נכון, באמת את מידת החמצון של כל אלמנט במתחם הוא אפס. מכיוון שאין חמצון בקשר זה ולא התקנת מחדש. וכל האלמנטים שווים באיכות. אף אחד לא לוקח את האלקטרונים, אף אחד לא נותן. בין אם זה חומר צפוף, או נוזלי, או גז - לא משנה.
מידת החמצון, כמו גם electronegativity, מדגים את איכות האלמנט הכימי - רק במסגרת האלמנט הכימי. מידת החמצון נועדה להשוות את איכות האלמנטים הכימיים במתחם. לדעתנו, הרעיון הוא טוב, אבל יישום שלה לא ממש מספק.
אנו באופן מוחלט נגד התיאוריה כולה ומושג של המבנה של אלמנטים וכימיים חיבורים ביניהם. ובכן, אם רק בגלל מספר הקבוצות, על פי הרעיונות שלנו, צריך להיות יותר מ 8. ולכן, כל המערכת מתמוטטת. כן, ולא רק זה. באופן כללי, לחשב מחדש את מספר האלקטרונים באטומים "אצבעות" הוא איכשהו לא רציני.
בהתאם לתפיסה הנוכחית, מתברר כי החמצון החזק ביותר מוקצים את החיובים הקטנים ביותר - פלואור יש תשלום -1 בכל התרכובות, חמצן כמעט בכל מקום -2. ובמתכות פעילים מאוד - אלקליין ואדמה אלקליין - חיובים אלה, בהתאמה, +1 ו -2. אחרי הכל, זה בהחלט לא הגיוני. אמנם, אנחנו חוזרים, אנו מבינים את התוכנית הכללית היטב, בהתאם אשר נעשה - הכל למען 8 קבוצות בטבלה ו 8 אלקטרונים ברמת האנרגיה החיצונית.
עם זאת, לכל הפחות, את גודל ההאשמות האלה הלוגן וחמצן היה אמור להיות הגדול ביותר עם סימן מינוס. ו Alkaline ו אלקליין מתכות כדור הארץ הם גם גדולים, רק עם סימן פלוס.
בכל תרכובת כימית ישנם אלמנטים כי לתת אלקטרונים - חמצון סוכנים, לא מתכות, חיובים שליליים, ואלמנטים לקחת אלקטרונים - צמצום סוכנים, מתכות, חיובי חיובי. זה בדיוק הדרך להשוות את האלמנטים, להתייחס להם זה לזה ולנסות, לקבוע את מידת החמצון שלהם.
עם זאת, כדי לגלות בדרך זו את מידת החמצון, לדעתנו, לא משקף במדויק את המציאות. זה יהיה נכון יותר להשוות את ElectroneGability של האלמנטים במולקולה. אחרי הכל, electronegativity כמעט זהה למידת החמצון (מאפיין את האיכות, רק אלמנט נפרד).
אתה יכול לקחת את סולם החשמל ולשים אותו בנוסחה עבור כל אלמנט. ואז הוא ייראה מיד, אילו אלמנטים ניתנים אלקטרונים, אשר נלקחים. אלמנט זה אשר electronegativity במתחם הוא הקוטב השלילי הגבוהה ביותר, נותן אלקטרונים. ואת זה ElectroneGability הוא הקוטב החיובי הקטן ביותר, לוקח את האלקטרונים.
אם פריטים, מודים, 3 או 4 במולקולה, שום דבר לא משתנה. כל גם לשים את גודל electronegability ולהשוות.
למרות שזה לא צריך להישכח לצייר את המודל של המבנה של המולקולה. ואכן, בכל תרכובת, אם זה לא פשוט, כלומר, זה לא מורכב מסוג אחד של אלמנטים, קשורים זה לזה, קודם כל, מתכות ולא מתכות. מתכות בחר אלקטרונים ללא מתכות, וכן לאגד אותם. ובאנרגיה אחת של לא מתכת, אלקטרונים 2 ניתן לבחור בו זמנית או מספר גדול יותר של אלמנטים עם תכונות מתכת בולטות יותר. אז מתרחשת המולקולה המורכבת, המורכבת. אבל זה לא אומר כי במולקולה כזו, אלמנטים מתכת יבואו חיבור מוצק אחד עם השני. אולי הם יהיו ממוקמים בצדדים מנוגדים זה מזה. אם בקרבת מקום - הם ימשכו. אבל החיבור מוצק נוצר רק אם אלמנט אחד הוא מתכתי יותר מאשר השני. הקפד לבצע אלמנט אחד בחר את האלקטרונים - הוסרו. אחרת, האלמנט לא יקרה - פטור מפוטונים חינם על פני השטח. שדה האטרקציה לא יתגלה היטב, ולא יהיה שום קשר עמיד. זה נושא מורכב - חינוך קשרים כימייםואנחנו לא אספר על זה בפירוט במאמר זה.
אנו מאמינים, דלקנו מאוד את הנושא המוקדש לניתוח של מושגים של "אלקטרנקסי", "תואר חמצון", "חמצון" ו "שחזור", ובנתיב תשומת הלב שלך הרבה מידע סקרן.
מספר חלומות מנוהלים מחבר העולם אלנהשיקום "כאשר סימן מאוחד של indi-expeam נולד, המהות והחיים מחולקים לשניים. מנקודה זו, אם העולם הסופי לא יגיע, המהות והחיים לעולם לא יראו זה את זה שוב ". ויליאם, "מסתורין של פרח הזהב" אחרי המכון
מהספר ספר סודות. מדהים ברור על כדור הארץ ובחו"ל מְחַבֵּר Vyatkin Arkady Dmitrievich.מזוכיזם מידה קיצונית של ערפפיות מרצון במובן זה מזוכיזם דומה לתקשורת. Mazochists הם אנשים מקבלים תחושות נעימות מן הסבל הפיזי והנפשי שלהם. במילים אחרות, הם אוהבים את זה כאשר הם היכו, נוזף, לועג
מן הערפדים בספר ברוסיה. כל מה שאתה צריך לדעת עליהם! מְחַבֵּר באואר אלכסנדרכיצד לקבוע את מידת אובדן הדם כאשר הערפד שותה דם, ואז שותה בבת אחת מתוך חצי ליטר אחד וחצי ליטר דם. הגוף האנושי מכיל רק חמישה או שישה ליטר דם, כך שאובדן דם כזה אינו בהכרח מסוכן לכל החיים. עם זאת, הערפד יכול
מהספר מודל את העתיד בחלום מחבר העולם אלנהשיקום לאחר חלוקת המכון, העובדת כמהנדס בחברה סגורה, הבנתי שאני לא במקומי, ולכן החלטתי לשנות את המקצוע ונכנסתי לבית הספר לג'אז, ולאחר מכן בבית הספר למוסיקה למשרד הקלאסי .
מן הספר הזהב כללי Fengshui. 10 צעדים פשוטים להצלחה, לרווחה ולאריכות ימים מְחַבֵּר רודין ולנטין לאונידוביץ 'מידת ההשפעה השלילית של אובייקטים חיצוניים ההשפעה השלילית הגדולה ביותר אובייקטים חיצוניים, להיות מיד לפני הכניסה לבית. אבל ככל שהם ממוקמים בזווית לכניסה, חלש הופך את השפעתם. האובייקט הוא ישירות
על ידי המחבר אדוארד ריפויתואר ראשון: בישול. דרשת נג'ורני וממלכת המקרה של אלוהים מתחילה עם אידיליה בגליל והכרזה על "ממלכת האלוהים". תחזית זו מציינת אותנו להוראות הפופולריות שלו. במקביל, זה הכנה עבור מוגבה יותר
מהאבולוציה האלוהית. מ Sphinx כדי המשיח על ידי המחבר אדוארד ריפוירמה שנייה של ייזום (טיהור). ריפוי נפלא. טיפול נוצרי בכל המסתורין העתיק להכנה מוסרית ואינטלקטואלית צריך להיות טיהור הנשמה, אשר אמור להחיות איברים חדשים בו ולתת אותו לאחר מכן את היכולת
מהספר חידה גדולה של ספינקס המחבר Barbaren Georges.שחזור הפסל הגיל בפועל של ספינקס גדול חוזר לתחילת עידן אדם. לפחות הוא פירמידה עכשווית, האנסמבל של שהוא, כפי שנראה, השלימו אותו. הדימוי של ספינקס גדול היה נתון למאות פג תוקף
מתוך הספר ריפוי הנשמה. 100 טכניקות מדיטטיביות, תרגילי ריפוי והרפיה מְחַבֵּר Rajnish bhagwan sri.שיקום הקצב ... להתקין באותו זמן ללכת לישון - אם בכל ערב זה אחד עשר, זה אומר כי אחת עשרה. זה הראשון: קבל זמן מסוים, ועד מהרה הגוף יוכל להזין את הקצב הזה. אל תשנה הפעם, אחרת תבחר את הגוף. גוּף
על ידי המחבר Kuzmishin E.תואר של קבלת דלפק סטודנט לתואר של התלמיד. עיטור של הלשכה והתחומים והתקרה של האכסניה צריכה להיות עניין כחול ולבן, ללא זזה. מעל ראשו של המומחה ממוקם מוקף ברק של משולש עם השם במרכזו
מתוך ספר Caliosostro ו הבטוחים המצריים על ידי המחבר Kuzmishin E.קבלת פנים בתואר של התלמיד. עיטור הלשינים והתחומים והתקרה של האכסניה צריכה להיות תלויה בחומר כחול ולבן ללא זזה. מעל ראשו של המומחה ממוקם מוקף ברק של משולש עם השם "יהוה", רקום במרכזו
מתוך הספר אוטוביוגרפיה יוגה מְחַבֵּר Yogananda Paramyansa.פרק 23 אני מקבל תואר אקדמי - אתה מתעלם מההגדרות הפילוסופיות של ספר הלימוד, בסמוך על כך שזכה לאיזה "אינטואיציה" לא יעצור אותך בכל הבחינות. אבל אם אתה בדחיפות לא להתייעץ שיטה מדעית יותר, אז אני אצטרך
מתוך ספר הקבלה. העולם הגבוה ביותר. תחילת הדרך מְחַבֵּר Lightman Michael.7.5. מידת המודעות של הרוע כפי שהובהר במאמר "מתעבבים", הנאה והאשר נקבעים על ידי מידת הדמיון של הבורא על פי הנכסים, וסבל וחוסר סבלנות - מידת ההבדלים מהבורא. בהתאם לכך, אגואיזם מגעיל לנו ולצייר בלתי נסבל,
אופציה 1
1. לקבוע את מידת החמצון של אטומים של אלמנטים כימיים בחיבורים הבאים: HNO₃, NO₂, H₃n, SO₂, N₂o.
2. ניצול הטבלה המחזורית, מקם את האלמנטים הבאים על מנת להפחית את electronegativity: o, n, להיות, b, li, c. לקבוע היכן פלואור ונתרן צריך להיות ממוקם בשורה זו. להסביר את התשובה. 
3. איך מידת החמצון של גופרית Atom לשנות כאשר SO₂ SON₃? תגובה להסביר את התשובה.
אפשרות 2.
1. לקבוע את מידת החמצון של אטומים של אלמנטים כימיים בחיבורים הבאים: Co₂, h₃po, sih, p₂o₅, mg₂si.
2. בכיוון של אטומים של איזה אלמנט כימי מועבר על ידי כללי זוגות אלקטרוניים, מולקולות של החיבורים הבאים: BF₃, PCL₃, CS₂, CCL₄, HBR? לתת תשובה סבירה.
3. האם מידה של פחמן שינויים חמצון במהלך היווצרות חומצה קואלי H₂CO פחמן דו חמצני מים? תגובה להסביר את התשובה.
אפשרות 3.
1. לקבוע את מידת החמצון של אטומים של אלמנטים כימיים בחיבורים הבאים: Cl₂, Naclo, Cacl₂, HF, SO₃, Cl₂o₇.
2. שימוש מערכת תקופתית אלמנטים כימיים, מיקום האלמנטים הבאים בסדר הגברת ElectroneGability שלהם: P, AL, CL, NA, S, MG. מצא אשלגן ופלואור בשורה זו. תגובה להסביר את התשובה. 
3. איך מידת של שינוי חמצון פחמן כאשר בוער מתאן ch₄ עם היווצרות של תחמוצת פחמן (IV) ומים? תגובה להסביר את התשובה.
אפשרות 4.
1. לקבוע את מידת החמצון של אטומים של אלמנטים כימיים בחיבורים הבאים: H₂So₄, SO₂, NO₂, BF₃, H₂s.
2. לקראת האטומים שבהם יסודות כימיים מציג זוגות אלקטרוניים כללי, במולקולות של החיבורים הבאים: H₂o, PCL₃, H₃n, H₂s, Co₂? לתת תשובה סבירה.
3. אם דרגות החמצון של האטומים משתנות כאשר המים משתנים חומרים פשוטים - מימן וחמצן? תגובה להסביר את התשובה.


