Elektronegativitas adalah sifat suatu unsur kimia untuk menarik elektron ke atomnya dari atom unsur lain yang dengannya unsur ini membentuk ikatan kimia dalam senyawa.
Dengan pembentukan ikatan kimia antara atom dari unsur-unsur yang berbeda, awan elektron umum bergeser ke atom yang lebih elektronegatif, yang menyebabkan ikatan tersebut menjadi polar secara kovalen, dan dengan perbedaan elektronegativitas yang besar, ionik.
Keelektronegatifan diperhitungkan saat menulis rumus kimia: dalam senyawa biner, simbol unsur paling elektronegatif ditulis di belakang.
Elektronegatifitas meningkat dari kiri ke kanan untuk elemen tiap periode dan menurun dari atas ke bawah untuk elemen grup PS yang sama.
Valensi elemen adalah sifat atomnya untuk bergabung dengan sejumlah atom lain.
Bedakan antara stoikiometri, valensi elektronik, dan bilangan koordinasi. Kami hanya akan mempertimbangkan valensi stoikiometri.
Stoikiometri valensi menunjukkan berapa banyak atom unsur lain yang diikat oleh atom unsur ini. Satuan valensi diambil sebagai valensi hidrogen, sejak hidrogen selalu monovalen. Misalnya, dalam senyawa HCl, H 2 O, NH 3 (ejaan yang benar untuk amonia H 3 N sudah digunakan dalam buku teks modern), CH 4 klorin monovalen, oksigen divalen, nitrogen trivalen, dan karbon tetravalen.
Valensi stoikiometri oksigen biasanya 2. Karena hampir semua unsur membentuk senyawa dengan oksigen, maka mudah digunakan sebagai standar untuk menentukan valensi unsur lain. Misalnya, dalam senyawa Na 2 O, CoO, Fe 2 O 3, SO 3 natrium monovalen, kobalt divalen, besi trivalen, sulfur heksavalen.
Dalam reaksi redoks, penting bagi kita untuk menentukan bilangan oksidasi unsur.
Status oksidasi unsur dalam suatu zat disebut valensi stoikiometri, diambil dengan tanda plus atau minus.
Unsur kimia dibagi lagi menjadi unsur valensi konstan elemen valensi variabel.
1.3.3. Zat struktur molekuler dan non-molekul. Jenis kisi kristal. Ketergantungan sifat-sifat zat pada komposisi dan strukturnya.
Bergantung pada keadaan senyawa di alam, mereka dibagi menjadi molekuler dan non-molekuler. DI zat molekuler Partikel struktural terkecil adalah molekul. Zat ini memiliki kisi kristal molekuler. Dalam zat non-molekuler, partikel struktural terkecil adalah atom atau ion. Kisi kristal mereka adalah atom, ionik atau logam.
Jenis kisi kristal sangat menentukan sifat zat. Misalnya, logam dengan jenis logam kisi kristal, berbeda dari semua elemen lainnya plastisitas tinggi, konduktivitas listrik dan termal... Properti ini, serta banyak lainnya - kelenturan, kilau logam, dll. karena jenis ikatan khusus antara atom logam - koneksi logam. Perlu dicatat bahwa sifat yang melekat pada logam hanya muncul dalam keadaan terkondensasi. Misalnya, perak dalam bentuk gas tidak memiliki sifat fisik logam.
Jenis ikatan khusus dalam logam - logam - disebabkan oleh kekurangan elektron valensi, oleh karena itu ikatan tersebut umum pada seluruh struktur logam. Model struktur logam yang paling sederhana mengasumsikan bahwa kisi kristal logam terdiri dari ion positif yang dikelilingi elektron bebas, pergerakan elektron terjadi secara kacau, seperti molekul gas. Namun, model seperti itu, meski secara kualitatif menjelaskan banyak sifat logam, ternyata tidak cukup dalam verifikasi kuantitatif. Perkembangan lebih lanjut dari teori keadaan logam mengarah pada penciptaan teori zona logam, yang didasarkan pada konsep mekanika kuantum.
Di simpul kisi kristal ada kation dan atom logam, dan elektron bebas bergerak di sepanjang kisi kristal.
Sifat mekanik karakteristik logam adalah plastik, karena kekhasan struktur internal kristalnya. Plastisitas dipahami sebagai kemampuan benda-benda di bawah pengaruh gaya luar untuk mengalami deformasi, yang tetap ada bahkan setelah pengaruh eksternal dihentikan. Sifat logam ini memungkinkannya dibentuk menjadi berbagai bentuk selama penempaan, digulung menjadi lembaran atau ditarik menjadi kawat.
Plastisitas logam disebabkan oleh fakta bahwa, di bawah pengaruh eksternal, lapisan ion yang membentuk kisi kristal bergeser relatif satu sama lain tanpa pecah. Ini terjadi sebagai hasil dari kenyataan bahwa elektron yang dipindahkan, karena redistribusi bebas, terus berkomunikasi antara lapisan ionik. Ketika secara mekanis bekerja pada padatan dengan kisi atom, masing-masing lapisannya bergeser dan adhesi di antara mereka rusak karena pecah. ikatan kovalen.
ion, kemudian zat ini terbentuk jenis kisi kristal ionik.

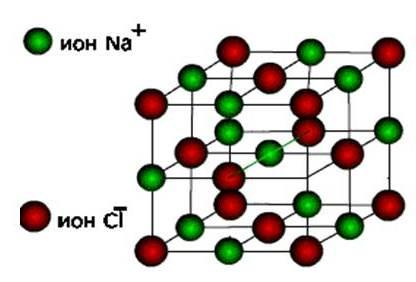
Ini adalah garam, serta oksida dan hidroksida logam khas. Ini adalah zat yang keras dan rapuh, tetapi kualitas utamanya : Larutan dan lelehan senyawa ini menghantarkan arus listrik.
Jika situs kisi kristal atom, kemudian zat ini terbentuk jenis atom kisi kristal(berlian, boron, silikon oksida dari aluminium dan silikon). Sifatnya sangat keras dan tahan api, tidak larut dalam air.
Jika situs kisi kristal molekul, kemudian zat ini terbentuk (dalam kondisi normal gas dan cairan: О 2, HCl; I 2 bahan organik).
Menarik untuk diperhatikan logam galium, yang meleleh pada suhu 30 o C. Anomali ini dijelaskan oleh fakta bahwa molekul Ga 2 terletak di simpul kisi kristal, dan sifat-sifatnya yang menjadi mirip dengan zat dengan kisi kristal molekuler.
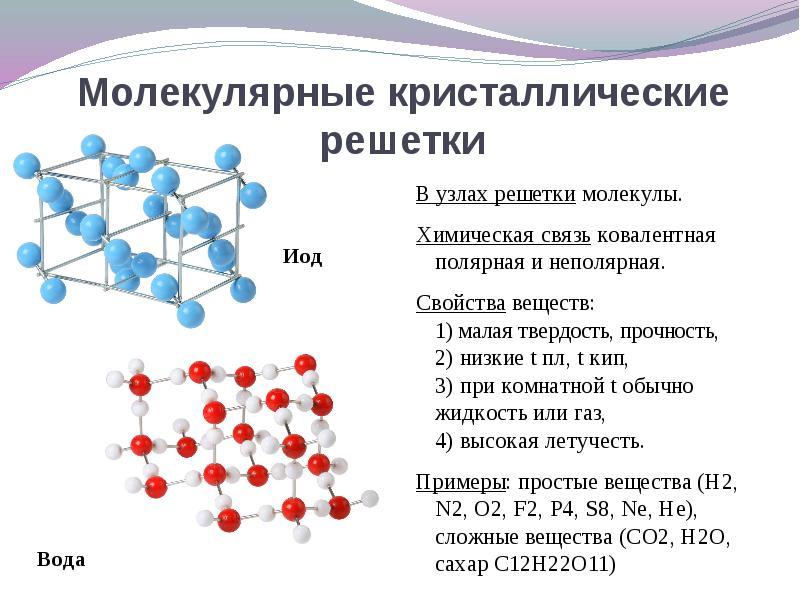
Contoh.Semua non-logam dalam grup memiliki struktur non-molekul:
1) karbon, boron, silikon; 2) fluor, brom, yodium;
3) oksigen, sulfur, nitrogen; 4) klorin, fosfor, selenium.
Dalam zat non-molekuler, partikel struktural terkecil adalah atom atau ion. Kisi kristal mereka adalah atom, ionik atau logam
Kapan keputusan pertanyaan ini lebih mudah untuk menjawab dari sebaliknya. Jika situs kisi kristal berada molekul, kemudian zat ini terbentuk jenis molekul kisi kristal(dalam kondisi normal gas dan cairan: O 2, HCl; juga I 2, belerang belah ketupat S 8, fosfor putih P 4, zat organik). Menurut sifatnya, ini adalah senyawa rapuh dengan leleh rendah.
Dalam jawaban kedua ada gas fluor, di jawaban ketiga - gas oksigen dan nitrogen, di jawaban keempat - gas klor. Artinya zat tersebut memiliki kisi kristal molekuler dan struktur molekul.
DI pertama Jawabannya adalah semua zat merupakan senyawa padat dalam kondisi normal dan membentuk kisi atom yang artinya memiliki struktur non molekuler.
Jawaban yang benar:1) karbon, boron, silikon
- Unsur kimia paling elektronegatif
- besi
- magnesium
- kalsium
Perhatian harus diberikan pada frase "paling elektronegatif", yaitu elemen dengan sifat logam terbesar. Argumen ini akan memungkinkan kita untuk mengecualikan nitrogen dari kemungkinan jawaban, sebagai non-logam, dan memikirkan kalsium, sebagai logam paling aktif yang diusulkan dalam tugas ini. Jawaban: 4.
- Ikatan kimia paling polar di salah satu molekul
- CCl 4
- CBr 4
Pengetahuan tentang keteraturan perubahan elektronegativitas dalam periode dan kelompok Tabel Periodik D.I. Jawaban: 2.
- Dalam molekul hidrogen klorida dan klorin, ikatan kimianya masing-masing
- kutub ionik dan kovalen
- ionik dan kovalen non-polar
- kovalen polar dan kovalen non-polar
- hidrogen dan kovalen non-polar
Kata kunci untuk menyelesaikan tugas ini dengan cepat dan benar adalah "sesuai". Dalam varian yang diajukan, hanya satu jawaban yang diawali dengan kata "kutub kovalen", yaitu karakteristik ikatan hidrogen klorida. Jawaban: 3.
- Bilangan oksidasi mangan dalam senyawa yang rumusnya adalah K 2 MnO 4
Mengetahui aturan untuk menghitung bilangan oksidasi unsur dengan rumus akan memungkinkan Anda memilih jawaban yang benar. Jawaban: 3.
- Sulfur dalam garam memiliki bilangan oksidasi paling rendah
- kalium sulfat
- kalium sulfit
- kalium sulfida
- kalium hidrogen sulfat
Tentunya, penyelesaian tugas ini dengan cepat akan difasilitasi dengan penerjemahan nama-nama garam ke dalam formula. Karena belerang adalah elemen dari kelompok VIA, bilangan oksidasi terendahnya adalah -2. Nilai ini sesuai dengan senyawa dengan rumus K 2 S - kalium sulfida. Jawaban: 3.
- Bilangan oksidasi +5 yang dimiliki atom klor dalam ion
- C1O - 4
- C1O -
- C1O - 3
- C1O - 2
Saat melakukan tugas ini, Anda harus memperhatikan fakta bahwa pada kondisi tersebut tidak diberikan senyawa netral secara elektrik, tetapi ion klor dengan muatan negatif tunggal ("-"). Karena jumlah bilangan oksidasi atom dalam ion sama dengan muatan ion, muatan negatif total atom oksigen dalam ion yang diinginkan adalah -6 (+5 - 6 \u003d -1). Jawaban: 3.
- Bilangan oksidasi -3 dimiliki nitrogen di masing-masing dua senyawa
- NF 3 DAN NH 3
- NH 4 Cl dan N 2 O 3
- NH 4 Cl dan NH 3
- HNO 2 dan NF 3
Untuk menentukan jawaban yang benar, Anda perlu membagi pilihan jawaban ke dalam sub-kolom kiri dan kanan. Kemudian pilih salah satu yang senyawanya memiliki komposisi yang lebih sederhana - dalam kasus kita, ini adalah sub-kolom kanan dari senyawa biner. Analisis akan memungkinkan untuk mengecualikan jawaban 2 dan 4, karena dalam oksida dan fluorida nitrogen memiliki bilangan oksidasi positif, seperti unsur yang kurang elektronegatif. Argumen ini memungkinkan kita untuk mengecualikan jawaban 1, karena zat pertama di dalamnya adalah nitrogen fluorida yang sama. Jawaban: 3.
- Untuk zat struktur molekul jangan diterapkan
- karbon dioksida
- metana
- hidrogen klorida
- kalsium karbonat
Perhatian harus diberikan pada penilaian negatif yang melekat dalam kondisi penugasan. Karena zat gas dalam kondisi normal memiliki kisi kristal molekuler dalam keadaan padat, opsi 1-3 tidak memenuhi syarat tugas. Pemberian kalsium karbonat ke garam sekali lagi akan mengkonfirmasi jawaban yang benar. Jawaban: 4.
- Apakah penilaian berikut tentang sifat zat dan strukturnya benar?
A. Cucian basah mengering dalam embun beku karena substansi dari struktur molekul mampu menyublim (sublimasi).
B. Cucian basah mengering dalam cuaca dingin karena molekul air memiliki berat molekul yang rendah.
- hanya A yang benar
- hanya B yang benar
- kedua penilaian itu benar
- kedua penilaian itu tidak benar
Pengetahuan properti fisik substansi struktur molekul memungkinkan kita untuk memutuskan bahwa alasan pengeringan pakaian basah dalam cuaca dingin adalah kemampuan es untuk menyublim, dan bukan struktur dipol dari molekul air. Jawaban 1.
- Setiap zat memiliki struktur molekul, rumusnya diberikan dalam deret
- CO 2, HNO 3, CaO
- Na 2 S, Br 2, TIDAK 2
- H 2 SO 4, Cu, O 3
- SO 2, I 2, HCl
Karena opsi yang diusulkan masing-masing berisi tiga substansi, maka logis untuk membagi opsi ini secara mental menjadi tiga pilar vertikal. Analisis masing-masing, dimulai dengan zat dengan komposisi yang lebih sederhana (pilar tengah), akan menghilangkan jawaban 3, karena mengandung logam tembaga yang memiliki kisi kristal logam. Analisis serupa pada subkolom kanan akan memungkinkan kita untuk mengecualikan jawaban 1, karena mengandung oksida logam alkali tanah (kisi ionik). Dari dua pilihan yang tersisa, pilihan 2 harus dikeluarkan, karena mengandung garam logam alkali - natrium sulfida (kisi ionik). Jawaban: 4.
Tugas belajar mandiri
- Bilangan oksidasi +5 nitrogen terlihat dalam senyawa, rumusnya adalah
- N 2 O 5
- N 2 O 4
- N 2 O
- Bilangan oksidasi kromium dalam senyawa yang rumusnya (NH 4) 2 Cr 2 O 7 adalah
- Bilangan oksidasi nitrogen menurun dalam sejumlah zat, rumusnya
- NH 3, NO 2, KNO 3
- N 2 O 4, KNO 2, NH 4 Cl
- N 2, N 2 O, NH 3
- HNO 3, HNO 2, NO 2
- Bilangan oksidasi klorin meningkat dalam sejumlah zat, rumusnya
- НСlO, НСlO 4, КСlO 3
- Сl 2, С1 2 O 7, КСlO 3
- Ca (C1O) 2, KClO 3, HClO 4
- КСl, КСlO 3, КСlO
- Ikatan kimia paling polar dalam molekul
- amonia
- hidrogen sulfida
- hidrogen bromida
- hidrogen fluorida
- Zat dengan ikatan non-polar kovalen
- fosfor putih
- aluminium fosfida
- fosfor (V) klorida
- kalsium fosfat
- Rumus untuk zat yang hanya memiliki ikatan ionik ditulis di baris ini
- natrium klorida, fosfor (V) klorida, natrium fosfat
- natrium oksida, natrium hidroksida, natrium peroksida
- karbon disulfida, kalsium karbida, kalsium oksida
- kalsium fluorida, kalsium oksida, kalsium klorida
- Kisi kristal atom memiliki
- natrium oksida
- kalsium oksida
- sulfur (IV) oksida
- aluminium oksida
- Koneksi ionik kisi kristal dibentuk oleh interaksi klor dengan
- fosfor
- barium
- hidrogen
- abu-abu
- Apakah penilaian berikut tentang amonium klorida benar?
A. Amonium klorida - zat berstruktur ionik, terbentuk karena ikatan polar dan ion kovalen.
B. Amonium klorida adalah substansi dengan struktur ionik, dan oleh karena itu padat, tahan api dan tidak mudah menguap.
- hanya A yang benar
- hanya B yang benar
- kedua penilaian itu benar
- kedua penilaian itu salah
08. Elektronegativitas, bilangan oksidasi, oksidasi dan reduksi
Mari kita bahas arti dari konsep-konsep yang sangat menarik yang ada dalam kimia, dan, seperti yang sering terjadi dalam sains, cukup membingungkan dan digunakan secara terbalik. Kita akan berbicara tentang "elektronegativitas", "bilangan oksidasi" dan "reaksi redoks".
Apa artinya - konsep digunakan secara terbalik?
Kami akan mencoba memberi tahu Anda secara bertahap.
Elektronegativitas menunjukkan kepada kita sifat redoks suatu unsur kimia. Artinya, kemampuannya mengambil atau memberikan foton gratis. Dan juga apakah unsur ini merupakan sumber atau penyerap energi (eter). Yang atau Yin.
Status oksidasi Apakah konsep yang mirip dengan elektronegativitas. Ini juga mencirikan sifat redoks elemen. Tetapi ada perbedaan berikut di antara mereka.
Keelektronegatifan memberikan karakteristik satu elemen. Dengan sendirinya, di luar menemukannya dalam komposisi senyawa kimia apa pun. Sedangkan bilangan oksidasi mencirikan kemampuan redoksnya persis ketika unsur tersebut termasuk dalam komposisi molekul apapun.
Mari kita bicara sedikit tentang apa itu kemampuan untuk mengoksidasi dan apa itu kemampuan untuk memulihkan.
Oksidasi Merupakan proses pemindahan foton bebas (elektron) ke unsur lain. Oksidasi sama sekali bukan menghilangkan elektron, seperti yang diyakini dalam sains ... Ketika suatu unsur mengoksidasi unsur lain, ia bertindak seperti asam atau oksigen (karena itu disebut "oksidasi"). Mengoksidasi berarti berkontribusi pada penghancuran, pembusukan, pembakaran elemen ... Kemampuan untuk mengoksidasi adalah kemampuan untuk menyebabkan penghancuran molekul oleh energi yang ditransfer kepadanya (foton bebas). Ingatlah bahwa energi selalu menghancurkan materi.
Sungguh menakjubkan betapa lama telah terjadi kontradiksi dalam logika dalam sains yang tidak diperhatikan oleh siapa pun.
Misalnya: “Sekarang kita tahu bahwa oksidator adalah zat yang memperoleh elektron, dan zat pereduksi adalah zat yang melepaskan elektron” (Ensiklopedia kimiawan muda, artikel “Reaksi redoks)”.
Dan di sana, dua paragraf di bawah ini: "Oksidan terkuat adalah arus listrik (aliran elektron bermuatan negatif)" (ibid.).
Itu. kutipan pertama mengatakan bahwa oksidan yang menerima elektron, dan yang kedua adalah oksidan yang menyerah.
Dan kesimpulan yang salah dan kontradiktif seperti itu membuat Anda menghafal di sekolah dan institut!
Diketahui bahwa oksidator terbaik adalah non-logam. Selain itu, semakin kecil bilangan periode dan semakin besar bilangan gugusnya, semakin jelas sifat-sifat zat pengoksidasi. Ini tidak mengherankan. Kami membahas alasannya dalam artikel yang ditujukan untuk analisis tabel periodik, di bagian kedua, di mana kami berbicara tentang warna nukleon. Dari kelompok 1 sampai 8, warna nukleon dalam unsur-unsur tersebut secara bertahap berubah dari ungu menjadi merah (jika kita juga memperhitungkan warna biru unsur d- dan f). Kombinasi partikel kuning dan merah memfasilitasi pelepasan foton bebas yang terakumulasi. Kuning menumpuk, tetapi bertahan dengan lemah. Dan yang merah berkontribusi pada dampaknya. Untuk melepaskan foton adalah proses oksidasi. Tetapi jika sebagian berwarna merah, maka tidak ada partikel yang mampu mengumpulkan foton. Itulah sebabnya unsur golongan 8, gas mulia, bukanlah agen pengoksidasi, tidak seperti tetangganya, halogen.
Pemulihan Merupakan proses kebalikan dari oksidasi. Saat ini, dalam sains, diyakini bahwa ketika suatu unsur kimia menerima elektron, ia tereduksi. Sudut pandang ini cukup bisa dimengerti (tapi tidak diterima). Saat mempelajari struktur unsur kimia, ditemukan bahwa mereka memancarkan elektron. Mereka menyimpulkan bahwa elektron adalah bagian dari unsur-unsur. Ini berarti bahwa transfer elektron ke suatu unsur adalah semacam pemulihan strukturnya yang hilang.
Namun, kenyataannya tidak demikian.
Elektron adalah foton bebas. Mereka bukan nukleon. Mereka bukan bagian dari tubuh elemen. Mereka tertarik, datang dari luar, dan menumpuk di permukaan nukleon dan di antara mereka. Tetapi akumulasinya sama sekali tidak mengarah pada pemulihan struktur suatu unsur atau molekul. Sebaliknya, foton-foton ini dipancarkan oleh eter (energi) mereka, melemahkan dan menghancurkan ikatan antar unsur. Dan ini adalah proses oksidasi, tetapi bukan reduksi.
Mengembalikan sebuah molekul, pada kenyataannya, adalah mengambil energi darinya (dalam hal ini, foton bebas), dan bukan berkomunikasi. Dengan mengambil foton, elemen pereduksi mengembunkan zat - mengembalikannya.
Agen pereduksi terbaik adalah logam. Sifat ini secara alami mengikuti komposisi kualitatif dan kuantitatifnya - Bidang Ketertarikannya adalah yang terbesar dan selalu ada banyak atau cukup partikel di permukaan warna biru.
Anda bahkan dapat menyimpulkan definisi logam berikut ini.
Logam Merupakan unsur kimia, yang lapisan permukaannya harus mengandung partikel biru.
DAN bukan metal - Ini adalah elemen dalam komposisi lapisan permukaan yang tidak ada atau hampir tidak ada foton biru, dan selalu ada yang berwarna merah.
Logam dengan tarikan kuatnya menghilangkan elektron dengan sempurna. Dan mereka adalah pemulih.
Mari kita berikan definisi konsep "keelektronegatifan", "keadaan oksidasi", "reaksi redoks", yang dapat ditemukan dalam buku teks tentang kimia.
« Status oksidasi - muatan kondisional sebuah atom dalam suatu senyawa, dihitung dengan asumsi bahwa atom hanya terdiri dari ion. Dalam mendefinisikan konsep ini, secara konvensional diasumsikan bahwa ikatan (valensi) elektron ditransfer ke atom yang lebih elektronegatif, dan oleh karena itu senyawanya terdiri dari ion bermuatan positif dan negatif. Bilangan oksidasi bisa nol, negatif atau positif, yang biasanya ditempatkan di atas simbol elemen di bagian atas.
Nilai nol bilangan oksidasi dikaitkan dengan atom unsur-unsur yang berada dalam keadaan bebas ... Nilai negatif bilangan oksidasi memiliki atom-atom yang menjadi tempat perpindahan awan elektron ikatan (pasangan elektron). Untuk fluor dalam semua senyawanya, nilainya -1. Atom yang menyumbangkan elektron valensi ke atom lain memiliki bilangan oksidasi positif. Misalnya, untuk logam alkali dan alkali tanah, nilainya adalah +1 dan +2. Dalam ion sederhana, ini sama dengan muatan ion. Pada kebanyakan senyawa, bilangan oksidasi atom hidrogen adalah + 1, tetapi dalam hidrida logam (senyawanya dengan hidrogen) dan lainnya adalah –1. Untuk oksigen, bilangan oksidasi adalah -2, tetapi, misalnya, dalam kombinasi dengan fluor akan menjadi +2, dan dalam senyawa peroksida -1. ...
Jumlah aljabar bilangan oksidasi atom dalam suatu senyawa adalah nol, dan dalam ion kompleks, muatan ion. ...
Bilangan oksidasi tertinggi adalah nilai positif tertingginya. Untuk sebagian besar unsur, ini sama dengan nomor golongan dalam tabel periodik dan merupakan karakteristik kuantitatif penting dari suatu unsur dalam senyawanya. Nilai bilangan oksidasi terkecil dari suatu unsur yang terjadi pada senyawanya biasanya disebut bilangan oksidasi terendah; sisanya adalah perantara "(Encyclopedic Dictionary of a Young Chemist, artikel" Oxidation State ").
Berikut adalah informasi dasar mengenai konsep ini. Ini terkait erat dengan istilah lain, elektronegativitas.
« Elektronegativitas Apakah kemampuan atom dalam molekul untuk menarik elektron ke dirinya sendiri, berpartisipasi dalam pembentukan ikatan kimia ”(Encyclopedic Dictionary of a Young Chemist, artikel“ Electronegativity ”).
“Reaksi redoks disertai dengan perubahan bilangan oksidasi atom yang menyusun reaktan, sebagai akibat pergerakan elektron dari atom salah satu reagen (agen pereduksi) ke atom lainnya. Reaksi reduksi oksidasi secara bersamaan terjadi oksidasi (pelepasan elektron) dan reduksi (penambahan elektron) "(Chemical Encyclopedic Dictionary, ed. Oleh IL Knunyants, artikel" Reaksi redoks ").
Menurut kami, ada banyak kesalahan yang tersembunyi dalam ketiga konsep ini.
Pertama-tama , kami percaya bahwa pembentukan ikatan kimia antara dua unsur sama sekali bukanlah proses sosialisasi elektronnya. Ikatan kimia adalah ikatan gravitasi. Elektron yang diduga terbang di sekitar nukleus adalah foton bebas yang terakumulasi di permukaan nukleon di dalam tubuh suatu unsur dan di antara mereka. Agar koneksi muncul antara dua elemen, foton bebasnya tidak perlu melapisi antar elemen. Ini tidak terjadi. Pada kenyataannya, elemen yang lebih berat menghilangkan (menarik) foton bebas dari yang lebih ringan, dan menyimpannya (lebih tepatnya, pada dirinya sendiri). Dan zona elemen yang lebih ringan, tempat foton ini diambil, sampai batas tertentu terekspos. Karena apa daya tarik di zona ini dimanifestasikan secara lebih luas. Dan elemen yang lebih ringan tertarik ke yang lebih berat. Begitulah cara ikatan kimia muncul.
Kedua Kimia modern melihat kemampuan unsur untuk menarik elektron ke dirinya sendiri terdistorsi - terbalik. Dipercaya bahwa semakin banyak elektronegativitas suatu unsur, semakin ia mampu menarik elektron ke dirinya sendiri. Dan fluor dengan oksigen dianggap paling baik - mereka menarik elektron orang lain. Serta elemen lain dari 6 dan 7 kelompok.
Nyatanya, pendapat ini tidak lebih dari khayalan belaka. Hal ini didasarkan pada kesalahpahaman bahwa semakin besar jumlah kelompok, semakin berat unsur-unsurnya. Dan juga, semakin besar muatan positif dari inti atom. Ini omong kosong. Para ilmuwan bahkan masih tidak repot-repot menjelaskan apa, dari sudut pandang mereka, yang merupakan "muatan". Sederhananya, seperti dalam numerologi, mereka menghitung semua elemen secara berurutan, dan meletakkan jumlah muatan sesuai dengan jumlahnya. Kenaikan yang bagus!
Juga jelas bagi seorang anak bahwa gas lebih ringan dari pada logam padat. Bagaimana dalam kimia dipercaya bahwa gas lebih baik dalam menarik elektron ke dirinya sendiri?
Logam padat, tentu saja, lebih baik dalam menarik elektron.
Ilmuwan kimia, tentu saja, dapat meninggalkan konsep "elektronegativitas" yang digunakan, karena konsep itu sangat umum. Namun, mereka harus mengubah artinya menjadi kebalikannya.
Elektronegativitas Adalah kemampuan suatu unsur kimia dalam suatu molekul untuk menarik elektron ke dirinya sendiri. Dan secara alami, logam memiliki kemampuan ini lebih baik daripada non-logam.
Adapun kutub listrik dalam molekul, memang, kutub negatif - Ini adalah elemen non-logam yang menyumbangkan elektron, dengan Medan Tarik yang lebih rendah. DAN positif - ini selalu merupakan elemen dengan sifat metalik yang lebih jelas, dengan bidang daya tarik yang luas.
Ayo tersenyum bersama.
Elektronegativitas - ini adalah upaya lain untuk mendeskripsikan kualitas unsur kimia, bersama dengan massa dan muatan yang sudah ada. Seperti yang sering terjadi, para ilmuwan dari bidang ilmu lain, dalam hal ini kimia, seolah-olah tidak mempercayai sesama fisikawannya, melainkan semata-mata karena setiap orang, yang melakukan penemuan, menempuh jalannya sendiri, dan tidak sekadar mengeksplorasi pengalaman orang lain.
Itu terjadi kali ini juga.
Massa dan muatan tidak membantu kimiawan memahami apa yang terjadi pada atom ketika mereka berinteraksi satu sama lain - dan elektronegativitas diperkenalkan - kemampuan suatu unsur untuk menarik elektron yang terlibat dalam pembentukan ikatan kimia. Harus diakui bahwa ide konsep ini dibuat dengan cukup tepat. Dengan satu-satunya amandemen yang mencerminkan realitas terbalik. Seperti yang telah kami katakan, yang terbaik adalah menarik elektron ke logam, dan bukan non-logam - karena kekhasan warna nukleon permukaan. Logam adalah agen pereduksi terbaik. Non-logam adalah zat pengoksidasi. Logam diambil, non-logam diberikan. Logam - Yin, bukan logam - Yang.
Esoterisisme membantu sains dalam memahami rahasia Alam.
Tentang bilangan oksidasi , maka ini merupakan upaya yang baik untuk memahami bagaimana distribusi elektron bebas terjadi di dalam senyawa kimia - molekul.
Jika suatu senyawa kimia homogen - yaitu sederhana, strukturnya terdiri dari unsur-unsur dengan jenis yang sama - maka semuanya benar, memang, bilangan oksidasi unsur mana pun dalam senyawa adalah nol. Karena tidak ada zat pengoksidasi dan tidak ada zat pereduksi dalam senyawa ini. Dan semua elemen memiliki kualitas yang sama. Tidak ada yang menghilangkan elektron, tidak ada yang memberikannya. Apakah itu zat padat, atau cairan, atau gas, tidak masalah.
Bilangan oksidasi, seperti elektronegativitas, menunjukkan kualitas unsur kimia - hanya dalam kerangka unsur kimia. Bilangan oksidasi dirancang untuk membandingkan kualitas unsur kimia dalam senyawa. Menurut kami, idenya bagus, tetapi implementasinya belum sepenuhnya memuaskan.
Kami secara kategoris menentang keseluruhan teori dan konsep struktur unsur kimia dan ikatan di antara mereka. Nah, jika hanya karena jumlah kelompok, menurut kami, harus lebih dari 8. Ini berarti seluruh sistem runtuh. Dan tidak hanya itu. Secara umum, menghitung jumlah elektron dalam atom "dengan satu tangan" tidaklah serius.
Sesuai dengan konsep saat ini, ternyata muatan konvensional terkecil diberikan ke oksidan terkuat - fluor memiliki muatan -1 di semua senyawa, oksigen -2 hampir di semua tempat. Dan untuk logam yang sangat aktif - alkali dan alkali tanah - muatan ini, masing-masing, +1 dan +2. Itu sama sekali tidak logis. Meskipun, kami ulangi, kami sangat memahami skema umum yang sesuai dengan apa yang telah dilakukan - semua demi 8 kelompok dalam tabel dan 8 elektron pada tingkat energi eksternal.
Minimal, nilai muatan halogen dan oksigen ini haruslah yang terbesar dengan tanda minus. Dan pada logam alkali dan alkali tanah itu juga besar, hanya dengan tanda plus.
Dalam setiap senyawa kimia ada unsur yang menyumbangkan elektron - pengoksidasi, non-logam, muatan negatif, dan unsur yang menyumbangkan elektron - zat pereduksi, logam, muatan positif. Dengan cara ini untuk membandingkan unsur-unsur, menghubungkannya satu sama lain dan mencoba untuk menentukan bilangan oksidasi mereka.
Namun, untuk mengetahui dengan cara ini bilangan oksidasi, menurut pendapat kami, tidak mencerminkan kenyataan secara akurat. Akan lebih tepat jika membandingkan keelektronegatifan unsur-unsur dalam suatu molekul. Bagaimanapun, keelektronegatifan hampir sama dengan bilangan oksidasi (ini mencirikan kualitas, hanya dari satu unsur).
Anda dapat mengambil skala elektronegativitas dan menuliskan nilainya dalam rumus untuk setiap elemen. Dan kemudian akan segera terlihat elemen mana yang melepaskan elektron dan mana yang lepas. Unsur yang elektronegativitasnya terbesar dalam senyawa - kutub negatif - menyumbangkan elektron. Dan orang yang keelektronegatifannya terkecil - kutub positif, mengambil elektron.
Jika ada, katakanlah, 3 atau 4 unsur dalam sebuah molekul, tidak ada yang berubah. Kami juga menempatkan nilai elektronegativitas dan membandingkan.
Namun, jangan lupa untuk menggambar model struktur molekulnya. Memang, dalam senyawa apa pun, jika tidak sederhana, yaitu tidak terdiri dari satu jenis unsur, logam dan non-logam dikaitkan satu sama lain, pertama-tama. Logam mengambil elektron dari non-logam dan mengikatnya. Dan dari satu unsur non-logam, elektron dapat diambil secara bersamaan dari 2 atau lebih unsur dengan sifat logam yang lebih jelas. Beginilah cara molekul kompleks muncul. Tetapi ini tidak berarti bahwa dalam molekul seperti itu unsur-unsur logam akan masuk ke dalam ikatan yang kuat satu sama lain. Mungkin mereka akan ditempatkan di sisi yang berlawanan satu sama lain. Jika dekat, mereka akan tertarik. Tetapi ikatan yang kuat terbentuk hanya jika satu unsur lebih logam daripada yang lain. Satu elemen harus memilih elektron - menghilangkannya. Jika tidak, elemen tidak akan terekspos - pembebasan dari foton bebas di permukaan. Field of Attraction tidak akan sepenuhnya memanifestasikan dirinya, dan tidak akan ada hubungan yang kuat. Itu topik yang kompleks - pendidikan ikatan kimia, dan kami tidak akan membahasnya secara detail di artikel ini.
Kami yakin bahwa kami telah membahas dengan cukup detail topik yang dikhususkan untuk analisis konsep "elektronegativitas", "bilangan oksidasi", "oksidasi" dan "reduksi", dan memberi Anda banyak informasi menarik.
Dari buku Guided Dreams penulis Mir ElenaPemulihan “Ketika satu atribut individualitas lahir, esensi dan kehidupan terbagi menjadi dua. Mulai sekarang, kecuali perdamaian akhir tercapai, esensi dan kehidupan tidak akan pernah bertemu lagi. " William, "Rahasia Bunga Emas" Setelah kuliah
Dari buku The Book of Secrets. Jelas luar biasa di Bumi dan sekitarnya penulis Vyatkin Arkady DmitrievichMasokisme sebagai vampir sukarela tingkat ekstrim Dalam pengertian ini, masokisme mirip dengan kodependensi. Masokis adalah orang yang menerima sensasi menyenangkan dari penderitaan fisik dan mental mereka sendiri. Dengan kata lain, mereka suka dipukul, dimarahi, diintimidasi
Dari buku Vampires in Russia. Semua yang perlu Anda ketahui tentang mereka! penulis Bauer AlexanderCara Menentukan Tingkat Kehilangan Darah Saat vampir meminum darah, dia meminum setengah liter hingga satu setengah liter darah sekaligus. Tubuh manusia hanya mengandung lima sampai enam liter darah, jadi kehilangan darah ini belum tentu mengancam nyawa. Namun, vampir bisa
Dari buku Modeling the Future in a Dream penulis Mir ElenaPemulihan Setelah lulus, bekerja sebagai insinyur di sebuah perusahaan tertutup, saya menyadari bahwa saya tidak berada di tempat saya, jadi saya memutuskan untuk mengubah profesi saya dan memasuki sekolah jazz improvisasi, dan kemudian departemen klasik di sekolah musik.
Dari buku The Golden Rules of Feng Shui. 10 langkah mudah menuju sukses, kesejahteraan dan umur panjang penulis Ogudin Valentin LeonidovichDerajat pengaruh negatif benda luar Benda luar memiliki pengaruh negatif terbesar, berada tepat di depan pintu masuk rumah. Tetapi semakin mereka ditempatkan pada suatu sudut ke pintu masuk, semakin lemah pengaruh mereka.
penulis Shure EduardGelar pertama: Memasak. Khotbah di Bukit dan Kerajaan Allah Pekerjaan Kristus dimulai dengan idil Galilea dan pengumuman tentang "kerajaan Allah". Prediksi ini mengarahkan kita pada ajaran populernya. Pada saat yang sama, itu adalah persiapan untuk lebih luhur
Dari buku Divine Evolution. Dari Sphinx sampai Kristus penulis Shure EduardTingkat inisiasi kedua (pemurnian). Penyembuhan ajaib. Terapi Kristen Dalam semua misteri kuno, persiapan moral dan intelektual diikuti dengan pemurnian jiwa, yang harus menghidupkan kembali organ-organ baru di dalamnya dan kemudian memberinya kemampuan.
Dari buku The Riddle of the Great Sphinx penulis Barbarene GeorgesPemulihan patung Usia sebenarnya dari Sphinx Agung berasal dari awal era Adam. Setidaknya dia sezaman dengan piramida, yang ansambelnya, seperti yang akan kita lihat, lengkap dengan dirinya sendiri. Gambar Sphinx Agung terungkap selama berabad-abad yang lalu
Dari buku Healing the Soul. 100 teknik meditasi, latihan penyembuhan dan relaksasi penulis Rajneesh Bhagwan ShriMengembalikan ritme ... Atur waktu yang sama untuk tidur - jika setiap malam pukul sebelas, lalu sebelas. Ini yang pertama: mulailah waktu tertentu, dan segera tubuh akan dapat memasuki ritme ini. Jangan ubah kali ini, jika tidak Anda akan membingungkan tubuh. Tubuh
penulis Kuzmishin E.L.Gelar Magang Masuk ke Gelar Magang Dekorasi kotak dan jubah Dinding dan langit-langit kotak harus digantung dengan kain biru dan putih tanpa penyepuhan. Di atas kepala Guru Pemuja ada sebuah segitiga yang dikelilingi oleh cahaya dengan nama yang tertulis di tengahnya
Dari buku Cagliostro dan Freemasonry Mesir penulis Kuzmishin E.L.Masuk ke Tingkat Magang Dekorasi Penginapan dan Jubah Dinding dan langit-langit Pondok harus digantung dengan kain biru dan putih tanpa penyepuhan. Di atas kepala Guru Pemuja ada segitiga yang dikelilingi oleh cahaya dengan nama "Yehuwa" tertulis di tengahnya, bersulam
Dari buku Autobiography of a Yogi penulis Yogananda ParamahansaBab 23 Saya Mendapatkan Gelar Universitas - Anda mengabaikan definisi filosofis dari buku teks Anda, pasti mengandalkan beberapa "intuisi" yang tidak mengganggu untuk memandu Anda melalui ujian Anda. Tetapi jika Anda tidak segera beralih ke metode yang lebih ilmiah, maka saya harus
Dari kitab Kabbalah. Dunia atas. Awal jalan penulis Laitman Michael7.5. Tingkat Kesadaran Jahat Seperti yang dijelaskan dalam artikel "Memberi Taurat," kesenangan dan kebahagiaan ditentukan oleh tingkat kesamaan dengan Sang Pencipta dalam properti, dan penderitaan dan ketidaksabaran ditentukan oleh tingkat perbedaan dari Sang Pencipta. Karena itu, keegoisan menjijikkan bagi kita dan menyakitkan yang tak tertahankan,
Pilihan 1
1. Tentukan bilangan oksidasi atom unsur kimia dalam senyawa berikut: HNO₃, NO₂, H₃N, SO₂, N₂O.
2. Dengan menggunakan tabel periodik, susun unsur-unsur berikut dalam urutan penurunan elektronegativitas: O, N, Be, B, Li, C. Tentukan lokasi fluor dan natrium dalam baris ini. Jelaskan jawabannya. 
3. Bagaimana bilangan oksidasi atom belerang berubah selama oksidasi SO₂ menjadi SO₃? Jelaskan jawabannya.
pilihan 2
1. Tentukan bilangan oksidasi atom unsur kimia dalam senyawa berikut: CO₂, H₃PO₄, SiH₄, P₂O₅, Mg₂Si.
2. Arah atom yang mana unsur kimianya umum pasangan elektronik, dalam molekul senyawa berikut: BF₃, PCl₃, CS₂, CCl₄, HBr? Berikan jawaban yang masuk akal.
3. Apakah bilangan oksidasi karbon berubah selama pembentukan asam karbonat H₂CO₃ dari karbon dioksida dan air? Jelaskan jawabannya.
Pilihan 3
1. Tentukan bilangan oksidasi atom unsur kimia dalam senyawa berikut: Cl₂, NaClO, CaCl₂, HF, SO₃, Cl₂O₇.
2. Menggunakan sistem periodik unsur kimia, susun unsur-unsur berikut dalam urutan naik keelektronegatifannya: P, Al, Cl, Na, S, Mg. Temukan tempat di baris ini untuk kalium dan fluorida. Jelaskan jawabannya. 
3. Bagaimana bilangan oksidasi karbon berubah setelah pembakaran metana CH мет dengan pembentukan karbon monoksida (IV) dan air? Jelaskan jawabannya.
Pilihan 4
1. Tentukan bilangan oksidasi atom unsur kimia dalam senyawa berikut: H₂SO₄, SO₂, NO₂, BF₃, H₂S.
2. Menuju atom-atom apa unsur kimia pasangan elektron umum dipindahkan dalam molekul senyawa berikut: H₂O, PCl₃, H₃N, H₂S, CO₂? Berikan jawaban yang masuk akal.
3. Apakah bilangan oksidasi atom berubah saat air terbentuk zat sederhana - hidrogen dan oksigen? Jelaskan jawabannya.


