Az elektronegativitás az a tulajdonság, hogy egy kémiai elem vonzza az elektronokat atomjához más elemek atomjaitól, amelyekkel ez az elem kémiai kötést képez a vegyületekben.
Amikor kémiai kötés jön létre a különböző elemek atomjai között, a közös elektronfelhő egy elektronegatívabb atomra vált át, amelynek következtében a kötés kovalensen polárissá válik, és az elektronegativitások nagy különbségével ionos.
A kémiai képletek írásakor figyelembe veszik az elektronegativitást: bináris vegyületekben a legelegonatívabb elem szimbóluma van mögötte.
Az elektronegativitás balról jobbra növekszik az egyes periódusok elemei esetében, és felülről lefelé csökken ugyanazon PS csoport elemei esetében.
Vegyérték elem az atomjainak tulajdonsága, hogy bizonyos számú más atomdal kombinálódjanak.
Különböztesse meg a sztöchiometrikus, az elektronikus valencia és a koordinációs számot. Csak a sztöchiometrikus vegyértéket vesszük figyelembe.
Sztöchiometrikus a vegyérték azt mutatja, hogy egy másik elem hány atomját köti össze ennek az elemnek az atomja. A vegyérték egységet hidrogén vegyértéknek tekintik, mivel a hidrogén mindig egyértékű. Például a HCl, H 2 O, NH 3 vegyületekben (az ammónia H 3 N helyes írásmódját már a modern tankönyvekben is használják) a CH 4 klór egyértékű, az oxigén kétértékű, a nitrogén háromértékű és a szén négyértékű.
Az oxigén sztöchiometriai vegyértéke általában 2. Mivel szinte minden elem vegyületeket képez az oxigénnel, célszerű ezt szabványként használni egy másik elem vegyértékének meghatározásához. Például a Na 2 O, CoO, Fe 2 O 3, SO 3 vegyületekben a nátrium egyértékű, a kobalt kétértékű, a vas háromértékű, a kén hat vegyértékű.
Redox-reakciókban fontos lesz számunkra az elemek oxidációs állapotainak meghatározása.
Oxidációs állapot egy anyag egy elemét sztöchiometrikus vegyértékének nevezzük, plusz vagy mínusz előjellel.
A kémiai elemeket elemekre bontják állandó vegyérték változó vegyértékű elemek.
1.3.3. Molekuláris és nem molekuláris szerkezetű anyagok. Kristályrács típusú. Az anyagok tulajdonságainak függése azok összetételétől és szerkezetétől.
A vegyületek természeti állapotától függően molekulárisra és nem molekulárisra oszthatók. BAN BEN molekuláris anyagok A legkisebb szerkezeti részecskék a molekulák. Ezeknek az anyagoknak molekuláris kristályrácsuk van. Nem molekuláris anyagokban a legkisebb szerkezeti részecskék atomok vagy ionok. Kristályrácsuk atomi, ionos vagy fémes.
A kristályrács típusa nagymértékben meghatározza az anyagok tulajdonságait. Például fémek fém típusú kristályrács, különböznek az összes többi elemtől nagy plaszticitás, elektromos és hővezető képesség... Ezek a tulajdonságok, csakúgy, mint sok más - alakíthatóság, fémes fény, stb. a fématomok közötti speciális típusú kötés miatt - fém csatlakozás. Meg kell jegyezni, hogy a fémekben rejlő tulajdonságok csak kondenzált állapotban jelennek meg. Például a gáz halmazállapotú ezüstnek nincsenek a fémek fizikai tulajdonságai.
A fémek speciális kötése - a fém - a valencia elektronok hiányának tudható be, ezért közösek a fém teljes szerkezetén. A fémek szerkezetének legegyszerűbb modellje azt feltételezi, hogy a fémek kristályrácsa szabad elektronokkal körülvett pozitív ionokból áll, az elektronok mozgása kaotikusan megy végbe, mint a gázmolekulák. Ez a modell, bár kvalitatívan magyarázza a fémek számos tulajdonságát, a mennyiségi ellenőrzés során elégtelennek bizonyul. A fémes állapot elméletének továbbfejlesztése vezetett létre a fémek zónaelmélete, amely a kvantummechanika fogalmain alapszik.
A kristályrács csomópontjaiban kationok és fématomok találhatók, és az elektronok szabadon mozognak a kristályrács mentén.
A fémek jellemző mechanikai tulajdonsága az műanyag, kristályaik belső szerkezetének sajátosságai miatt. A plaszticitás alatt a külső erők hatására lévő testek azon képességét kell deformálni, amely a külső hatás megszűnése után is megmarad. A fémek ezen tulajdonsága lehetővé teszi, hogy kovácsolás közben különböző formákká formálják őket, lapokká tekerjék vagy huzallá húzzák.
A fémek plaszticitása annak köszönhető, hogy külső hatással a kristályrácsot alkotó ionrétegek egymáshoz képest eltörés nélkül eltolódnak. Ez annak a ténynek az eredményeként következik be, hogy az elmozdult elektronok a szabad újraelosztás következtében továbbra is kommunikálnak az ionrétegek között. Atomrácsos szilárd anyag mechanikai hatása alatt az egyes rétegek elmozdulnak, és a köztük lévő tapadás szakadás miatt megszakad kovalens kötések.
ionok, akkor ezek az anyagok képződnek ionos típusú kristályrács.

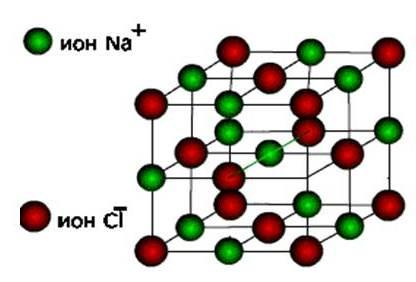
Ezek sók, valamint tipikus fémek oxidjai és hidroxidjai. Ezek kemény, törékeny anyagok, de legfőbb minőségük : ezen vegyületek oldatai és olvadékai elektromos áramot vezetnek.
Ha a kristályrács helyei vannak atomok, akkor ezek az anyagok képződnek atom típusú kristályrács(gyémánt, bór, alumínium és szilícium szilícium-oxidjai). Nagyon kemény és tűzálló tulajdonságú, vízben nem oldódik.
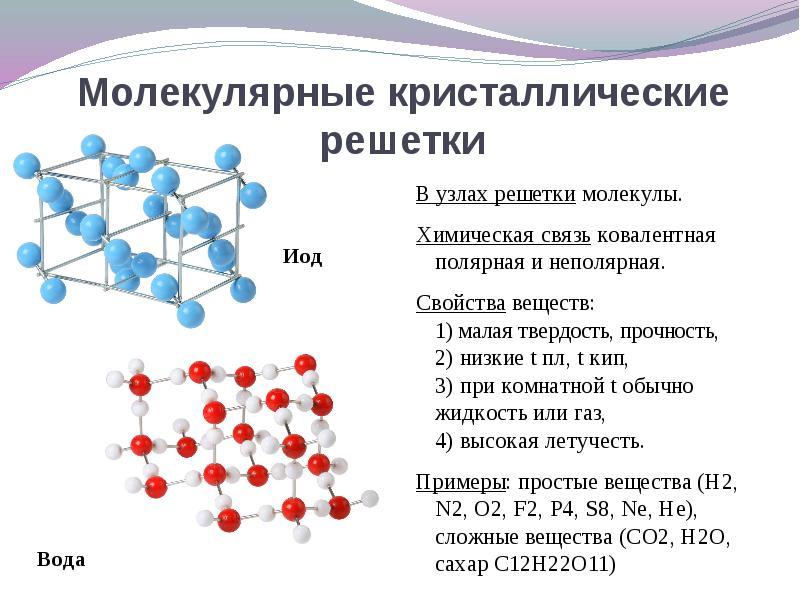
Ha a kristályrács helyei vannak molekulák, akkor ezek az anyagok képződnek (normál körülmények között gázok és folyadékok: О 2, HCl; I 2 szerves anyag).
Érdekes megjegyezni a fémgalliumot, amely 30 o C hőmérsékleten olvad. Ezt az anomáliát azzal magyarázzák, hogy a Ga 2 molekulák a kristályrács csomópontjaiban helyezkednek el, és tulajdonságai, amelyek hasonlóvá válnak a molekuláris kristályrácsos anyagokkal.
Példa.A csoport összes nemfémje nem molekuláris felépítésű:
1) szén, bór, szilícium; 2) fluor, bróm, jód;
3) oxigén, kén, nitrogén; 4) klór, foszfor, szelén.
Nem molekuláris anyagokban a legkisebb szerkezeti részecskék atomok vagy ionok. Kristályrácsuk atomi, ionos vagy fémes
Mikor döntés ezt a kérdést könnyebb fordítva fordítani. Ha a kristályrács helyei vannak molekulák, akkor ezek az anyagok képződnek a kristályrács molekuláris típusa(normál körülmények között gázok és folyadékok: O 2, HCl; I 2 is, rombikus kén S 8, fehér foszfor P 4, szerves anyagok). Tulajdonságaik szerint törékeny, alacsony olvadáspontú vegyületek.
A második válaszban fluorgáz, a harmadikban oxigén- és nitrogéngáz, a negyedikben klórgáz található. Ez azt jelenti, hogy ezeknek az anyagoknak molekuláris kristályrácsuk és molekulaszerkezete van.
BAN BEN első A válasz az, hogy minden anyag normál körülmények között szilárd vegyület, és atomrácsot képez, ami azt jelenti, hogy nem molekuláris szerkezetűek.
Helyes válasz:1) szén, bór, szilícium
- A legkevésbé elektronegatív kémiai elem az
- vas
- magnézium
- kalcium
Figyelmet kell fordítani a "legkevésbé elektronegatív" kifejezésre, vagyis a legnagyobb fémes tulajdonságokkal rendelkező elemre. Ez az érv lehetővé teszi számunkra, hogy kizárjuk a nitrogént a lehetséges válaszokból, mint nemfémet, és a kalciumra koncentráljunk, mint a legaktívabbra a feladatban javasolt fémek közül. Válasz: 4.
- A legpolárisabb kémiai kötés az egyik molekulában
- CCl 4
- CBr 4
Az elektronegativitás változásainak törvényszerűségeinek ismerete a periódusos rendszer periódusaiban és csoportjaiban a D.I. Válasz: 2.
- A hidrogén-klorid és a klór molekuláiban a kémiai kötés, ill
- ionos és kovalens poláris
- ionos és kovalens nem poláros
- kovalens poláris és kovalens nem poláris
- hidrogénatom és kovalens, nem poláros
A feladat gyors és megfelelő elvégzésének kulcsszava az "ennek megfelelően". A javasolt változatokban a válaszok közül csak az egyik a "kovalens poláris" szavakkal kezdődik, vagyis a hidrogén-kloridra jellemző kötés. Válasz: 3.
- A mangán oxidációs állapota egy olyan vegyületben, amelynek képlete K2 MnO4
Az elemek oxidációs állapotának a képlettel történő kiszámításának szabályainak ismerete lehetővé teszi a helyes válasz kiválasztását. Válasz: 3.
- A sóban lévő kén oxidációs állapota a legalacsonyabb
- kálium-szulfát
- kálium-szulfit
- kálium-szulfid
- kálium-hidrogén-szulfát
Nyilvánvaló, hogy ennek a feladatnak a gyors elvégzését megkönnyíti a sók nevének képletté történő fordítása. Mivel a kén a VIA csoport eleme, a legalacsonyabb oxidációs állapota -2. Ez az érték megfelel egy K 2 S - kálium-szulfid képletű vegyületnek. Válasz: 3.
- Az oxidációs állapot +5, amelyet a klóratom tartalmaz az ionban
- C1O - 4
- C1O -
- C1O - 3
- C1O - 2
Ennek a feladatnak a végrehajtása során figyelni kell arra, hogy ebben az állapotban nem elektromosan semleges vegyületeket adnak, hanem klórionokat egységnyi negatív töltéssel ("-"). Mivel az atomokban az atomok oxidációs állapotainak összege megegyezik az ion töltésével, a kívánt ionban lévő összes negatív oxigénatom töltésének értéke -6 (+5 - 6 \u003d -1). Válasz: 3.
- Az oxidációs állapot -3 nitrogén mindkét vegyületben van
- NF 3 és NH 3
- NH4Cl és N2O3
- NH4Cl és NH3
- HNO 2 és NF 3
A helyes válasz meghatározásához mentálisan fel kell osztani a válaszlehetőségeket a bal és a jobb aloszlopokra. Ezután válassza ki azt, amelyben a vegyületek összetétele egyszerűbb - esetünkben ez a bináris vegyületek jobb aloszlopa. Az elemzés lehetővé teszi számunkra a 2. és a 4. válasz kizárását, mivel oxidban és fluoridban a nitrogén pozitív oxidációs állapotú, mint egy kevésbé elektronegatív elem. Ez az érv lehetővé teszi számunkra, hogy kizárjuk az 1. választ, mivel az első anyag benne ugyanaz a nitrogén-fluorid. Válasz: 3.
- Anyagokra molekuláris szerkezete nem alkalmazható
- szén-dioxid
- metán
- hidrogén klorid
- kálcium-karbonát
Figyelnie kell a megbízás feltételeiben rejlő negatív megítélésre. Mivel normál körülmények között a gáz halmazállapotú anyagok molekuláris kristályrácsának szilárd állapotban vannak, az 1-3. Lehetőségek nem felelnek meg a feladat feltételének. A kalcium-karbonát sókhoz való hozzárendelése ismét megerősíti a helyes választ. Válasz: 4.
- Helyesek-e a következő ítéletek az anyagok tulajdonságairól és szerkezetéről?
A. A nedves ruhanemű fagyban szárad, mert a molekulaszerkezetű anyagok képesek szublimálódni (szublimálni).
B. A nedves ruhanemű szárad a hidegben, mert a vízmolekulák alacsony molekulatömegűek.
- csak A igaz
- csak B igaz
- mindkét ítélet helyes
- mindkét ítélet nem helyes
Tudás fizikai tulajdonságok a molekulaszerkezetű anyagok lehetővé teszik annak eldöntését, hogy a nedves ruhák hidegben történő száradásának oka a jég szublimációs képessége, és nem a vízmolekulák dipólusszerkezete. Válasz: 1.
- Mindegyik anyag molekuláris felépítésű, amelynek képleteit a sorozatban adjuk meg
- CO 2, HNO 3, CaO
- Na2S, Br2, NO2
- H2S04, Cu, O3
- SO 2, 12, HCl
Mivel a javasolt lehetőségek három-három anyagot tartalmaznak, logikus ezeket a lehetőségeket mentálisan három függőleges oszlopra osztani. Mindegyik elemzése, egy egyszerűbb összetételű anyagokkal (középső oszlop) kezdve, kiküszöböli a 3. választ, mivel rézfémet tartalmaz, amelynek fémkristályos rácsa van. A jobb oldali oszlop hasonló elemzése lehetővé teszi számunkra, hogy kizárjuk az 1. választ, mivel alkáliföldfém-oxidot (ionrácsot) tartalmaz. A két hátralévő lehetőség közül a 2. lehetőséget ki kell zárni, mivel alkálifémsót - nátrium-szulfidot (ionrács) tartalmaz. Válasz: 4.
Önálló tanulási feladatok
- Az oxidációs állapot +5 nitrogén van a vegyületben, amelynek képlete:
- N 2 O 5
- N 2 O 4
- N 2 O
- A króm oxidációs állapota egy (NH 4) 2 Cr 2 O 7 képletű vegyületben
- A nitrogén oxidációs állapota számos olyan anyagban csökken, amelyek képletei
- NH3, NO2, KNO3
- N 2 O 4, KNO 2, NH 4 Cl
- N2, N20, NH3
- HNO 3, HNO 2, NO 2
- A klór oxidációs állapota számos olyan anyagban növekszik, amelyek képletei
- НСlO, НСlO 4, КСlO 3
- Сl 2, С1 2 O 7, КСlO 3
- Ca (C1O) 2, KCl03, HCl04
- КСl, КСlO 3, КСlO
- A legpolárisabb kémiai kötés a molekulában
- ammónia
- hidrogén-szulfid
- hidrogén-bromid
- hidrogén-fluorid
- Kovalens, nem poláros kötéssel rendelkező anyag
- fehér foszfor
- alumínium-foszfid
- foszfor (V) -klorid
- kalcium-foszfát
- A csak ionos kötést tartalmazó anyagok képleteit írják a sorba
- nátrium-klorid, foszfor (V) -klorid, nátrium-foszfát
- nátrium-oxid, nátrium-hidroxid, nátrium-peroxid
- szén-diszulfid, kalcium-karbid, kalcium-oxid
- kalcium-fluorid, kalcium-oxid, kalcium-klorid
- Az atomi kristályrácsnak van
- nátrium-oxid
- kalcium-oxid
- kén (IV) -oxid
- alumínium-oxid
- Ionikus kapcsolat kristályrács klór kölcsönhatásával képződik
- foszfor
- bárium
- hidrogén
- szürke
- Helyesek-e a következő ítéletek az ammónium-kloridról?
A. Ammónium-klorid - ionos szerkezetű anyag, amely kovalens poláris és ionos kötések miatt keletkezik.
B. Ammónium-klorid - ionos szerkezetű anyag, ezért szilárd, tűzálló és nem illékony.
- csak A igaz
- csak B igaz
- mindkét ítélet helyes
- mindkét ítélet téves
08. Elektronegativitás, oxidációs állapot, oxidáció és redukció
Beszéljük meg a kémia területén létező, és - mint a tudományban gyakran előfordul - meglehetősen érdekes és fejjel lefelé használt fogalmak jelentését. Szó lesz az "elektronegativitásról", az "oxidációs állapotról" és a "redoxreakciókról".
Mit jelent ez - a fogalmat fejjel lefelé használják?
Megpróbálunk fokozatosan mesélni róla.
Elektronegativitás megmutatja nekünk egy kémiai elem redox tulajdonságait. Vagyis az a képessége, hogy szabad fotonokat vegyen vagy adjon. És azt is, hogy ez az elem energiaforrás vagy energiaelnyelő (éter). Yang vagy Yin.
Oxidációs állapot Hasonló koncepció az elektronegativitáshoz. Jellemzi az elem redox tulajdonságait is. De a következő különbség van közöttük.
Az elektronegativitás egyetlen elemet jellemez. Önmagában azon kívül, hogy bármilyen kémiai vegyület összetételében megtalálná. Míg az oxidációs állapot pontosan akkor jellemzi redox képességét, amikor az elem egy molekula része.
Beszéljünk egy kicsit arról, hogy mi az oxidációs képesség és mi a helyreállítás képessége.
Oxidáció A szabad fotonok (elektronok) egy másik elemre történő átvitelének folyamata. Az oxidáció egyáltalán nem az elektronok eltávolítása, ahogy ma a tudományban hitték ... Amikor egy elem oxidál egy másik elemet, úgy viselkedik, mint a sav vagy az oxigén (innen származik az "oxidáció" név). Az oxidáció azt jelenti, hogy hozzájárulunk az elemek elpusztításához, bomlásához, elégetéséhez ... Az oxidáció képessége az a képesség, hogy a rájuk átvitt energia (szabad fotonok) révén a molekulákat elpusztítja. Ne feledje, hogy az energia mindig elpusztítja az anyagot.
Elképesztő, mióta vannak olyan ellentmondások a logikában a tudományban, amelyeket senki sem vett észre.
Például: „Most már tudjuk, hogy az oxidálószer olyan anyag, amely elektronokat szerez, a redukálószer pedig olyan anyag, amely ezeket eladja” (Egy fiatal vegyész enciklopédiája, „Redox-reakciók” cikk).
És ott, az alábbi két bekezdés: "A legerősebb oxidálószer az elektromos áram (negatív töltésű elektronok áramlása)" (uo.).
Azok. az első idézet szerint az oxidálószer az, amely elfogadja az elektronokat, a második pedig az az oxidálószer, amely feladja.
Az ilyen téves, ellentmondásos következtetések pedig emlékezetessé teszik az iskolákban és intézetekben!
Ismeretes, hogy a legjobb oxidálószerek a nemfémek. Sőt, minél kisebb az időszak száma és minél nagyobb a csoport száma, annál hangsúlyosabbak az oxidálószer tulajdonságai. Ez nem meglepő. Ennek okait a periódusos rendszer elemzésének szentelt cikkünkben tárgyaltuk, a második részben, ahol a nukleonok színéről beszéltünk. Az 1–8. Csoportból az elemek nukleonjainak színe fokozatosan változik ibolyáról vörösre (ha figyelembe vesszük a d– és f-elemek kék színét is). A sárga és a vörös részecskék kombinációja megkönnyíti a felhalmozódott szabad fotonok felszabadulását. A sárgák felhalmozódnak, de gyengén megmaradnak. És a pirosak hozzájárulnak a hatáshoz. A fotonok leadása az oxidációs folyamat. De amikor néhány vörös, akkor nincsenek részecskék, amelyek képesek fotonokat felhalmozni. Éppen ezért a 8. csoport elemei, a nemesgázok nem oxidálószerek, a szomszédaikkal ellentétben, a halogének.
Felépülés Az oxidációval ellentétes folyamat. Manapság a tudományban úgy gondolják, hogy amikor egy kémiai elem elektronokat fogad, redukálódik. Ez a nézőpont érthető (de nem elfogadott). A kémiai elemek szerkezetének tanulmányozása során kiderült, hogy ezek elektronokat bocsátanak ki. Arra a következtetésre jutottak, hogy az elektronok az elemek részei. Ez azt jelenti, hogy az elektronok átvitele egy elemhez egyfajta helyreállítása elveszett szerkezetének.
A valóságban azonban ez nem így van.
Az elektronok szabad fotonok. Nem nukleonok. Nem részei az elem testének. Vonzódnak, kívülről jönnek, és felhalmozódnak a nukleonok felszínén és közöttük. De felhalmozódásuk egyáltalán nem vezet egy elem vagy egy molekula szerkezetének helyreállításához. Éppen ellenkezőleg, ezek az éterük (energiájuk) által kibocsátott fotonok gyengítik és elpusztítják az elemek közötti kötelékeket. Ez pedig oxidációs folyamat, de nem redukció.
A molekula helyreállítása valójában azt jelenti, hogy energiát veszünk belőle (ebben az esetben szabad fotonokat), és nem közöljük. A fotonok felvételével a redukáló elem kondenzálja az anyagot - helyreállítja.
A legjobb redukálószerek a fémek. Ez a tulajdonság természetesen kvalitatív és kvantitatív összetételükből következik - vonzáskörük a legnagyobb, és mindig sok vagy elegendő részecske van a felszínen kék színű.
Még a fémek következő meghatározására is következtethet.
Fém Kémiai elem, amelynek felületi rétegeinek kék részecskéket kell tartalmazniuk.
A nem fém - Ez a felületi rétegek összetételének olyan eleme, amelynek kék fotonjai nincsenek vagy csaknem vannak, és mindig vannak vörösek.
A fémek erős vonzerővel tökéletesen elveszik az elektronokat. Tehát restaurátorok.
Adjunk meghatározást az "elektronegativitás", az "oxidációs állapot", a "redoxireakciók" fogalmairól, amelyek megtalálhatók a kémiai tankönyvekben.
« Oxidációs állapot - egy vegyületben lévő atom feltételes töltése, feltételezve, hogy csak ionokból áll. Ennek a fogalomnak a meghatározásakor hagyományosan azt feltételezik, hogy a kötő (valencia) elektronok több elektronegatív atomra kerülnek át, és ezért a vegyületek mintha pozitív és negatív töltésű ionokból állnának. Az oxidációs állapot lehet nulla, negatív vagy pozitív, amelyet általában az elem szimbóluma felett helyeznek el a tetején.
Az oxidációs állapot nulla értékét a szabad állapotban lévő elemek atomjainak tulajdonítják ... Az oxidációs állapot negatív értékében vannak azok az atomok, amelyek felé a kötő elektronfelhő (elektronpár) elmozdul. A fluor minden vegyületében -1. Azok az atomok, amelyek valencia elektronokat adnak más atomoknak, pozitív oxidációs állapotúak. Például alkáliföld- és alkáliföldfémeknél ez +1, illetve +2. Egyszerű ionokban egyenlő az ion töltésével. A legtöbb vegyületben a hidrogénatomok oxidációs állapota + 1, de a fémhidridekben (ezek vegyületei hidrogénnel) és másokban –1. Az oxigén esetében az oxidációs állapot -2, de például fluorral kombinálva +2, a peroxid-vegyületeknél -1. ...
A vegyületek atomjainak oxidációs állapotainak algebrai összege nulla, és egy komplex ionban az ion töltése. ...
A legmagasabb oxidációs állapot a legmagasabb pozitív értéke. A legtöbb elem esetében megegyezik a periódusos rendszer csoportszámával, és fontos mennyiségi jellemzője egy elemnek a vegyületeiben. A vegyületekben előforduló elemek oxidációs állapotának legkisebb értékét általában a legalacsonyabb oxidációs állapotnak nevezzük; az összes többi köztes "(Egy fiatal vegyész enciklopédikus szótára," Oxidációs állapot "cikk).
Itt vannak az alapvető információk erről a koncepcióról. Szorosan összefügg egy másik kifejezéssel, az elektronegativitással.
« Elektronegativitás - ez az a képesség, hogy egy molekula atomja vonzza a kémiai kötés kialakulásában részt vevő elektronokat.
„A redox-reakciók együtt járnak a reaktánsokat alkotó atomok oxidációs állapotának változásával, amelynek eredményeként az elektronok az egyik reagens (redukálószer) atomjától a másik atomjáig mozognak. Az oxidációs-redukciós reakciók egyszerre fordulnak elő oxidációval (elektronok felszabadulása) és redukcióval (elektronok hozzáadása) "(Chemical Encyclopedic Dictionary, szerk. IL Knunyants," Redox-reakciók "cikk).
Véleményünk szerint ebben a három fogalomban sok hiba rejlik.
Először , úgy gondoljuk, hogy a kémiai kötés kialakulása két elem között egyáltalán nem az elektronjaik szocializációjának folyamata. A kémiai kötés gravitációs kötés. Az állítólag a sejt körül repülõ elektronok szabad fotonok, amelyek az elem testében és közöttük a nukleonok felszínén halmozódnak fel. Ahhoz, hogy kapcsolat létrejöjjön két elem között, szabad fotonjaiknak nem kell az elemek között lebegniük. Ez nem történik meg. Valójában a nehezebb elem eltávolítja (vonzza) a szabad fotonokat a könnyebbikről, és megtartja azokat (pontosabban önmagában). És az öngyújtó elem zónája, ahonnan ezeket a fotonokat eltávolították, többé-kevésbé csupasz lesz. Miatt nyilvánul meg nagyobb mértékben a vonzás ebben a zónában. A könnyebb elem pedig a nehezebbhez vonzódik. Így keletkezik a kémiai kötés.
Másodszor , a modern kémia az elemek azon képességét, hogy torzan - fejjel lefelé vonzzák magukhoz az elektronokat. Úgy gondolják, hogy minél nagyobb egy elem elektronegativitása, annál inkább képes elektronokat magához vonzani. Állítólag a fluor és az oxigén teszi ezt a legjobban - vonzzák mások elektronjait. Valamint 6 és 7 csoport egyéb elemei.
Valójában ez a vélemény nem más, mint téveszme. Tévhiten alapszik, hogy minél nagyobb a csoportszám, annál nehezebbek az elemek. És, annál nagyobb a mag pozitív töltése. Ez baromság. A tudósok még mindig nem veszik a fáradságot, hogy elmagyarázzák, mi az ő nézőpontjuk szerint "töltés". Egyszerűen, mint a numerológiában, az összes elemet sorrendben megszámolták, és a számnak megfelelően letették a töltés összegét. Remek túra!
A gyermek számára is világos, hogy a gáz könnyebb, mint a sűrű fém. Hogyan lehet az, hogy a kémia területén azt gondolják, hogy a gázok jobban vonzzák magukhoz az elektronokat?
Sűrű fémek természetesen jobban vonzzák az elektronokat.
A vegyész tudósok természetesen meg tudják tartani az "elektronegativitás" kifejezést, mivel ez annyira elterjedt. Jelentésüket azonban pont az ellenkezőjére kell változtatniuk.
Elektronegativitás A molekulában lévő kémiai elem képes-e elektronokat magához vonzani? Természetesen ez a képesség jobban kifejeződik a fémekben, mint a nem fémekben.
Ami a molekula elektromos pólusait illeti, negatív pólus - ezek nem fém elemek, amelyek adományoznak elektronokat, alacsonyabb vonzóterekkel. A pozitív - ezek mindig hangsúlyosabb fémes tulajdonságokkal rendelkező elemek, nagy vonzerővel.
Mosolyogjunk együtt.
Elektronegativitás - ez egy újabb, újabb kísérlet egy kémiai elem minőségének leírására, a már meglévő tömeggel és töltettel együtt. Mint gyakran előfordul, a tudomány egy másik tudományterületéről, jelen esetben a kémiai tudósokról, mintha nem bíznának fizikus társaikban, sokkal inkább egyszerűen azért, mert bárki, aki felfedezéseket tesz, a saját útját járja, és nem csak mások tapasztalatait kutatja.
Ezúttal is megtörtént.
A tömeg és a töltés nem tett semmit ahhoz, hogy a vegyészek megértsék, mi történik az atomokban, amikor kölcsönhatásba lépnek egymással - és bevezették az elektronegativitást -, hogy egy elem képes vonzani a kémiai kötés kialakulásában részt vevő elektronokat. El kell ismerni, hogy e koncepció ötlete meglehetősen helyesen van lefektetve. Az egyetlen módosítással, amely fejjel lefelé tükrözi a valóságot. Mint már említettük, a legjobb, ha az elektronokat a fémekhez vonzzuk, és nem a nem fémekhez - a felszíni nukleonok színének sajátosságai miatt. A fémek a legjobb redukálószerek. A nemfémek oxidálószerek. Fémeket visznek el, nem fémeket adnak el. Fémek - Yin, nemfémek - Yang.
Az ezotéria a tudomány segítségére szolgál a Természet titkainak megértésében.
Vonatkozó oxidációs állapot , akkor ez jó kísérlet arra, hogy megértsük, hogyan történik a szabad elektronok eloszlása \u200b\u200begy kémiai vegyületben - egy molekulában.
Ha egy kémiai vegyület homogén - vagyis egyszerű, szerkezete azonos típusú elemekből áll -, akkor minden helyes, sőt, a vegyület bármely elemének oxidációs állapota nulla. Mivel ez a vegyület nem tartalmaz oxidálószert és redukálószert sem. És minden elem azonos minőségű. Senki sem veszi el az elektronokat, senki sem adja el. Akár sűrű anyag, akár folyadék, akár gáz, nem számít.
Az oxidációs állapot, akárcsak az elektronegativitás, a kémiai elem minőségét mutatja - csak egy kémiai elem keretein belül. Az oxidációs állapot célja a vegyületben lévő kémiai elemek minőségének összehasonlítása. Véleményünk szerint az ötlet jó, de megvalósítása nem teljesen kielégítő.
Kategorikusan ellenezzük a kémiai elemek szerkezetének elméletét és koncepcióját, valamint a köztük lévő kötelékeket. Nos, már csak azért is, mert elképzeléseink szerint a csoportok száma meghaladja a 8-at. Ez azt jelenti, hogy az egész rendszer összeomlik. És nem csak. Általában az atomokban lévő elektronok számának "egyrészt" számlálása valahogy nem komoly.
A jelenlegi koncepció szerint kiderül, hogy a legkisebb hagyományos töltést a legerősebb oxidáló szerekhez rendelik - a fluor töltése -1 minden vegyületben, az oxigén szinte mindenütt -2. A nagyon aktív fémeknél - alkáli és alkáliföldfémeknél - ezek a töltések +1, illetve +2. Egyáltalán nem logikus. Bár megismételjük, nagyon jól megértjük azt az általános sémát, amelynek megfelelően ez megtörtént - mindezt a táblázatban szereplő 8 csoport és a külső energia szintjén lévő 8 elektron érdekében.
Legalábbis ezeknek a halogének és oxigén töltéseinek értékének a legnagyobbnak kellett volna lennie mínusz előjellel. Az alkáli- és alkáliföldfémekben pedig szintén nagy, csak plusz jellel.
Bármilyen kémiai vegyület vannak olyan elemek, amelyek elektront adnak - oxidálószerek, nemfémek, negatív töltés, és olyan elemek, amelyek elektront adnak - redukálószerek, fémek, pozitív töltés. Ilyen módon hasonlítják össze az elemeket, kapcsolják össze őket egymással, és próbálják meghatározni oxidációs állapotukat.
Az oxidációs állapot ilyen módon történő megismerése véleményünk szerint azonban nem tükrözi pontosan a valóságot. Helyesebb lenne összehasonlítani egy molekula elemeinek elektronegativitását. Végül is az elektronegativitás majdnem megegyezik az oxidációs állapottal (csak egyetlen elem minőségét jellemzi).
Megveheti az elektronegativitás skáláját, és az egyes elemek képletében leírhatja értékeit. És akkor azonnal látható lesz, hogy mely elemek adják fel az elektronokat, és melyek veszik el. Az az elem, amelynek elektronegativitása a vegyületben a legnagyobb - a negatív pólus, elektront adományoz. És akinek az elektronegativitása a legkisebb - a pozitív pólus, az elektronokat vesz fel.
Ha mondjuk 3 vagy 4 elem van egy molekulában, akkor semmi sem változik. Tesszük az elektronegativitás értékeit és összehasonlítjuk is.
Azonban nem szabad elfelejteni, hogy rajzoljon egy modellt a molekula szerkezetéről. Valójában bármely vegyületben, ha nem egyszerű, vagyis nem egy elemtípusból áll, elsősorban a fémek és a nemfémek kapcsolódnak egymáshoz. A fémek elektronokat vesznek el a nemfémektől és kötődnek hozzájuk. És 2 vagy több, kifejezettebb fémes tulajdonságú elemből álló elektronok egyszerre elvehetik a nem fém egyik elemét. Így keletkezik egy összetett, összetett molekula. De ez nem azt jelenti, hogy egy ilyen molekulában a fém elemek erős kötődésbe lépnek egymással. Talán egymás ellentétes oldalán helyezkednek el. Ha ezután következik, vonzani fogják őket. De erős kötés csak akkor jön létre, ha az egyik elem fémesebb, mint a másik. Elengedhetetlen, hogy egy elem kiválasztja az elektronokat - eltávolítsa őket. Ellenkező esetben az elem nem lesz kitéve - felszabadulás a szabad fotonoktól a felszínen. A vonzásmező nem fog teljesen megnyilvánulni, és nem lesz szoros kapcsolat. azt összetett téma - oktatás kémiai kötések, és ebben a cikkben nem részletezzük ezt.
Úgy gondoljuk, hogy kellő részletességgel lefedtük az "elektronegativitás", az "oxidációs állapot", az "oxidáció" és a "redukció" fogalmainak elemzésével foglalkozó témakört, és sok érdekes információt szolgáltattunk Önnek.
Az Irányított álmok című könyvből szerző Mir ElenaHelyreállítás „Amikor az individualizáció egyetlen jele megszületik, a lényeg és az élet két részre oszlik. Mostantól kezdve, hacsak nem érik el a végső békét, a lényeg és az élet soha többé nem látja egymást. " William, "Az arany virág titka" az egyetem után
A Titkok könyve könyvből. A hihetetlen nyilvánvaló a Földön és azon túl szerző Vjatkin Arkagyij DmitrievichA mazochizmus, mint az önkéntes vámpírság rendkívüli foka Ebben az értelemben a mazochizmus hasonló a függőséghez. A mazochisták olyan emberek, akik kellemes érzéseket kapnak saját testi és lelki szenvedéseiktől. Más szavakkal, szeretik, ha megverik, szidják, zaklatják őket
A vámpírok Oroszországban című könyvből. Minden, amit tudnod kell róluk! szerző Bauer SándorHogyan lehet meghatározni a vérveszteség szintjét Amikor egy vámpír vért iszik, fél liter - másfél liter vért iszik egyszerre. Az emberi test csak öt-hat liter vért tartalmaz, így az ilyen vérveszteség nem feltétlenül életveszélyes. Egy vámpír azonban képes
A jövő modellezése álomban című könyvből szerző Mir ElenaGyógyulás Érettségi után, mérnökként dolgoztam egy zárt vállalkozásban, rájöttem, hogy nem vagyok a helyemben, ezért úgy döntöttem, hogy hivatást váltok, és beléptem az improvizáció jazziskolájába, majd később a zeneiskola klasszikus tanszékébe.
A Feng Shui aranyszabályai című könyvből. 10 egyszerű lépés a sikerhez, a jóléthez és a hosszú élettartamhoz szerző Ogudin Valentin LeonidovichA külső tárgyak negatív hatásának mértéke A külső tárgyak gyakorolják a legnagyobb negatív hatást, közvetlenül a ház bejárata előtt vannak. De minél jobban helyezkednek el a bejárat szögében, annál gyengébb lesz a befolyásuk.
szerző Shure EduardElső fokozat: Főzés. A hegyi beszéd és Isten Királysága Krisztus munkája egy galilei idillel és az "Isten országának" bejelentésével kezdődik. Ez az előrejelzés népszerű tanításaira mutat. Ugyanakkor felkészülés a magasztosabbra
Az Isteni evolúció című könyvből. A Szfinxtől Krisztusig szerző Shure EduardA beavatás (tisztítás) második foka. Csodálatos gyógyulások. Keresztény terápia Az ókori misztériumokban az erkölcsi és szellemi felkészülést a lélek megtisztítása követte, amelynek új szerveket kell felélesztenie és képességet kell adnia a
A Nagy Szfinx talánya című könyvből szerző Barbaren GeorgesA szobor helyreállítása A Nagy Szfinx tényleges kora az Ádám korszak elejére nyúlik vissza. Legalábbis a piramisok kortársa, amelynek együttesét, amint látni fogjuk, önmagával is kiegészítette. A Nagy Szfinx képe az elmúlt évszázadok során láthatóvá vált
A lélek gyógyítása című könyvből. 100 meditációs technika, gyógyító gyakorlatok és relaxáció szerző Rajneesh Bhagwan ShriA ritmus visszaállítása ... Állítsa be ugyanazt az időt a lefekvéshez - ha minden este tizenegy, akkor tizenegy. Ez az első: kezdjen el egy bizonyos időt, és hamarosan a test beléphet ebbe a ritmusba. Ezúttal ne változtasson, különben összezavarja a testet. Test
szerző Kuzmishin E.L.Tanulói fokozat felvétele tanulói fokozatba A doboz és az öltözék díszítése A doboz falát és mennyezetét kék és fehér kendővel kell felakasztani aranyozás nélkül. Az imádó Mester feje fölött egy ragyogással körülvett háromszög található, amelynek közepén a név szerepel
Cagliostro és az egyiptomi szabadkőművesség könyvéből szerző Kuzmishin E.L.A páholy és a mellények tanulói díszítésének felvétele A páholy falát és mennyezetét kék és fehér kendővel kell felakasztani aranyozás nélkül. A Tiszteletreméltó Mester feje fölött egy ragyogással körülvett háromszög található, közepén „Jehova” névvel, hímezve
A Jógi önéletírása című könyvből szerző Yogananda Paramahansa23. fejezet Egyetemi diplomát szerzek - Ön figyelmen kívül hagyja tankönyve filozófiai meghatározásait, kétségkívül számít valamilyen feltűnés nélküli "megérzésre", amely végigvezeti Önt a vizsgálatokon. De ha nem sürgősen fordul egy tudományosabb módszer felé, akkor muszáj
A Kabbala könyvéből. Felső világ. Az út kezdete szerző Laitman Michael7.5. A gonosz megvalósításának foka Amint azt a „Tóra adása” cikkben kifejtettük, az örömöt és a boldogságot a Teremtőhöz hasonló tulajdonságok mértéke határozza meg, míg a szenvedést és a türelmetlenséget a Teremtőtől való eltérés mértéke határozza meg. Ennek megfelelően az önzés undorító számunkra és elviselhetetlenül fájdalmas,
1.opció
1. Határozza meg a kémiai elemek atomjainak oxidációs állapotát a következő vegyületekben: HNO₃, NO₂, H₃N, SO₂, N₂O.
2. A periódusos rendszer segítségével rendezze a következő elemeket az elektronegativitás csökkenésének sorrendjében: O, N, Be, B, Li, C. Határozza meg, hol helyezkedjen el a fluor és a nátrium ebben a sorban. Magyarázza el a választ. 
3. Hogyan változik a kénatom oxidációs állapota az SO2 SO2-oxidációja során? Magyarázza el a választ.
2. lehetőség
1. Határozza meg a kémiai elemek atomjainak oxidációs állapotát a következő vegyületekben: CO₂, H₃PO₄, SiH₄, P₂O₅, Mg₂Si.
2. Mely kémiai elem atomjainak irányában az általános elektronikus pároka következő vegyületek molekuláiban: BF3, PC1, CS2, CC1, HBr? Adjon indokolt választ.
3. Változik-e a szén oxidációs állapota a képződés során? szénsav H₂CO₃ szén-dioxidból és vízből? Magyarázza el a választ.
3. lehetőség
1. Határozza meg a kémiai elemek atomjainak oxidációs állapotát a következő vegyületekben: Cl₂, NaClO, CaCl₂, HF, SO₃, Cl₂O₇.
2. Használata időszakos rendszer kémiai elemeket, a következő elemeket rendezze elektronegativitásuk növekvő sorrendjében: P, Al, Cl, Na, S, Mg. Keressen egy helyet ebben a sorban a kálium és a fluorid számára. Magyarázza el a választ. 
3. Hogyan változik a szén oxidációs állapota a metán CH мет égésekor szénmonoxid (IV) és víz képződésével? Magyarázza el a választ.
4. lehetőség
1. Határozza meg a kémiai elemek atomjainak oxidációs állapotát a következő vegyületekben: H₂SO₄, SO₂, NO₂, BF₃, H₂S.
2. A mi atomjai felé kémiai elemek a közös elektronpárok kiszorulnak a következő vegyületek molekuláiban: H2O, PCl₃, H₃N, H₂S, CO₂? Adjon indokolt választ.
3. Változnak-e az atomok oxidációs állapota, ha víz képződik belőle? egyszerű anyagok - hidrogén és oxigén? Magyarázza el a választ.


