इलेक्ट्रॉनों को अन्य तत्वों के परमाणुओं से इलेक्ट्रॉनों को आकर्षित करने के लिए रासायनिक तत्व की संपत्ति कहा जाता है जिसके साथ यह तत्व कनेक्शन में रासायनिक बंधन बनाता है।
जब विभिन्न तत्वों के परमाणुओं के बीच रासायनिक बंधन बनाया जाता है, तो सामान्य इलेक्ट्रॉनिक क्लाउड अधिक इलेक्ट्रोन-नकारात्मक परमाणु में जाता है, यही कारण है कि कनेक्शन सहसंयोजक ध्रुवीय हो जाता है, और इलेक्ट्रोनगेटनेस - आयन के बड़े अंतर के साथ।
रासायनिक सूत्रों को लिखते समय बिजली को ध्यान में रखा जाता है: अधिकांश इलेक्ट्रोजीजेटिव तत्व का प्रतीक बाइनरी कनेक्शन में दर्ज किया जाता है।
प्रत्येक अवधि के तत्वों के लिए बाएं से दाएं दिशा में बिजली बढ़ जाती है और उसी पीएस समूह के तत्वों के लिए ऊपर से नीचे की दिशा में घट जाती है।
वैलेंस तत्व को अपने परमाणुओं की संपत्ति को अन्य परमाणुओं की एक निश्चित संख्या से जोड़ने के लिए कहा जाता है।
StoichioMetric, इलेक्ट्रॉनिक वैलेंस और समन्वय संख्या हैं। हम केवल स्टॉइचियोमेट्रिक वैलेंस पर विचार करेंगे।
Stoichiometric वैलेंस दिखाता है कि किसी अन्य तत्व के कितने परमाणु इस तत्व के परमाणु को जोड़ते हैं। वैलेंस की प्रति इकाई हाइड्रोजन के वैधता को अपनाया, क्योंकि हाइड्रोजन हमेशा monovalent है। उदाहरण के लिए, एचसीएल में, एच 2 ओ, एनएच 3 यौगिकों (अमोनिया एच 3 एन का उचित लेखन पहले से ही आधुनिक मैनुअल में उपयोग किया जाता है), सीएच 4 क्लोरीन मोनोवलेंट, ऑक्सीजन बालेंट, नाइट्रोजन त्रिकोणीय और कार्बन टेट्रावलेंटन है।
ऑक्सीजन का स्टॉइचियोमेट्रिक वैलेंस आमतौर पर 2 के बराबर होता है। चूंकि लगभग सभी तत्व ऑक्सीजन के साथ यौगिक बनाते हैं, इसलिए किसी अन्य तत्व के वैलेंस को निर्धारित करने के संदर्भ के रूप में इसका उपयोग करना सुविधाजनक होता है। उदाहरण के लिए, यौगिकों में एनए 2 ओ, सीओओ, एफई 2 ओ 3, तो 3 सोडियम मोनोवलेंट, कोबाल्ट बाल्टेंट, लोहा त्रिभुज, सल्फर हेक्सावालेंट है।
ऑक्सीडेटिव और रेस्टोरिव प्रतिक्रियाओं में, तत्व ऑक्सीकरण की डिग्री निर्धारित करना हमारे लिए महत्वपूर्ण होगा।
ऑक्सीकरण की डिग्री पदार्थ में तत्व को इसके स्टॉइचियोमेट्रिक वैलेंस कहा जाता है, जिसे प्लस साइन या माइनस के साथ लिया जाता है।
रासायनिक तत्व तत्वों में विभाजित होते हैं स्थायी वैशता वैलेंस वैरिएबल तत्व।
1.3.3। आणविक और गैर-लोचदार पदार्थ। क्रिस्टल जाली का प्रकार। उनकी संरचना और संरचना से पदार्थों के गुणों की निर्भरता।
इस पर निर्भर करता है कि यौगिक की स्थिति प्रकृति में है, वे आणविक और अनिश्चितता में विभाजित हैं। में आणविक पदार्थ सबसे छोटे संरचनात्मक कण अणु हैं। इन पदार्थों में आणविक क्रिस्टल जाली होती है। गैर-पर्सुलर पदार्थों में, परमाणु या आयन सबसे छोटे संरचनात्मक कण होते हैं। क्रिस्टल जाली परमाणु, आयन या धातु है।
क्रिस्टल जाली का प्रकार बड़े पैमाने पर पदार्थों के गुणों को निर्धारित करता है। उदाहरण के लिए, धातुओं के होने वाले धातु प्रकार का क्रिस्टल जालीअन्य सभी तत्वों से अलग है उच्च plasticity, बिजली और थर्मल चालकता। इन गुणों के साथ-साथ कई अन्य - फोर्जिंग, धातु चमक इत्यादि। धातु परमाणुओं के बीच एक विशेष प्रकार के संचार के कारण - धातु कनेक्शन। यह ध्यान दिया जाना चाहिए कि धातुओं में निहित संपत्ति केवल संघनित राज्य में प्रकट होती है। उदाहरण के लिए, एक गैसीय राज्य में चांदी में धातुओं के भौतिक गुण नहीं होते हैं।
धातुओं में एक विशेष प्रकार का संचार धातु है - वैलेंस इलेक्ट्रॉनों की कमी के कारण, इसलिए वे धातु की पूरी संरचना के लिए आम हैं। धातु संरचना के सबसे सरल मॉडल ने माना कि धातुओं के क्रिस्टलीय जाली में नि: शुल्क इलेक्ट्रॉनों से घिरे सकारात्मक आयनों होते हैं, इलेक्ट्रॉनों का आंदोलन गैस अणुओं की तरह अराजक होता है। हालांकि, इस तरह के एक मॉडल, एक गुणात्मक जांच के साथ, एक गुणात्मक रूप से धातुओं के कई गुणों को समझाते हुए अपर्याप्त होने का कारण बनता है। धातु राज्य के सिद्धांत के आगे के विकास ने निर्माण के लिए प्रेरित किया धातुओं का क्षेत्र सिद्धांतजो क्वांटम यांत्रिकी के प्रदर्शन पर आधारित है।
क्रिस्टल जाली के नोड्स में केशन और धातु परमाणु होते हैं, और इलेक्ट्रॉनों को क्रिस्टल जाली के साथ स्वतंत्र रूप से स्थानांतरित किया जाता है।
धातुओं की विशेषता यांत्रिक संपत्ति है प्लास्टिकउनके क्रिस्टल की आंतरिक संरचना की विशिष्टताओं के कारण। प्लास्टिकिटी के तहत, बाहरी ताकतों की क्रिया के तहत निकायों की क्षमता विकृति से गुजरने के लिए, जो बाहरी प्रभाव के समाप्ति के बाद बनी हुई है। धातुओं की यह संपत्ति उन्हें काटने, चादरों में धातु की सवारी करने या इसे तार में खींचने पर उन्हें एक अलग रूप देने की अनुमति देती है।
धातुओं की plasticity इस तथ्य के कारण है कि आयनों की परतों के बाहरी प्रभावों के साथ क्रिस्टल जाली बनाने वाले आयनों के साथ, एक दूसरे के सापेक्ष तोड़ दिए बिना। यह इस तथ्य के परिणामस्वरूप होता है कि मुक्त पुनर्वितरण के कारण इलेक्ट्रॉनों को स्थानांतरित करने के लिए आयन परतों के बीच संवाद करना जारी रहता है। एक परमाणु ग्रिल के साथ ठोस पर यांत्रिक प्रभाव में, इसकी अलग परतों को स्थानांतरित कर दिया जाता है और टूटने के कारण उनके बीच आसंजन टूट जाता है सहसंयोजक संबंध.
आयनोंफिर ये पदार्थ बनाते हैं आयन प्रकार क्रिस्टल जाली.

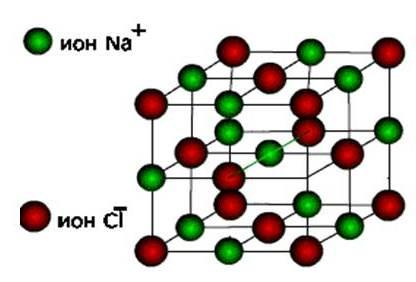
ये लवण हैं, साथ ही साथ सामान्य धातुओं के ऑक्साइड और हाइड्रोक्साइड भी हैं। ये ठोस, नाजुक पदार्थ हैं, लेकिन उनकी मुख्य गुणवत्ता : इन यौगिकों के समाधान और पिघल विद्युत प्रवाह का संचालन करते हैं.
यदि क्रिस्टल जाली के नोड्स में स्थित हैं परमाणुओंफिर ये पदार्थ बनाते हैं क्रिस्टल जाली के परमाणु प्रकार(हीरा, बोर, सिलिकॉन एल्यूमीनियम और सिलिकॉन ऑक्साइड)। संपत्तियों के अनुसार, बहुत ठोस और अपवर्तक, पानी में अघुलनशील।
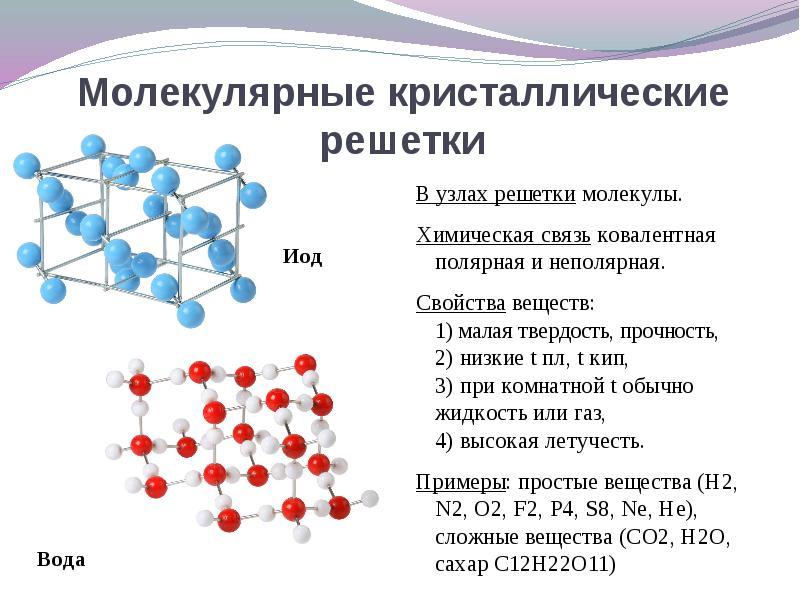
यदि क्रिस्टल जाली के नोड्स में स्थित हैं अणुओंये पदार्थ बनाते हैं (गैसों और तरल पदार्थों की सामान्य परिस्थितियों में: ओ 2, एचसीएल; मैं 2 कार्बनिक पदार्थ).
गैलियम की धातु को नोट करना दिलचस्प है, जो 30 ओ सी के तापमान पर पिघला देता है। इस विसंगति को इस तथ्य से समझाया गया है कि जीए 2 अणु और इसकी गुण क्रिस्टल जाली की असेंबली में स्थित हैं।
उदाहरण।नेमोल्यूलर संरचना समूह के सभी गैर-धातुएं हैं:
1) कार्बन, बोरॉन, सिलिकॉन; 2) फ्लोराइन, ब्रोमाइन, आयोडीन;
3) ऑक्सीजन, सल्फर, नाइट्रोजन; 4) क्लोरीन, फास्फोरस, सेलेनियम।
में गैर लोचदार पदार्थ सबसे छोटे संरचनात्मक कण परमाणु या आयन हैं। क्रिस्टल जाली परमाणु, आयनिक या धातु है
के लिये समाधान यह प्रश्न विपरीत से जाना आसान है। यदि क्रिस्टल जाली के नोड्स में स्थित हैं अणुओंफिर ये पदार्थ बनाते हैं आणविक प्रकार क्रिस्टल जाली(गैसों और तरल पदार्थों की सामान्य परिस्थितियों में: ओ 2, एचसीएल; इसके अलावा मैं 2, रम्बिक सल्फर एस 8, सफेद फास्फोरस पी 4, कार्बनिक पदार्थ)। गुणों से, ये नाजुक कम पिघलने वाले यौगिक हैं।
दूसरे उत्तर में चौथे - क्लोरीन गैस में तीसरे गैस ऑक्सीजन, नाइट्रोजन में एक फ्लोरिन गैस है। तो इन पदार्थों में आणविक क्रिस्टल जाली और एक आणविक संरचना होती है।
में प्रथम सभी पदार्थों का उत्तर दें - सामान्य परिस्थितियों में ठोस यौगिकों और एक परमाणु ग्रिल बनाते हैं, जिसका अर्थ है कि एक गैर-नैतिकता है।
सही जवाब:1) कार्बन, बोर, सिलिकॉन
- कम से कम इलेक्ट्रोनेटिव रासायनिक तत्व है।
- लोहा
- मैग्नीशियम
- कैल्शियम
ध्यान "कम से कम इलेक्ट्रोनेटिव" वाक्यांश पर भुगतान किया जाना चाहिए, यानी सबसे बड़ी धातु गुणों वाला तत्व। यह तर्क गैर-धातु के रूप में संभावित एसीओटी प्रतिक्रियाओं से समाप्त हो जाएगा, और कैल्शियम पर रहने के लिए, कार्य में प्रस्तावित धातुओं के सबसे सक्रिय के रूप में। उत्तर - 4।
- अणुओं में से एक में सबसे ध्रुवीय रासायनिक बंधन
- सीएल 4।
- सेंट 4।
अवधि में इलेक्ट्रॉन स्त्रावता में परिवर्तन के पैटर्न का ज्ञान और आवधिक प्रणाली के समूह डी मेंडेलीव कार्बन मीथेन सीएच 4 के क्वाड्रिकुलर यौगिकों की सूची से बाहर निकलना संभव बनाता है, और शेष हिस्सों से सीएफ 4 पर रुकने के लिए, के रूप में सभी रासायनिक तत्वों के सबसे इलेक्ट्रोजीजेटिव के साथ कार्बन का यौगिक - फ्लोराइन। उत्तर: 2
- क्रमशः क्लोराइड अणुओं और क्लोरीन रासायनिक संचार में
- आयनिक और सहसंयोजक ध्रुवीय
- आयनिक और सहसंयोजक गैर-ध्रुवीय
- सहसंयोजक ध्रुवीय और सहसंयोजक गैर-ध्रुवीय
- हाइड्रोजन और सहसंयोजक गैर-ध्रुवीय
इस कार्य के त्वरित और सही निष्पादन के लिए कीवर्ड "क्रमशः" शब्द है। प्रस्तावित संस्करणों में, केवल एक उत्तर "सहसंयोजक ध्रुवीय" शब्दों के साथ शुरू होता है, यानी क्लोराउडोर की बॉन्ड की विशेषता। उत्तर: 3।
- यौगिक में मैंगनीज के ऑक्सीकरण की डिग्री, 2 एमएनओ 4 के सूत्र के बराबर है
सूत्र द्वारा तत्वों के ऑक्सीकरण की डिग्री की गणना के लिए नियमों का ज्ञान आपको सही उत्तर चुनने की अनुमति देगा। उत्तर: 3।
- ऑक्सीकरण की सबसे छोटी डिग्री नमक में एक सल्फर है
- सल्फेट पोटेशियम
- सल्फिट पोटेशियम
- सल्फाइड पोटेशियम
- पोटेशियम हाइड्रोसल्फेट
जाहिर है, इस कार्य की तेजी से पूर्ति सूत्र में लवण के नामों का अनुवाद करना होगा। चूंकि सल्फर समूह का एक तत्व है, फिर ऑक्सीकरण की सबसे छोटी डिग्री -2 है। यह मान फॉर्मूला के 2 एस - पोटेशियम सल्फाइड के साथ एक यौगिक से मेल खाता है। उत्तर: 3।
- ऑक्सीकरण की डिग्री +5 क्लोरीन एटम आयन में है
- C1O - 4।
- C1O -
- C1O - 3।
- सी 1 ओ - 2।
इस कार्य को करते समय, आपको इस तथ्य पर ध्यान देना चाहिए कि स्थिति में कोई इलेक्ट्रॉनिक यौगिक नहीं हैं, लेकिन क्लोरीन आयनों को एक नकारात्मक चार्ज ("-") के साथ। चूंकि आयन में परमाणुओं के ऑक्सीकरण की डिग्री का योग आयन के प्रभारी के बराबर है, आर्टिक्यूलेटेड आयन में ऑक्सीजन परमाणुओं का कुल नकारात्मक शुल्क -6 (+5 - 6 \u003d -1) होना चाहिए। उत्तर: 3।
- ऑक्सीकरण -3 नाइट्रोजन की डिग्री प्रत्येक दो कनेक्शन में है
- NF 3 और NH 3
- एनएच 4 सीएल और एन 2 ओ 3
- एनएच 4 सीएल और एनएच 3
- एचएनओ 2 और एनएफ 3
सही प्रतिक्रिया का निर्धारण करने के लिए, बाएं और दाएं बीप के उत्तर के लिए विकल्पों को मानसिक रूप से विभाजित करना आवश्यक है। फिर उस व्यक्ति को चुनें जिसमें यौगिकों की एक सरल रचना है - हमारे मामले में, यह सही बाध्य द्विआधारी यौगिक है। विश्लेषण प्रतिक्रियाओं को 2 और 4 को खत्म कर देगा, जैसा कि नाइट्रोजन में ऑक्साइड और फ्लोराइड में ऑक्सीकरण की सकारात्मक डिग्री, कम इलेक्ट्रोजीजेटिव तत्व में होगा। यह तर्क 1 को बाहर करना और प्रतिक्रिया देना संभव बनाता है, क्योंकि यह पहला पदार्थ है - सभी समान नाइट्रोजन फ्लोराइड। उत्तर: 3।
- आणविक संरचना के पदार्थों के लिए शामिल नहीं है
- कार्बन डाइऑक्साइड
- मीथेन
- क्लोरोरोड
- कैल्शियम कार्बोनेट
आपको असाइनमेंट स्थिति में निर्धारित नकारात्मक निर्णय पर ध्यान देना चाहिए। चूंकि सामान्य परिस्थितियों में गैसीय पदार्थों में एक ठोस स्थिति में एक आणविक क्रिस्टलीय ग्रिल होता है, इसलिए असाइनमेंट स्थिति 1-3 शर्त की स्थिति के अनुरूप नहीं होती है। लवण के लिए कैल्शियम कार्बोनेट एट्रिब्यूशन फिर से सही उत्तर की पुष्टि करता है। उत्तर - 4।
- पदार्थों और उनकी संरचना के गुणों के बारे में निम्नलिखित निर्णय हैं?
ए गीले अंडरवियर ठंढ में सूख जाते हैं क्योंकि आणविक संरचना पदार्थ ऊष्मायन (उत्थान) में सक्षम होते हैं।
बी गीले अंडरवियर ठंढ में सूख जाते हैं क्योंकि पानी के अणुओं में कम आणविक भार होता है।
- सच केवल ए।
- केवल बी।
- दोनों निर्णय सच हैं
- दोनों निर्णय सच नहीं हैं।
ज्ञान भौतिक गुण आणविक संरचना के पदार्थ यह तय करना संभव बनाता है कि ठंढ में सूखी कपड़े धोने का कारण बर्फ की ऊष्मायन की क्षमता है, न कि पानी के अणुओं की डीपोल संरचना। उत्तर 1।
- आणविक संरचना में प्रत्येक पदार्थ होता है, जिनमें से सूत्र पंक्ति में दिए जाते हैं
- सीओ 2, एचएनओ 3, साओ
- ना 2 एस, बीआर 2, नहीं 2
- एच 2 एसओ 4, सीयू, ओ 3
- तो 2, मैं 2, एनएसएल
चूंकि प्रस्तावित विकल्पों में तीन पदार्थ होते हैं, इसलिए इन संस्करणों को मानसिक रूप से तीन लंबवत बीप में विभाजित करने के लिए तार्किक होता है। उनमें से प्रत्येक का विश्लेषण, एक सरल संरचना (औसत पॉडस्टोलबिक) के पदार्थों से शुरू होने से प्रतिक्रिया 3 को खत्म कर देगा, क्योंकि इसमें धातु कॉपर होता है, जिसमें धातु क्रिस्टलीय ग्रिड होता है। सही बीप का एक समान विश्लेषण प्रतिक्रिया 1 को खत्म करना संभव बनाता है, क्योंकि इसमें पिच-अर्थ धातु (आयन जाली) का ऑक्साइड होता है। दो शेष विकल्पों में से, विकल्प 2 को बाहर करना आवश्यक है, क्योंकि इसमें एक क्षार धातु नमक - सोडियम सल्फाइड (आयन जाली) शामिल है। उत्तर - 4।
स्वतंत्र काम के लिए कार्य
- ऑक्सीकरण की डिग्री यौगिक में +5 नाइट्रोजन प्रदर्शन है, जिसका सूत्र
- N 2 o 5
- एन 2 ओ 4
- एन 2 ओ
- यौगिक में क्रोमियम के ऑक्सीकरण की डिग्री, किस सूत्र (एनएच 4) 2 सीआर 2 ओ 7, बराबर है
- नाइट्रोजन के ऑक्सीकरण की डिग्री पदार्थों की एक पंक्ति में घट जाती है, जिनमें से सूत्र
- एनएच 3, नहीं 2, नो 3
- एन 2 ओ 4, नो 2, एनएच 4 सीएल
- एन 2, एन 2 ओ, एनएच 3
- एचएनओ 3, एचएनओ 2, नहीं 2
- क्लोरीन के ऑक्सीकरण की डिग्री कई पदार्थों में बढ़ जाती है, सूत्र
- NSLO, NSLO 4, KSLO 3
- सीएल 2, सी 1 2 ओ 7, केएसएलओ 3
- सीए (सी 1 ओ) 2, केएसएलओ 3, एनएसएलओ 4
- केएसएल, केएसएलओ 3, केएसएलओ
- अणु में सबसे ध्रुवीय रासायनिक संचार
- अमोनिया
- serovodorod।
- ब्रोमोमोडोरोड
- फ्लोरोडोरोड
- सहसंयोजक गैर-ध्रुवीय बंधन के साथ पदार्थ
- सफेद फास्फोरस
- एल्यूमीनियम फॉस्फाइड
- फॉस्फोरस क्लोराइड (वी)
- कैल्शियम फॉस्फेट
- केवल एक पंक्ति में दर्ज आयन बॉन्ड के साथ पदार्थों का सूत्र
- सोडियम क्लोराइड, फॉस्फोरस क्लोराइड (वी), सोडियम फॉस्फेट
- सोडियम ऑक्साइड, सोडियम हाइड्रॉक्साइड, सोडियम पेरोक्साइड
- seroublerod, कैल्शियम कार्बाइड, कैल्शियम ऑक्साइड
- कैल्शियम फ्लोराइड, कैल्शियम ऑक्साइड, कैल्शियम क्लोराइड
- परमाणु क्रिस्टल जाली है
- सोडियम ऑक्साइड
- कैल्शियम ऑक्साइड
- सल्फर ऑक्साइड (iv)
- अल्यूमिनियम ऑक्साइड
- आयनिक के साथ संबंध क्रिस्टल लैटिस जब क्लोरीन के साथ बातचीत करता है
- फास्फोरस
- बेरियम
- हाइड्रोजन
- धूसर
- अमोनियम क्लोराइड के बारे में निम्नलिखित निर्णय हैं?
ए अमोनियम क्लोराइड सहसंयोजक ध्रुवीय और आयनिक संबंधों द्वारा बनाई गई आयनिक संरचना पदार्थ है।
बी अमोनियम क्लोराइड - आयन संरचना का पदार्थ, और इसलिए ठोस, अपवर्तक और गैर-अस्थिर।
- सच केवल ए।
- केवल बी।
- दोनों निर्णय सच हैं
- दोनों निर्णय गलत हैं
08. बिजली, ऑक्सीकरण डिग्री, ऑक्सीकरण और वसूली
आइए रसायन शास्त्र में मौजूद बेहद दिलचस्प अवधारणाओं के अर्थ पर चर्चा करें, और अक्सर विज्ञान में होता है, पर्याप्त रूप से भ्रमित होता है, और उल्टे रूप में उपयोग किया जाता है। यह "इलेक्ट्रोनगेटिविटी", "ऑक्सीकरण की डिग्री" और "रेडॉक्स प्रतिक्रियाओं" के बारे में होगा।
इसका क्या अर्थ है - अवधारणा का उपयोग उलटा रूप में किया जाता है?
हम धीरे-धीरे इसके बारे में बताने की कोशिश करेंगे।
बिजली हमें रासायनिक तत्व के रेडॉक्स गुणों को प्रदर्शित करता है। यही है, उसकी क्षमता लेने या मुक्त फोटॉन देने की क्षमता। और यह भी एक स्रोत या ऊर्जा अवशोषक (ईथर) है। यांग या यिन।
ऑक्सीकरण की डिग्री - यह "इलेक्ट्रोनगेटिविटी" की अवधारणा के समान एक अवधारणा है। यह तत्व के रेडॉक्स गुणों को भी दर्शाता है। लेकिन उनके बीच अगला अंतर है।
बिजली एक अलग तत्व की विशेषता देता है। अपने आप में, इसे एक रासायनिक परिसर में खोजने से बाहर। जबकि ऑक्सीकरण की डिग्री अपने ऑक्सीडेटिव और पुनर्स्थापनात्मक क्षमताओं को ठीक से दर्शाती है जब तत्व किसी भी अणु का हिस्सा होता है।
आइए थोड़ा बात करें कि ऑक्सीकरण करने की क्षमता क्या है, और पुनर्स्थापित करने की क्षमता क्या है।
ऑक्सीकरण - यह मुफ्त फोटॉन (इलेक्ट्रॉनों) के किसी अन्य तत्व को स्थानांतरित करने की प्रक्रिया है। ऑक्सीकरण इलेक्ट्रॉनों को छोड़कर नहीं है, जैसा कि अब विज्ञान में माना जाता है। । जब तत्व किसी अन्य तत्व को ऑक्सीकरण करता है, तो यह एक एसिड या ऑक्सीजन की तरह कार्य करता है (इसलिए "ऑक्सीकरण नाम")। ऑक्सीकरण - इसका मतलब विनाश, क्षय, जलन तत्वों को बढ़ावा देना है । ऑक्सीकरण करने की क्षमता अणुओं के विनाश को उनके द्वारा प्रसारित ऊर्जा (मुक्त फोटॉन) द्वारा विनाश का कारण बनने की क्षमता है। याद रखें कि ऊर्जा हमेशा पदार्थ को नष्ट कर देती है।
आश्चर्य की बात है कि, विज्ञान में कितने समय तक विरोधाभास हैं, किसी के द्वारा ध्यान देने योग्य नहीं है।
यहां, उदाहरण के लिए: "अब हम जानते हैं कि ऑक्सीकरण एजेंट एक पदार्थ है जो इलेक्ट्रॉनों का अधिग्रहण करता है, और कम करने वाला एजेंट वह पदार्थ है जो उन्हें देता है" (युवा केमिस्ट, एक लेख "ऑक्सीकरण और प्रतिक्रिया) के विश्वकोष"।
और तुरंत, नीचे दो पैराग्राफ: "सबसे मजबूत ऑक्सीडाइज़र एक विद्युत प्रवाह (नकारात्मक चार्ज इलेक्ट्रॉनों की एक धारा)" (ibid।) है।
वे। पहले उद्धरण में कहा गया है कि ऑक्सीकरण एजेंट इलेक्ट्रॉनों को लेता है, और दूसरे ऑक्सीडेंट कॉल में क्या देता है।
और इसी तरह के गलत निष्कर्ष जो एक दूसरे के विरोधाभास को स्कूलों और संस्थानों में याद रखने के लिए मजबूर होते हैं!
यह ज्ञात है कि सबसे अच्छे ऑक्सीडेंट गैर-धातु हैं। इसके अलावा, अवधि की संख्या और अधिक समूह संख्या जितनी छोटी है, उतनी ही मजबूत ऑक्सीडेंट के गुण व्यक्त किए जाते हैं। यह आश्चर्य की बात नहीं है। हमने दूसरे भाग में आवधिक प्रणाली के विश्लेषण के लिए समर्पित एक लेख में इसके कारणों को अलग किया, जहां उन्होंने न्यूक्लियंस के रंग के बारे में बात की। पहले समूह से 8 तक, तत्वों में नाभिकों का रंग धीरे-धीरे बैंगनी से लाल तक बदल रहा है (यदि आप डी- और एफ-एलिमेंट्स के नीले रंग पर विचार करते हैं)। पीले और लाल कणों का संयोजन संचित मुक्त फोटॉन की वापसी की सुविधा प्रदान करता है। पीला संचय, लेकिन कमजोर रूप से पकड़ो। और लाल वापसी में योगदान देता है। फोटॉन डालें - यह ऑक्सीकरण की प्रक्रिया है। लेकिन जब कुछ लाल होते हैं, तो ऐसे कोई कण नहीं होते हैं जो फोटॉन जमा कर सकते हैं। यही कारण है कि 8 समूह, महान गैसों के तत्व, अपने पड़ोसियों, हलोजन के विपरीत, ऑक्सीकरण एजेंट नहीं।
मरम्मत - यह ऑक्सीकरण के विपरीत एक प्रक्रिया है। अब, विज्ञान में, ऐसा माना जाता है कि जब रासायनिक तत्व इलेक्ट्रॉनों को प्राप्त करता है, तो इसे बहाल किया जाता है। इस दृष्टिकोण को समझना संभव है (लेकिन स्वीकार नहीं)। रासायनिक तत्वों की संरचना का अध्ययन करते समय, यह पता चला कि वे इलेक्ट्रॉनों को उत्सर्जित करते हैं। निष्कर्ष निकाला कि इलेक्ट्रॉन तत्वों का हिस्सा हैं। इसका मतलब है कि इलेक्ट्रॉनों के तत्व का हस्तांतरण, एक प्रकार की खोई हुई संरचना की बहाली है।
हालांकि, वास्तव में, सब कुछ गलत है।
इलेक्ट्रॉन्ज मुफ्त फोटॉन हैं। वे नाभिक नहीं हैं। वे तत्व के शरीर का हिस्सा नहीं हैं। वे बाहर प्रवेश करके आकर्षित होते हैं, और नाभिक की सतह और उनके बीच जमा होते हैं। लेकिन उनका संचय तत्व या अणु की संरचना को बहाल करने के लिए बिल्कुल नहीं है। इसके विपरीत, उनके द्वारा उत्सर्जित इन फोटॉन ईथर (ऊर्जा) तत्वों के बीच के लिंक को कमजोर और नष्ट कर देते हैं। और यह ऑक्सीकरण की प्रक्रिया है, लेकिन वसूली नहीं है।
अणु को पुनर्स्थापित करें, वास्तविकता में, - उससे ऊर्जा लें (इस मामले में, मुफ्त फोटॉन), और रिपोर्ट नहीं। फोटॉन का चयन करना, तत्व पुनर्प्राप्तकर्ता पदार्थ को कॉम्पैक्ट करता है - इसे पुनर्स्थापित करता है।
सबसे अच्छा कम करने वाले एजेंट धातु हैं। यह संपत्ति स्वाभाविक रूप से उनके गुणात्मक और मात्रात्मक संरचना से होती है - आकर्षण के उनके क्षेत्र सबसे बड़ा और सतह पर जरूरी है कि कई या पर्याप्त कण हैं। नीले रंग का.
आप धातुओं के निम्नलिखित निर्धारण को भी वापस ले सकते हैं।
धातु - यह एक रासायनिक तत्व है, सतह परतों की संरचना में जिसमें आवश्यक रूप से नीले कण होते हैं।
लेकिन अ नांमेटल - यह एक तत्व है, सतह परतों की संरचना में जिसमें से कोई या लगभग नीला नहीं है, और जरूरी रूप से लाल होते हैं।
अपने मजबूत आकर्षण के साथ धातु पूरी तरह से इलेक्ट्रॉनों लेते हैं। और इसलिए वे एजेंटों को कम कर रहे हैं।
हम "इलेक्ट्रोनसिटी", "ऑक्सीकरण की डिग्री", "रेडॉक्स प्रतिक्रियाओं" की अवधारणाओं की परिभाषा देते हैं, जो रसायन विज्ञान में पाठ्यपुस्तकों में पाए जा सकते हैं।
« ऑक्सीकरण की डिग्री - यौगिक में परमाणु के सशर्त प्रभार की धारणा के आधार पर गणना की गई कि इसमें केवल आयन शामिल हैं। इस अवधारणा को निर्धारित करने में, इसे पारंपरिक रूप से माना जाता है कि बाइंडर्स (वैलेंस) इलेक्ट्रॉन अधिक इलेक्ट्रोजीजेटिव परमाणुओं पर जाते हैं, और इसलिए यौगिकों में सकारात्मक और नकारात्मक रूप से चार्ज आयनों से होता है। ऑक्सीकरण की डिग्री में शून्य, नकारात्मक और सकारात्मक मान हो सकते हैं, जो आमतौर पर उपरोक्त तत्व के प्रतीक पर सेट होते हैं।
ऑक्सीकरण की डिग्री का शून्य मूल्य मुक्त राज्य में तत्वों के परमाणुओं के लिए जिम्मेदार है ... ऑक्सीकरण की डिग्री के नकारात्मक मूल्य में उन परमाणुओं को बाइंडर इलेक्ट्रॉन क्लाउड (इलेक्ट्रॉन जोड़ी) स्थानांतरित किया जाता है। अपने सभी कनेक्शनों में फ्लोराइन यह -1 के बराबर है। ऑक्सीकरण की एक सकारात्मक डिग्री परमाणु होते हैं जो अन्य परमाणुओं को वैलेंस इलेक्ट्रॉनों देते हैं। उदाहरण के लिए, क्षारीय और क्षारीय पृथ्वी धातु, यह क्रमशः +1 और +2 है। सामान्य आयनों में, यह आयन के चार्ज के बराबर है। अधिकांश यौगिकों में, हाइड्रोजन परमाणुओं के ऑक्सीकरण की डिग्री + 1 है, लेकिन धातुओं के हाइड्राइड (हाइड्रोजन के साथ यौगिक) और अन्य - यह -1 के बराबर है। ऑक्सीजन के लिए, ऑक्सीकरण -2 की डिग्री विशेषता है, लेकिन, उदाहरण के लिए, फ्लोराइन के साथ एक परिसर में यह +2 होगा, और पेरोक्साइडेशन कनेक्शन में -1। ...
यौगिक में परमाणुओं के ऑक्सीकरण का बीजगणितीय योग शून्य है, और जटिल आयन - आयन का प्रभार। ...
ऑक्सीकरण की उच्चतम डिग्री सबसे बड़ी सकारात्मक मूल्य है। अधिकांश तत्वों के लिए, यह आवधिक प्रणाली में समूह संख्या के बराबर है और इसके कनेक्शन में तत्व की एक महत्वपूर्ण मात्रात्मक विशेषता है। तत्व के ऑक्सीकरण की डिग्री का सबसे छोटा मूल्य, जो इसके यौगिकों में होता है, ऑक्सीकरण की निचली डिग्री कहा जाता है; अन्य सभी - मध्यवर्ती "(युवा रसायनज्ञ के विश्वकोश शब्दकोश, लेख" ऑक्सीकरण की डिग्री ")।
इस अवधारणा से संबंधित मूलभूत जानकारी यहां दी गई है। यह एक और अवधि - "बिजली" से निकटता से संबंधित है।
« बिजली - यह एक रासायनिक बंधन के गठन में शामिल इलेक्ट्रॉनों को आकर्षित करने के लिए अणु में एक परमाणु की क्षमता है "(युवा रसायनज्ञ का विश्वकोश शब्दकोश, लेख" विद्युत ")।
"रेडॉक्स प्रतिक्रियाएं परमाणुओं के ऑक्सीकरण की डिग्री में बदलाव के साथ होती हैं जो प्रतिक्रियाशील पदार्थों का हिस्सा हैं, दूसरे परमाणु में एक अभिकर्मकों (कम करने वाले एजेंट) के परमाणु से इलेक्ट्रॉनों को स्थानांतरित करने के परिणामस्वरूप। ऑक्सीडेटिव और कम करने वाली प्रतिक्रियाओं के साथ, ऑक्सीकरण (इलेक्ट्रॉन रिटर्न) और रिकवरी (इलेक्ट्रॉन अतिरिक्त) होता है (रासायनिक विश्वकोशीय शब्दकोश) (रासायनिक विश्वकोशीय शब्दकोश एड। I.L. Knunyantz, लेख "रेडॉक्स प्रतिक्रिया")।
हमारी राय में, इन तीन अवधारणाओं में कुछ गलतियां हैं।
पहले तो , हम मानते हैं कि दोनों तत्वों के बीच रासायनिक कनेक्शन का गठन उनके इलेक्ट्रॉनों के सामाजिककरण की सभी प्रक्रियाओं पर नहीं है। रासायनिक बंधन एक गुरुत्वाकर्षण कनेक्शन है। कथित रूप से कर्नेल के चारों ओर उड़ान, इलेक्ट्रॉनों, तत्व के शरीर में और उनके बीच नाभिकों की सतह पर जमा मुक्त फोटॉन हैं। दो तत्वों के बीच एक कनेक्शन उत्पन्न होने के लिए, उनके मुक्त फोटॉन को तत्वों के बीच चलाने की आवश्यकता नहीं है। यह नहीं होता है। वास्तव में, भारी तत्व हल्का के साथ मुक्त फोटॉन को बंद (आकर्षित करता है) लेता है, और उन्हें छोड़ देता है (अधिक सटीक, खुद पर)। और एक हल्का तत्व का क्षेत्र जिसके साथ इन फोटॉनों को हटा दिया गया था, एक या दूसरे तरीके से। इस क्षेत्र में किस आकर्षण को अधिक हद तक प्रकट किया गया है। और आसान तत्व भारी रूप से आकर्षित होता है। तो रासायनिक बंधन उत्पन्न होता है।
दूसरे , आधुनिक रसायन विज्ञान विकृत - उलटा इलेक्ट्रॉनों को आकर्षित करने के लिए तत्वों की क्षमता को देखता है। ऐसा माना जाता है कि तत्व की इलेक्ट्रोनगेटिविटी जितनी बड़ी होगी, उतना ही वह अपने आप को आकर्षित करने में सक्षम है। और ऑक्सीजन के साथ फ्लोराइन कथित रूप से इसे सबसे अच्छा बनाता है - वे खुद को अन्य इलेक्ट्रॉनों को आकर्षित करते हैं। साथ ही अन्य तत्व 6 और 7 समूह।
वास्तव में, यह राय एक भ्रम से अधिक नहीं है। यह गलत दृश्य पर आधारित है, जैसे कि अधिक समूह संख्या, कठिन आइटम। और, नाभिक का सकारात्मक प्रभार जितना अधिक होगा। यह बकवास है। वैज्ञानिक खुद को यह बताने के लिए परेशान नहीं करते हैं कि उनके दृष्टिकोण से "चार्ज" है। बस, अंक विज्ञान के रूप में, उन्होंने सभी तत्वों को क्रम में पुन: गणना की, और चार्ज मानों की संख्या के अनुसार हस्ताक्षरित किया गया। महान वृद्धि!
यह स्पष्ट और बच्चा है कि गैस घने धातु की तुलना में हल्की है। यह कैसे हुआ कि रसायन विज्ञान में यह माना जाता है कि गैसें बेहतर इलेक्ट्रॉनों को आकर्षित कर रही हैं?
घने धातु, ज़ाहिर है, वे इलेक्ट्रॉनों को बेहतर आकर्षित कर रहे हैं।
वैज्ञानिक-रसायनविद, निश्चित रूप से, पाठ्यक्रम में "इलेक्ट्रोनगेंस" की अवधारणा को छोड़ सकते हैं, क्योंकि यह इतना आम है। हालांकि, उन्हें विपरीत प्रत्यक्ष रूप से इसका अर्थ बदलना होगा।
बिजली - यह इलेक्ट्रॉनों को आकर्षित करने के लिए अणु में रासायनिक तत्व की क्षमता है। और, ज़ाहिर है, धातुओं पर, यह क्षमता गैर-धातुओं की तुलना में बेहतर व्यक्त की जाती है।
अणु में बिजली के ध्रुवों के लिए, तो, वास्तव में, नकारात्मक ध्रुव - ये गैर-धातु तत्व हैं जो आकर्षण के छोटे क्षेत्रों के साथ इलेक्ट्रॉनों देते हैं। लेकिन अ सकारात्मक - यह हमेशा आकर्षण के बड़े क्षेत्रों के साथ अधिक स्पष्ट धातु गुणों के साथ तत्व होता है।
एक साथ मुस्कुराओ।
बिजली - यह एक और है, रासायनिक तत्व की गुणवत्ता का वर्णन करने का एक और प्रयास, पहले से ही मौजूदा वजन और चार्ज के साथ। जैसा कि अक्सर होता है, इस मामले में विज्ञान के एक अलग क्षेत्र के वैज्ञानिक, इस मामले में, रसायन शास्त्र, जैसे कि भौतिकविदों के लिए अपने सहयोगियों पर भरोसा नहीं करते हैं, बल्कि, बल्कि, किसी भी व्यक्ति, खोज करने के लिए, अपने तरीके से, और नहीं बस दूसरों के अनुभव की खोज।
तो यह इस बार हुआ।
द्रव्यमान और चार्ज ने किसी भी रसायनवादियों को यह समझने में मदद नहीं की थी कि परमाणुओं में क्या हो रहा था जब वे एक-दूसरे के साथ बातचीत कर रहे थे - और इलेक्ट्रोनगेट को पेश किया गया था - एक रासायनिक बंधन के गठन में शामिल इलेक्ट्रॉनों को आकर्षित करने की तत्व की क्षमता। यह पहचाना जाना चाहिए कि इस अवधारणा का विचार बहुत सच है। एकमात्र संशोधन के साथ कि यह एक उलटा रूप में वास्तविकता को दर्शाता है। जैसा कि हमने कहा था, गैर-धातुओं के बजाय धातु इलेक्ट्रॉनों को आकर्षित करना सबसे अच्छा है - सतह नाभिकों के रंग की विशेषताओं के आधार पर। धातु सबसे अच्छा कम करने वाले एजेंट हैं। Nonmetals - ऑक्सीकरण एजेंटों। धातुओं को लिया जाता है, गैर-धातु देते हैं। धातु - यिन, निमेमेटल्ला - यांग।
एसोटेरिक प्रकृति के रहस्यों को समझने के मामलों में विज्ञान में मदद करने के लिए आता है।
विषय में ऑक्सीकरण की डिग्री यह समझने का एक अच्छा प्रयास है कि रासायनिक यौगिक - अणुओं के भीतर मुक्त इलेक्ट्रॉनों का वितरण कैसे हो रहा है।
यदि रासायनिक यौगिक समान रूप से है - यानी, यह आसान है, इसकी संरचना में समान प्रकार के तत्व होते हैं - फिर सबकुछ सच है, वास्तव में यौगिक में किसी भी तत्व के ऑक्सीकरण की डिग्री शून्य है। चूंकि इस संबंध में कोई ऑक्सीडेंट नहीं हैं और कोई रीबूट नहीं है। और सभी तत्व गुणवत्ता में समान हैं। कोई भी इलेक्ट्रॉनों को नहीं लेता है, कोई भी नहीं देता है। चाहे वह घने पदार्थ, या तरल, या गैस है - कोई फर्क नहीं पड़ता।
ऑक्सीकरण की डिग्री, साथ ही इलेक्ट्रोनगेटिविटी, रासायनिक तत्व की गुणवत्ता का प्रदर्शन करता है - केवल रासायनिक तत्व के ढांचे के भीतर। ऑक्सीकरण की डिग्री यौगिक में रासायनिक तत्वों की गुणवत्ता की तुलना करने के लिए डिज़ाइन की गई है। हमारी राय में, विचार अच्छा है, लेकिन इसका कार्यान्वयन काफी संतुष्ट नहीं है।
हम स्पष्ट रूप से रासायनिक तत्वों और उनके बीच संबंधों की संरचना की अवधारणा के खिलाफ स्पष्ट रूप से। खैर, अगर केवल इसलिए कि समूहों की संख्या, हमारे विचारों के अनुसार, 8 से अधिक होनी चाहिए और इसलिए, पूरी प्रणाली ढह जाती है। हाँ, और न केवल वह। आम तौर पर, "उंगलियों" परमाणुओं में इलेक्ट्रॉनों की संख्या का पुनर्मूल्यांकन करना किसी भी तरह से गंभीर नहीं है।
वर्तमान अवधारणा के अनुसार, यह पता चला है कि सबसे मजबूत ऑक्सीडाइज़र को सबसे छोटा सशर्त शुल्क सौंपा गया है - फ्लोरिन में सभी यौगिकों में चार्ज -1 है, ऑक्सीजन लगभग हर जगह -2। और बहुत सक्रिय धातुओं में - क्षारीय और क्षारीय पृथ्वी - ये शुल्क, क्रमशः, +1 और +2। आखिरकार, यह बिल्कुल तार्किक नहीं है। हालांकि, हम दोहराते हैं, हम सामान्य योजना को बहुत अच्छी तरह से समझते हैं, जिसके अनुसार यह किया गया था - सभी को टेबल में 8 समूहों और बाहरी ऊर्जा स्तर में 8 इलेक्ट्रॉन के लिए।
हालांकि, कम से कम, हलोजन और ऑक्सीजन में इन शुल्कों की परिमाण एक ऋण चिह्न के साथ सबसे बड़ा माना जाता था। और क्षारीय और क्षारीय पृथ्वी धातु भी बड़े हैं, केवल एक प्लस साइन के साथ।
किसी में रासायनिक यौगिक ऐसे तत्व हैं जो इलेक्ट्रॉनों को देते हैं - ऑक्सीकरण एजेंट, गैर-धातु, नकारात्मक शुल्क, और तत्व जो इलेक्ट्रॉनों को लेते हैं - एजेंटों, धातुओं, सकारात्मक चार्ज को कम करना। यह तत्वों की तुलना करने का तरीका है, उन्हें एक-दूसरे से संबंधित और ऑक्सीकरण की अपनी डिग्री निर्धारित करने का प्रयास करें।
हालांकि, ऑक्सीकरण की डिग्री इस तरह से पता लगाने के लिए, हमारी राय में, वास्तविकता को सटीक रूप से प्रतिबिंबित नहीं करता है। अणु में तत्वों की इलेक्ट्रोनबिलिटी की तुलना करना अधिक सही होगा। आखिरकार, इलेक्ट्रोनगेटिविटी लगभग ऑक्सीकरण की डिग्री के समान ही है (गुणवत्ता की विशेषता, केवल एक अलग तत्व)।
आप बिजली के पैमाने को ले सकते हैं और इसे प्रत्येक तत्व के लिए सूत्र में डाल सकते हैं। और फिर यह तुरंत देखा जाएगा, किन तत्वों को इलेक्ट्रॉनों दिए जाते हैं, और जिन्हें लिया जाता है। उस तत्व जिसका परिसर में इलेक्ट्रोनगेटिविटी उच्चतम - नकारात्मक ध्रुव है, इलेक्ट्रॉनों देता है। और जिसकी इलेक्ट्रोनबिलिटी सबसे छोटी - सकारात्मक ध्रुव है, इलेक्ट्रॉनों को ले जाती है।
यदि आइटम, स्वीकार करते हैं, अणु में 3 या 4, कुछ भी नहीं बदलता है। सभी ने इलेक्ट्रोनिबिलिटी की परिमाण और तुलना भी की।
हालांकि इसे अणु की संरचना के मॉडल को आकर्षित करने के लिए भुलाया नहीं जाना चाहिए। दरअसल, किसी भी परिसर में, यदि यह आसान नहीं है, तो यह है कि इसमें एक प्रकार के तत्व शामिल नहीं होते हैं, एक दूसरे के साथ जुड़े होते हैं, सबसे पहले, धातु और गैर-धातुओं के साथ। धातु गैर-धातुओं में इलेक्ट्रॉनों का चयन करते हैं, और उनसे जुड़ते हैं। और गैर-धातु के एक तत्व में, इलेक्ट्रॉनों 2 को एक ही समय में या अधिक स्पष्ट धातु गुणों के साथ तत्वों की एक बड़ी संख्या का चयन किया जा सकता है। तो जटिल, जटिल अणु होता है। लेकिन इसका मतलब यह नहीं है कि इस तरह के अणु में, धातु तत्व ठोस कनेक्शन और एक दूसरे के साथ आएंगे। शायद वे एक दूसरे से विपरीत पक्षों पर स्थित होंगे। यदि आस-पास - वे आकर्षित करेंगे। लेकिन ठोस कनेक्शन केवल तभी गठित होता है जब एक तत्व दूसरे की तुलना में अधिक धातु है। एक तत्व को इलेक्ट्रॉनों का चयन करना सुनिश्चित करें - हटाया गया। अन्यथा, तत्व नहीं होगा - सतह पर मुक्त फोटॉन से छूट। आकर्षण क्षेत्र अच्छी तरह से प्रकट नहीं होगा, और कोई टिकाऊ कनेक्शन नहीं होगा। यह जटिल विषय - शिक्षा रासायनिक संबंधऔर हम इस लेख में इसके बारे में विस्तार से नहीं बताएंगे।
हमारा मानना \u200b\u200bहै कि, हमने "इलेक्ट्रोनसिटी", "ऑक्सीकरण डिग्री", "ऑक्सीकरण" और "बहाली" की अवधारणाओं के विश्लेषण के लिए समर्पित विषय को बेहद जलाया, और आपके ध्यान को बहुत अधिक उत्सुक जानकारी प्रदान की।
पुस्तक प्रबंधित सपनों से विश्व ऐलेना के लेखकबहाली "जब इंडी-एप्रीम का एक एकीकृत संकेत पैदा होता है, सार और जीवन दो में विभाजित होता है। इस बिंदु से, यदि अंतिम दुनिया तक नहीं पहुंचती है, तो सार और जीवन एक दूसरे को फिर कभी नहीं देख पाएगा। " संस्थान के बाद विलियम, "द मिस्ट्री ऑफ द गोल्डन फ्लॉवर"
पुस्तक पुस्तक पुस्तक से। पृथ्वी और विदेशों में अविश्वसनीय स्पष्ट लेखक Vyatkin Arkady Dmitrievichमासोकिज्म इस अर्थ में स्वैच्छिक पिशाच की चरम डिग्री के रूप में मासोकिज्म दूरसंचार के समान है। Mazochists वे लोग हैं जो अपने शारीरिक और मानसिक पीड़ा से सुखद संवेदना प्राप्त करते हैं। दूसरे शब्दों में, वे इसे पसंद करते हैं जब वे हरा, डरावना, नकली
रूस में पिशाच पुस्तक से। आपको उनके बारे में जानने की ज़रूरत है! लेखक बाउर अलेक्जेंडररक्त के नुकसान की डिग्री कैसे निर्धारित करें जब पिशाच खून पीता है, फिर आधे लीटर से डेढ़ लीटर रक्त में एक बार पीता है। मानव शरीर में केवल पांच या छह लीटर रक्त होता है, ताकि इस तरह के रक्त हानि जीवन के लिए जरूरी नहीं खतरनाक हो। हालांकि, पिशाच कर सकते हैं
एक सपने में भविष्य मॉडलिंग पुस्तक से विश्व ऐलेना के लेखकएक बंद कंपनी में एक इंजीनियर के रूप में काम करने के बाद बहाली, मुझे एहसास हुआ कि मैं अपने स्थान पर नहीं था, इसलिए मैंने पेशे को बदलने और जैज़ स्कूल ऑफ इम्प्रोवाइजेशन में प्रवेश करने का फैसला किया, और बाद में क्लासिक कार्यालय के लिए संगीत स्कूल में प्रवेश किया ।
गोल्डन नियम फेंगशुई पुस्तक से। सफलता, कल्याण और दीर्घायु के लिए 10 सरल कदम लेखक रुडिन वैलेंटाइन लियोनिदोविचबाहरी वस्तुओं के नकारात्मक प्रभाव की डिग्री सबसे बड़ा नकारात्मक प्रभाव बाहरी वस्तुओं को घर में प्रवेश करने से पहले तुरंत होता है। लेकिन जितना अधिक वे प्रवेश द्वार के कोण पर स्थित हैं, कमजोर उनका प्रभाव बन जाता है। वस्तु सीधे है
लेखक एडवर्ड इलाज द्वारापहली डिग्री: खाना पकाने। नागोनी उपदेश और मसीह के परमेश्वर के मामले का राज्य गलील आइडल और "भगवान के राज्य" की घोषणा के साथ शुरू होता है। यह भविष्यवाणी हमें अपने लोकप्रिय निर्देशों को इंगित करती है। उसी समय, यह अधिक उन्नत की तैयारी है
पुस्तक दिव्य विकास से। स्फिंक्स से मसीह तक लेखक एडवर्ड इलाज द्वारादीक्षा की दूसरी डिग्री (सफाई)। अद्भुत उपचार। नैतिक और बौद्धिक तैयारी के लिए सभी प्राचीन रहस्यों में ईसाई थेरेपी आत्मा को साफ कर देनी चाहिए, जिसे इसमें नए अंगों को पुनर्जीवित करना चाहिए और इसे बाद में क्षमता देना चाहिए
एक बड़ी स्फिंक्स पहेली पुस्तक से लेखक बर्बरन जॉर्जेसमूर्ति की बहाली एक बड़े स्फिंक्स की वास्तविक युग आदम युग की शुरुआत में वापस जाती है। कम से कम वह एक समकालीन पिरामिड है, जिसमें से वह, जैसा कि हम देखेंगे, इसे पूरा करेंगे। एक बड़े स्फिंक्स की छवि को समाप्त सदियों के लिए अधीन किया गया है
आत्मा की किताब से। 100 ध्यान तकनीक, उपचार अभ्यास और विश्राम लेखक रजनीश भगवान श्रीलय की बहाली ... बिस्तर पर जाने के लिए एक ही समय स्थापित करें - अगर हर शाम यह ग्यारह है, तो इसका मतलब है कि ग्यारह। यह पहला है: एक निश्चित समय प्राप्त करें, और जल्द ही शरीर इस लय में प्रवेश करने में सक्षम हो जाएगा। इस समय को न बदलें, अन्यथा आप शरीर का चयन करेंगे। तन
लेखक कुज़मिशिन ई एल द्वारा।छात्र की डिग्री के लिए एक छात्र रिसेप्शन की डिग्री। लॉज और डोमेन की सजावट और लॉज की छत को बिना गिल्डिंग के नीले और सफेद पदार्थ को बेक किया जाना चाहिए। विशेषज्ञ मास्टर के सिर पर अपने केंद्र में नाम के साथ एक त्रिभुज की चमक से घिरा हुआ है
कैलियोसोस्ट्रो और मिस्र के फ्रीमेसन की पुस्तक से लेखक कुज़मिशिन ई एल द्वारा।छात्र की डिग्री में रिसेप्शन। लॉज और डोमेन की सजावट और लॉज की छत को बिना गिल्डिंग के नीले और सफेद पदार्थ के साथ लटकाया जाना चाहिए। विशेषज्ञ मास्टर के प्रमुख पर "यहोवा" नाम के साथ एक त्रिभुज की चमक से घिरा हुआ है, जो अपने केंद्र में कढ़ाई हुआ है
पुस्तक आत्मकथा योग से लेखक योगानंद परम्यांसअध्याय 23 मुझे एक विश्वविद्यालय की डिग्री मिलती है - आप पाठ्यपुस्तक से दार्शनिक परिभाषाओं को अनदेखा करते हैं निस्संदेह यह गिनती है कि कुछ गैर-गोलिंग "अंतर्ज्ञान" आपको सभी परीक्षाओं के माध्यम से पकड़ लेगी। लेकिन अगर आप तत्काल एक और वैज्ञानिक विधि से परामर्श नहीं करते हैं, तो मुझे करना होगा
कब्बाला की पुस्तक से। उच्चतम दुनिया। रास्ते की शुरुआत लेखक लाइटमैन माइकल।7.5। "टारस्टिंग", आनंद और आनंद के लेख में स्पष्ट रूप से बुराई की जागरूकता की डिग्री गुणों के अनुसार निर्माता की समानता की डिग्री, और पीड़ा और अधीरता के अनुसार निर्धारित की जाती है - निर्माता से मतभेदों की डिग्री। इसके अनुसार, अहंकार हमें घृणित और असहनीय रूप से पेंट कर रहा है,
विकल्प 1
1. निम्नलिखित कनेक्शन में रासायनिक तत्वों के परमाणुओं के ऑक्सीकरण की डिग्री निर्धारित करें: hno₃, no₂, h₃n, soo₂, n₂o।
2. आवर्त सारणी का लाभ लेना, इलेक्ट्रोनगेटिविटी को कम करने के लिए निम्नलिखित तत्वों की स्थिति: ओ, एन, बीई, बी, ली, सी निर्धारित करें कि इस पंक्ति में फ्लोराइन और सोडियम कहां स्थित होना चाहिए। उत्तर की व्याख्या करें। 
3. सल्फर परमाणु के ऑक्सीकरण की डिग्री कैसे बदलती है जब SO₂ तक? उत्तर बताएं।
विकल्प 2।
1. निम्नलिखित कनेक्शन में रासायनिक तत्वों के परमाणुओं के ऑक्सीकरण की डिग्री निर्धारित करें: co₂, h₃po₄, sih₄, p₂o₅, mg₂si।
2. परमाणुओं की दिशा में जिसके रासायनिक तत्व को सामान्य रूप से स्थानांतरित किया जाता है इलेक्ट्रॉनिक युगल, निम्नलिखित कनेक्शन के अणु: बीएफ₃, पीसीएल₃, सीएस₂, सीसीएल₄, एचबीआर? एक उचित जवाब दें।
3. क्या कार्बन ऑक्सीकरण की डिग्री गठन के दौरान बदलती है कोलिक एसिड H₂co₃ कार्बन डाइऑक्साइड और पानी? उत्तर बताएं।
विकल्प 3।
1. निम्नलिखित कनेक्शन में रासायनिक तत्वों के परमाणुओं के ऑक्सीकरण की डिग्री निर्धारित करें: cl₂, naclo, cacl₂, hf, so₃, cl₂o₇।
2. उपयोग करना आवधिक प्रणाली रासायनिक तत्व, अपनी इलेक्ट्रोनबिलिटी बढ़ाने के क्रम में निम्नलिखित तत्वों की स्थिति: पी, अल, सीएल, एनए, एस, एमजी। इस पंक्ति में एक पोटेशियम और फ्लोराइन खोजें। उत्तर बताएं। 
3. कार्बन ऑक्सीडेशन की डिग्री कार्बन ऑक्साइड (iv) और पानी के गठन के साथ मीथेन ch₄ जलते समय कैसे बदलती है? उत्तर बताएं।
विकल्प 4।
1. निम्नलिखित कनेक्शन में रासायनिक तत्वों के परमाणुओं के ऑक्सीकरण की डिग्री निर्धारित करें: h₂so₄, soo₂, no₂, bf₃, h₂s।
2. किस परमाणुओं की ओर रासायनिक तत्व निम्नलिखित कनेक्शन के अणुओं में सामान्य इलेक्ट्रॉनिक जोड़े प्रदर्शित करता है: H₂o, पीसीएल₃, h₃n, h₂s, co₂? एक उचित जवाब दें।
3. यदि पानी में बदला जाता है तो परमाणुओं के ऑक्सीकरण की डिग्री बदल जाती है साधारण पदार्थ - हाइड्रोजन और ऑक्सीजन? उत्तर बताएं।


