Električna energija se naziva svojstvo hemijskog elementa kako bi privukao elektrone svom atomu iz atoma drugih elemenata s kojima ovaj element formira kemijsku vezu u vezama.
Kada se kemijska veza formira između atoma različitih elemenata, opći elektronički oblak se preseljava na elektronektivni negativni atom, zbog čega veza postaje kovalentno polar, a velika razlika elektronegine - ion.
Električna energija se uzima u obzir prilikom pisanja hemijskih formula: Simbol najviše elektronegativnog elementa zabilježen je u binarnim vezama.
Struja se povećava u smjeru s lijeva na desno za elemente svakog razdoblja i smanjuje se u smjeru od vrha do dna za elemente iste grupe PS.
Valencija Element se naziva svojstvo svojih atoma koji će biti povezani na određeni broj drugih atoma.
Postoje kameiometrijska, elektronska valencija i koordinacijski broj. Razmotrit ćemo samo stoichiometrijsku valenciju.
Stoichiometric Valencija pokazuje koliko atoma drugog elementa pridaje atom ovog elementa. Po jedinici valence usvojene valence vodika, jer Vodonik je uvijek samovalentno. Na primjer, u HCL, H 2 o, NH 3 jedinjenja (pravilno pisanje amonijaka H 3 N već se koristi u modernim priručnicima), CH 4 hlor je monavalentni, kisivalni bivalentni, azotni trivalentni i ugljik tetravalenten.
Stoichiometrijska valenca kisika obično je jednaka 2. Budući da gotovo svi elementi formiraju spojeve sa kisikom, prikladno je koristiti kao referencu za određivanje valencija drugog elementa. Na primjer, u spojevima na 2 o, Coo, FE 2 O 3, SO 3 samolarenalentni, kobaltni bivalentni, željezo je trivalentno, sumporni heksavalentni.
U oksidativnim i restorativnim reakcijama bit će važno da utvrdimo stupnjeve elemenata oksidacije.
Stepen oksidacije Element u tvari naziva se stoichiometrijska valencija, snimljena sa potpisom plus ili minus.
Hemijski elementi su podijeljeni u elemente stalna valencija Valence varijabilni elementi.
1.3.3. Molekularne i ne-elastične supstance. Vrsta kristalne rešetke. Ovisnost svojstava tvari iz njihovog sastava i strukture.
Ovisno o tome koji je stanje spoja u prirodi, podijeljeni su u molekularno i ne-enekularno. U molekularne supstance Najmanje strukturne čestice su molekule. Ove supstance imaju molekularne kristalne rešetke. U ne-mekularnim supstancama, atomi ili joni su najmanje strukturne čestice. Kristalna rešetka je atomska, jonska ili metala.
Vrsta kristalne rešetke u velikoj mjeri određuje svojstva tvari. Na primjer, metali koji imaju metalna vrsta kristalne rešetkerazlikuju se od svih ostalih elemenata visoka plastičnost, električna i toplotna provodljivost. Ova svojstva, kao i mnoge druge - kovanje, metalni sjaj itd. Zbog posebne vrste komunikacije između metalnih atoma - metalna veza. Treba napomenuti da se svojstva svojstvena metalima očituju samo u kondenzonsnom stanju. Na primjer, srebro u gasovitim stanju nema fizička svojstva metala.
Posebna vrsta komunikacije u metalima je metalik - zbog nedostatka valentnih elektrona, tako da su zajednički za cijelu strukturu metala. Najjednostavniji model metalne strukture pretpostavljao je da se kristalna rešetka metala sastoji od pozitivnih jona okruženih besplatnim elektronima, kretanje elektrona dolazi kaotično, poput plinskih molekula. Međutim, takav model, kvalitativno objašnjavajući mnoga svojstva metala, s kvantitativnim provjerom pokaže se nedovoljnim. Daljnji razvoj teorije metalnog stanja doveo je do stvaranja zonska teorija metalašto se zasniva na performansama kvantne mehanike.
U čvorovima kristalne rešetke nalaze se kationi i metalni atomi, a elektroni se slobodno pomjeraju duž kristalne rešetke.
Karakteristična mehanička imovina metala je plastičanZbog osobina unutarnje strukture njihovih kristala. Pod plastičnošću, sposobnost tijela pod djelovanjem vanjskih snaga za prolaze deformaciju, što ostaje i nakon prestanka vanjskog utjecaja. Ova nekretnina metala omogućava im da im daju drugačiji oblik prilikom rezanja, vožnji metala u listove ili ga povuku u žicu.
Plastičnost metala je zbog činjenice da se sa vanjskim efektima slojeva iona koji čine kristalne rešetke, premješteni su u odnosu na međusobno bez probijanja. To se događa kao rezultat činjenice da se kretanje elektrona zbog slobodne preraspodjele i dalje komuniciraju između ionskih slojeva. U mehaničkom učinku na krutinu s nuklearnom rešetkom, njegovi odvojeni slojevi se pomaknute i prijanjanje između njih je polomljeno zbog rupture kovalentne veze.
ioniTada se ove tvari obrađuju iON tip kristalne rešetke.

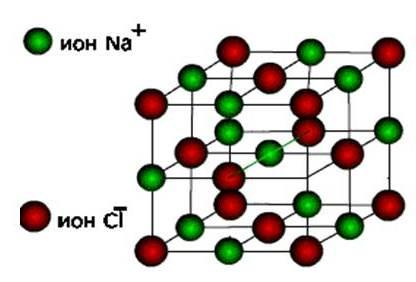
Ovo su soli, kao i oksidi i hidroksidi tipičnih metala. To su čvrste, krhke tvari, ali njihov glavni kvalitet : Rješenja i topi tih spojeva provode električnu struju.
Ako se nalaze u čvorovima kristalne rešetke atomiTada se ove tvari obrađuju atomska vrsta kristalne rešetke(Diamond, Bor, silicijum aluminijum i silikonski oksidi). Prema nekretninama, vrlo čvrstim i vatrostalnim, netopljivim u vodi.
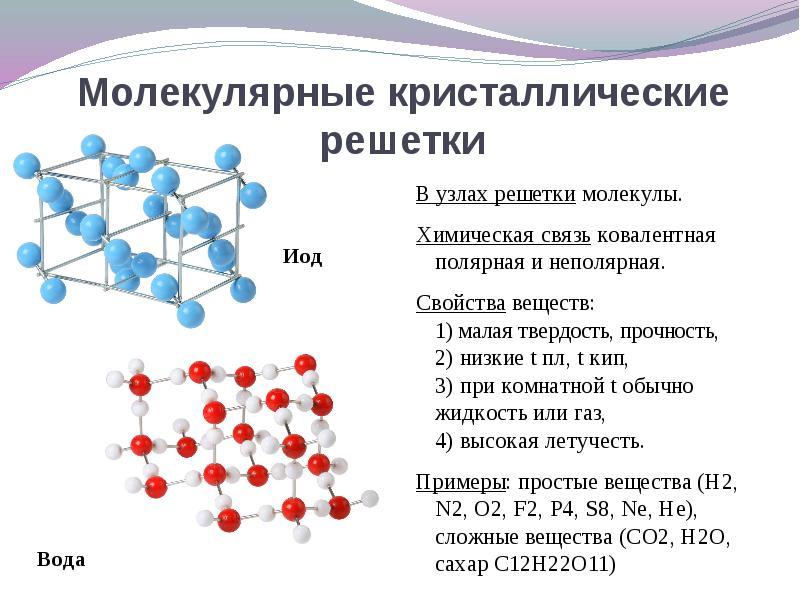
Ako se nalaze u čvorovima kristalne rešetke molekuleOve tvari se formiraju (u normalnim uvjetima gasova i tekućina: O 2, HCl; i 2 organske materije).
Zanimljivo je primijetiti metal galija, koji se topi na temperaturi od 30 o C. Ovaj anomalija objašnjava činjenicom da se GA 2 molekule i njena svojstva nalaze u sklopovima kristalne rešetke, koji su slični tvarima koji imaju molekularna kristalna mreža.
Primjer.Nemolekularna struktura ima sve nemetale grupe:
1) ugljik, boron, silicijum; 2) fluor, bromin, jod;
3) kisik, sumpor, azot; 4) hlor, fosfor, selen.
U ne-elastične supstance Najmanje strukturne čestice su atomi ili joni. Kristalna rešetka je atomska, jonska ili metalna
Za rješenje Ovo je pitanje lakše odlaziti od suprotnog. Ako se nalaze u čvorovima kristalne rešetke molekuleTada se ove tvari obrađuju molekularna vrsta kristalne rešetke(u normalnim uvjetima gasova i tečnosti: O 2, HCl; takođe i 2, rombični sumpor sa 8, bijeli fosfor P 4, organske tvari). Svojstvima su to krhki spojevi sa niskim topljenjem.
U drugom odgovoru postoji fluorski plin, u trećem - plinovima kisikom, azotu, u četvrtom - hlorskom plinu. Dakle, ove supstance imaju molekularne kristalne rešetke i molekularna struktura.
U prvo Odgovorite na sve tvari - čvrstim spojevima u normalnim uvjetima i formiraju nuklearnu rešetku, što znači da postoji ne-etika.
Tačan odgovor:1) carbon, Bor, Silicon
- Najmanje elektronegativni je hemijski element.
- gvožđe
- magnezijum
- kalcijum
Treba obratiti pažnju na frazu "najmanje elektronegativ", tj. Element sa najvećim metalnim svojstvima. Ovaj argument će eliminirati iz mogućih azotskih odgovora kao ne-metala, a za boravak na kalcijumu, kao što su najaktivniji od metala predloženih u zadatku. Odgovor: 4.
- Najpotalnija hemijska veza u jednom od molekula
- CL 4.
- St. 4.
Poznavanje obrazaca promjena u elektrona u periodima i grupama periodičnog sistema di mendeleev omogućava isključenje sa liste kvadratnih kvadrata Carbon Metan CH 4, a od preostalih halogenika za zaustavljanje u CF 4, kao na Spoj ugljika s najviše elektronegiranih svih hemijskih elemenata - fluor. Odgovor: 2
- U kloridnim molekulama i klornim hemijskim komunikacijama, respektivno
- jonski i kovalentni polar
- jonski i kovalentni ne-polar
- kovalentni polar i kovalentni ne-polar
- vodonik i kovalentni ne-polar
Ključna riječ za brzo i ispravno izvršavanje ovog zadatka je riječ "respektivno". U predloženim verzijama samo jedan od odgovora započinje riječima "kovalentnim polarnim", tj. Obveznice karakteristične za Chloroodor. Odgovor: 3.
- Stupanj oksidacije mangana u spoju, formula od kojih je 2 Mno 4, jednaka je
Poznavanje pravila za izračunavanje stupnjeva oksidacije elemenata od strane formule omogućit će vam da odaberete pravi odgovor. Odgovor: 3.
- Najmanji stepen oksidacije ima sumpor u soli
- sulfatni kalijum
- sulfit kalijum
- sulfidni kalijum
- kalijum hidrosulfat
Očigledno da će brzo ispunjavanje ovog zadatka biti prevođenje imena soli u formulu. Budući da je sumpor element grupe preko, tada je njegov najmanji stepen oksidacije -2. Ova vrijednost odgovara slonu s formulom K 2 S - kalijum sulfid. Odgovor: 3.
- Stupanj oksidacije je +5 klor atoma u ION-u
- C1O - 4.
- C1O -
- C1O - 3.
- C1O - 2.
Prilikom obavljanja ovog zadatka trebali biste obratiti pažnju na činjenicu da u stanju nema elektroničkih spojeva, ali hlorni ioni s jednim negativnim nabojem ("-"). Budući da je zbroj stupnjeva oksidacije atoma u ION-u jednak optužbi za ion, ukupni negativni naboj atoma kisika u zglobnom jonu treba biti -6 (+5 - 6 \u003d -1). Odgovor: 3.
- Stupanj oksidacije -3 azota ima u svakom od dva spojka
- NF 3 i NH 3
- NH 4 CL i N 2 O 3
- NH 4 CL i NH 3
- HNO 2 i NF 3
Da biste odredili pravi odgovor, potrebno je mentalno podijeliti opcije za odgovore na lijevi i desni zvučni signal. Zatim odaberite onaj u kojem jedinjenja imaju jednostavnije kompoziciju - u našem slučaju, ovo je desni izbrisan binarni spoj. Analiza će eliminirati odgovore 2 i 4, kao u oksidu i fluoridu u dušiku pozitivnim stupnjem oksidacije, kao u manje elektronegativnom elementu. Ovaj argument omogućava isključenje i reagiranje 1, jer je to prva supstanca - svi isti dušični fluorid. Odgovor: 3.
- Na tvari molekularne strukture ne uključuju
- ugljen-dioksid
- metan
- chloroorod
- kalcijum karbonat
Trebali biste obratiti pažnju na negativnu prosudbu, utvrđenu u stanju zadatka. Budući da su gasovi supstance u normalnim uvjetima molekularna kristalna rešetka u čvrstom stanju, stanje dodjele 1-3 ne odgovara stanju stanja. Kalcijum karbonatna atribucija sa solima ponovo potvrđuje pravi odgovor. Odgovor: 4.
- Da li su sljedeće prosudbe o svojstvima tvari i njihovoj strukturi?
SVEDOK ŠEŠELJ - ODGOVOR: Mokra donje rublje se suši u mrazu jer su tvari molekularne strukture sposobne sublimaciju (sublimacija).
B. Vlažno donje rublje se suši u mrazu jer molekuli vode imaju nisku molekularnu težinu.
- tRUE samo A.
- samo samo B.
- obje presude su istinite
- obje presude nisu istinite.
Znanje fizička svojstva Supstance molekularne strukture omogućavaju odlučivanje da je uzrok sušenja suhog rublja u mrazu sposobnost leda do sublimacije, a ne dipole strukture molekula vode. Odgovor: 1.
- Molekularna struktura ima svaku od tvari, od kojih su formule date u nizu
- CO 2, HNO 3, SAO
- Na 2 s, br 2, br. 2
- H 2 SO 4, CU, 3
- SO 2, I 2, NSL
Budući da predložene opcije sadrže tri tvari, logično je mentalno podijeliti ove verzije u tri vertikalna zvučna signala. Analiza svake od njih, počevši od supstanci jednostavnijeg sastava (prosjek Podstolbik), eliminirat će odgovor 3, jer sadrži metalni bakar, ima metalnu kristalnu mrežu. Slična analiza desnog zvučnog signala omogućit će eliminiranje odgovora 1, jer sadrži oksid metala na terenu (jonska rešetka). Od dvije preostale opcije potrebno je isključiti opciju 2, jer sadrži alkalnu metalnu sol - natrijum sulfid (ion rešetka). Odgovor: 4.
Zadaci za nezavisni rad
- Stupanj oksidacije je +5 eksponata dušika u spoju, od kojih je formula
- N 2 o 5
- N 2 o 4
- N 2 O.
- Stupanj oksidacije hroma u spoju, od kojih je formula (NH 4) 2 CR 2 O 7, jednaka
- Stupanj oksidacije dušika opada u nizu tvari, od kojih se formule
- NH 3, br. 2, kno 3
- N 2 o 4, kno 2, nh 4 cl
- N 2, n 2 o, nh 3
- HNO 3, HNO 2, br. 2
- Stupanj oksidacije hlora povećava se u više tvari, formulama
- NSLO, NSLO 4, Kslo 3
- CL 2, C1 2 O 7, Kslo 3
- CA (C1O) 2, Kslo 3, NSLO 4
- KSL, Kslo 3, Kslo
- Najpotalnija hemijska komunikacija u molekuli
- amonijak
- serovodorod.
- bromomodorod
- fluorodorod
- Supstanca sa kovalentnom ne-polarnom obvezom
- bijeli fosfor
- aluminijski fosfid
- fosfor hlorid (v)
- kalcijum fosfat
- Formule tvari samo sa ionskim obveznicama zabilježeno u nizu
- natrijum-hlorid, fosfor hlorid (V), natrijumforijum fosfat
- natrijum oksid, natrijum hidroksid, natrijum peroksid
- seroublerod, kalcijum karbid, kalcijum oksid
- kalcijum fluorid, kalcijum oksid, kalcijum hlorid
- Atomska kristalna rešetka ima
- natrijum oksid
- kalcijum oksid
- sumpor oksid (iv)
- aluminijum oksid
- Veza sa jonskim kristalne rešetke formirano kada hlor interaktivno komunicira
- fosfor
- barijum
- vodonik
- siva
- Da li su sljedeće prosudbe o amonijum hlorid?
SVEDOK ŠEŠELJ - ODGOVOR: Amonijum hlorid je supstanca jonske strukture koju formira kovalentne polarne i jonske veze.
B. Amonijum hlorid - supstanca jonske strukture, a samim tim i čvrsta, vatrostalna i nehlapljiva.
- tRUE samo A.
- samo samo B.
- obje presude su istinite
- obje su presude netačne
08. Struja, stepen oksidacije, oksidacija i oporavak
Raspravimo o značenju izuzetno zanimljivih koncepata koji postoje u hemiji, a što se često događa u nauci, dovoljno zbunjujući i koristi se u obrnutom obliku. To će biti o "elektronegativnosti", "stepena oksidacije" i "Redox reakcije".
Šta to znači - koncept se koristi u obrnutom obliku?
Pokušat ćemo postepeno reći o tome.
Električna energija Pokazuje američki redox svojstva hemijskog elementa. To jest njegova sposobnost da uzme ili daju besplatne fotone. A je li to i izvor ili energetski apsorber (eter). Yang ili yin.
Stepen oksidacije - Ovo je koncept sličan konceptu "elektronegativnosti". Takođe karakteriše redox svojstva elementa. Ali između njih je sljedeća razlika.
Električna energija daje karakteristiku zasebnog elementa. Sama po sebi, izlazi u hemijskom spoju. Iako stupanj oksidacije karakterizira njegove oksidativne i restorativne sposobnosti upravo kada je element dio bilo kojeg molekula.
Razgovarajmo malo o onome što je sposobnost oksidiranja i koja je sposobnost obnavljanja.
Oksidacija - Ovo je proces prijenosa na drugi element besplatnih fotona (elektrona). Oksidacija uopšte ne isključuje elektrone, kao što se sada smatra u nauci. . Kad se element oksidira drugi element, djeluje poput kiseline ili kiseonika (otuda ime "oksidacija"). Oksidirati - znači promovirati uništavanje, propadanje, elemente sagorijevanja . Sposobnost oksidiranja je sposobnost da se uništavanje molekula uzrokuju energijom prenosom njih (besplatni fotoni). Zapamtite da energija uvijek uništava supstancu.
Iznenađujuće, koliko dugo u nauci postoje kontradikcije logike, a ne vidljivo nitko.
Evo, na primjer: "Sada znamo da je oksidirajuća sredstva supstanca koju elektroni stječe, a smanjujući agent je tvar koja im daje" (enciklopedija mladih hemičara, članka "oksidacija i reakcija)".
I odmah dva paragrafa u nastavku: "Najjači oksidant je električna struja (tok negativno napunjenih elektrona)" (ibid.).
Oni. prvi citat kaže da je oksidirajuće sredstvo koji elektroni uzimaju, a u drugom oksidantu nazivaju ono što daje.
I slične pogrešne zaključke koji su međusobno suprotstavljali su da se primoraju da pamte u školama i institutima!
Poznato je da su najbolji oksidanti ne-metali. Štaviše, manji broj razdoblja i više grupnih broja, jači su svojstva oksidansa izražena. Ovo nije iznenađujuće. Ratodali smo razlozima za to u članku posvećenom analizi periodičnog sistema, u drugom dijelu, gdje su govorili o boji nukleona. Od 1. grupe do 8, boja nukleona u elementima se postepeno mijenja iz ljubičaste u crvenu (ako smatrate plavom bojom D- i F-elemenata). Kombinacija žutih i crvenih čestica olakšava povratak akumuliranih besplatnih fotona. Žuta nakuplja, ali držite se slabo. I crveni doprinosi povratku. Stavite fotone - ovo je proces oksidacije. Ali kada su neki crveni, tada nema čestica koje mogu akumulirati fotone. Zato su elementi 8 grupa, plemeniti plinovi, a ne oksidanti, za razliku od njihovih susjeda, halogena.
Restauracija - Ovo je proces suprotnog oksidacije. Sada, u nauci se veruje da kada hemijski element primi elektrone, obnovljen je. Ovo gledište je sasvim moguće razumjeti (ali ne prihvaćanje). Prilikom proučavanja strukture hemijskih elemenata otkriveno je da emituju elektrone. Zaključio da su elektroni dio elemenata. To znači da je prijenos elektronskog elementa, vrsta, obnavljanje izgubljene strukture.
Međutim, u stvari, sve nije u redu.
Elektroni su besplatni fotoni. Nisu jezgro. Oni nisu dio tijela elementa. Privlače ih ulazeći vani i akumuliraju na površini nukleona i između njih. Ali njihova akumulacija uopće nije obnavljanje strukture elementa ili molekule. Suprotno tome, ovi fotoni koji eteriraju eter (energija) oslabi i uništavaju veze između elemenata. A to je proces oksidacije, ali ne i oporavak.
Vratite molekulu, u stvarnosti, - ponesite energiju od nje (u ovom slučaju, besplatnim fotonima), a ne prijaviti. Odabir fotona, reproducnik elementa sabija tvar - vraća ga.
Najbolji smanjujući agenti su metali. Ova nekretnina prirodno slijedi iz njihovog kvalitativnog i kvantitativnog sastava - njihova polja atrakcije su najveća, a na površini nužno postoje mnoge ili dovoljno čestica. plave boje.
Možete čak i povući sljedeće određivanje metala.
Metal - Ovo je hemijski element, u sastavu površinskih slojeva, čiji su nužno plavi čestici.
Ali nemetalan - Ovo je element, u sastavu površinskih slojeva od kojih nema ili gotovo da nema fotona plave boje, a nužno postoji crveno.
Metali sa svojom jakom atrakcijom savršeno uzimaju elektrone. I zato oni smanjuju sredstva.
Dajemo definiciju koncepata "elektronegije", "stepena oksidacije", "Redox reakcije", koji se mogu naći u udžbenicima u hemiji.
« Stepen oksidacije - Uvjetno napunjenost atoma u spoju izračunato na temelju pretpostavke da se sastoji samo od jona. U određivanju ovog koncepta konvencionalno se vjeruje da se veziva (valence) elektroni idu na više elektronegativnih atoma, a samim tim se spojevi sastoje od pozitivnih i negativnih iona. Stupanj oksidacije može imati nultu, negativne i pozitivne vrijednosti koje se obično postavljaju preko simbola elementa odozgo.
Nulta vrijednost stupnja oksidacije pripisuje se atomima elemenata u slobodnoj državi ... Negativnu vrijednost stupnja oksidacije ima te atome na koje se pomakne obveza zavođenje (elektronski par). Fluor u svim svojim vezama jednak je -1. Pozitivan stupanj oksidacije ima atome koji daju valentne elektrone drugim atomima. Na primjer, alkalni i alkalni zemaljski metali, odnosno je +1 i +2. U običnim jonivima jednak je optužbi za ion. U većini spojeva stupanj oksidacije atoma vodika je + 1, ali u hidzidima metala (spojevi s vodikom) i drugima - jednak je -1. Za kisik, stepen oksidacije -2 je karakterističan, ali, na primjer, u spoju sa fluorom bit će +2, a u peroksidacijskom priključku -1. ...
Algebarska zbroj oksidacije atoma u spoju je nula, a u složenom ionju - optužba Iona. ...
Najveći stupanj oksidacije najveća je pozitivna vrijednost. Za većinu elemenata jednak je broju grupe u periodičnom sustavu i važna je kvantitativna karakteristika elementa u svojim vezama. Najmanja vrijednost stupnja oksidacije elementa, koja se javlja u svojim spojevima, uobičajeno je nazvati niži stupanj oksidacije; Sve ostalo - srednji "(enciklopedijski rječnik mladih hemičara, član" Stupanj oksidacije ").
Evo osnovnih informacija koje se odnose na ovaj koncept. Uskoro je povezana s drugim izrazom - "električnom energijom".
« Električna energija - Ovo je sposobnost atoma u molekuli kako bi privukla elektrone uključene u formiranje hemijske veze "(enciklopedijski rječnik omladinskih hemičara, član" Električna energija ").
"Redox reakcije praćene su promjenom stupnja oksidacije atoma koji su dio reagiranja tvari, kao rezultat pokretnih elektrona iz atoma jednog od reagensa (smanjujući agent) na drugi atom. Sa oksidativnim i smanjenim reakcijama, oksidacija (povrat elektrona) i oporavak (dodatak elektrona) (kemijski enciklopedijski rječnik) (hemijski enciklopedijski rječnik ed. I.L. Knunyantz, članak "Redox reakcija").
Prema našem mišljenju, u ova tri koncepta ima prilično nekoliko grešaka.
Kao prvo , Vjerujemo da formiranje hemijske veze između dva elementa uopće nije proces socijalizacije njihovih elektrona. Hemijska veza je gravitaciona veza. Elektroni, navodno lete oko kernela, besplatni su fotoni koji se nakupljaju na površini nukleona u tijelu elementa i između njih. Da bi između dva elementa pojavila veza, njihovi besplatni fotoni ne trebaju trajati između elemenata. To se ne događa. Zapravo, teži element (privlači) besplatne fotone sa upaljačem i napušta ih (tačnije, na sebi). I zona svjetlijeg elemenata sa kojim su ti fotoni uklonjeni, na jedan ili onaj način. Zbog koje se privlačnost u ovoj zoni se očituje u većoj mjeri. A lakši element privlači jako. Dakle, nastaje hemijska veza.
Drugo , Moderna hemija vidi sposobnost elemenata da privuku elektrone iskrivljene - obrnute. Vjeruje se da je veća elektronegativnost elementa, to više može privući elektrone sebi. A fluor sa kisikom navodno je najbolje - privlače druge elektrone sebi. Kao i drugi elementi 6 i 7 grupa.
U stvari, ovo mišljenje nije više od zablude. Zasnovan je na pogrešnom pogledu, kao da je više grupnog broja, teže stavke. A takođe, veće je pozitivan naboj jezgra. Ovo je sranje. Naučnici se ne uznemiravaju i da objasne da je sa njihovog stanovišta "naboj". Jednostavno, kao u numeriranju, oni su preračunali sve elemente po redu, a potpisani su u skladu s brojem vrijednosti naplate. Sjajno pohod!
Ovo je jasno i dijete da je plin lakši od gustog metala. Kako se dogodilo da se u hemiji smatra da gasovi bolje privlače elektrone?
Gusti metali, naravno, bolji su privlačni elektroni.
Naučnike-hemičari, naravno, mogu ostaviti koncept "elektronegance" u toku, jer je tako čest. Međutim, oni će morati promijeniti svoje značenje na suprotnom direktnom.
Električna energija - Ovo je sposobnost hemijskog elementa u molekuli da privuče elektrone. I, naravno, na metalima, ta je sposobnost bolje izražena od nemetala.
Što se tiče električnih stupova u molekuli, tada, zaista, negativan pol - Ovo su nemetalni elementi koji daju elektrone sa manjim poljima atrakcije. Ali pozitivno - Uvijek su elementi s izraženim metalnim svojstvima, s velikim poljima atrakcije.
Osmjehnite se zajedno.
Električna energija - Ovo je još jedan, drugi pokušaj da se opisa kvalitet hemijskog elementa, zajedno sa već postojećim vaganjem i punjenjem. Kako se često događa, naučnici iz drugog područja nauke, u ovom slučaju, kao da ne vjeruju svojim kolegama fizičarima, već samo zato što bilo koja osoba, izrada otkrivanja, i ne Samo istraživanje iskustva drugih.
Tako se dogodilo ovaj put.
Masa i optužba nisu pomogli da razumiju šta se shvate što se događa u atomima kada su međusobno komunicirali - i uveden je elektronegat - sposobnost elementa da privuče elektrone uključene u formiranje hemijske veze. Trebalo bi da se prepozna da je ideja o ovom konceptu postavljena vrlo istina. Sa jedinim amandmanom da odražava stvarnost u obrnutom obliku. Kao što smo rekli, najbolje je privući metalne elektrone, a ne nemetale - na osnovu karakteristika boje površinskih nukleona. Metali su najbolja smanjuje agente. Nemetals - oksidanti. Metali se uzimaju, ne-metali daju. Metali - yin, Nemmetalla - Yang.
Ezoterični dolazi da pomogne nauci u pitanjima da shvate tajne prirode.
U vezi oksidacijski stupanj Ovo je dobar pokušaj razumijevanja kako se raspodjela slobodnih elektrona događa u hemijskom spoju - molekulama.
Ako je hemijski spoj ravnomjerno - to jeste, jednostavno je, njegova struktura sastoji se od elemenata iste vrste - tada je sve istina, zaista stupanj oksidacije bilo kojeg elementa u spoju je nula. Budući da u ovoj vezi nema oksidansa i nema ponosa. I svi su elementi jednaki u kvaliteti. Niko ne uzima elektrone, niko ne daje. Bilo da se radi o gustoj supstanci ili tekućini ili gas - bez obzira.
Stupanj oksidacije, kao i elektronegativnosti, pokazuje kvalitetu hemijskog elementa - samo u okviru hemijskog elementa. Stupanj oksidacije dizajniran je za usporedbu kvalitete hemijskih elemenata u spoju. Po našem mišljenju ideja je dobra, ali njegova implementacija ne zadovoljava baš zadovoljava.
Kategorički smo protiv cijele teorije i koncepta strukture hemijskih elemenata i povezanosti između njih. Pa, ako samo zato što je broj grupa, prema našim idejama, trebao biti veći od 8. i samim tim, cijeli sistem se urušava. Da, a ne samo to. Općenito, preračunajte broj elektrona u atomima "prstiju", nekako nije ozbiljan.
U skladu s trenutnim konceptom, on se ispostavilo da su najjači oksidizeri dodijeljeni najmanji uslovni naboji - Fluor ima naplaćuju -1 u svim spojevima, kiseonik gotovo svugdje -2. I u vrlo aktivnim metalima - alkalnom i alkalnom zemljom - ove troškove, odnosno, +1 i +2. Uostalom, apsolutno nije logičan. Iako, ponavljamo, vrlo dobro razumijemo opću shemu, u skladu s kojom je to učinjeno - sve radi 8 grupa u tablici i 8 elektrona na vanjskom nivou energije.
Međutim, na minimum, veličina tih optužbi u halogenu i kisiku trebalo je biti najveći sa znakom minus. I alkalni i alkalni metali zemlje su takođe veliki, samo uz znak plus.
U bilo kojem hemijski spoj Postoje elementi koji daju elektrone - oksidanti, nemetali, negativne troškove i elemente koji uzimaju elektrone - smanjujući agente, metale, pozitivna naknada. To je upravo način da se usporedi elementi, odnose ih jedni prema drugima i pokušati, određujući njihov stupanj oksidacije.
Međutim, da se sazna na ovaj način stupanj oksidacije, po našem mišljenju, ne odražava baš tačno stvarnost. Bilo bi tačno da uporedimo elektronamjernost elemenata u molekuli. Napokon, elektronegativnost je gotovo jednaka stupnju oksidacije (karakterizira kvalitetu, samo poseban element).
Možete uzeti skalu električne energije i staviti je u formulu za svaki element. A onda će se odmah vidjeti, koji su elementi date elektrone, a koji su uzeti. Taj element čija elektronegativnost u spoju je najviši - negativni pol, daje elektrone. I onaj čija je elektronegivost najmanji - pozitivni pol, uzima elektrone.
Ako su stavke, priznajte, 3 ili 4 u molekuli, ništa se ne mijenja. Sve su takođe postavili veličinu elektronaponošenja i usporedite.
Iako se ne treba zaboraviti nacrtavanje modela strukture molekule. Zaista, u bilo kojem spoju, ako nije jednostavan, to jeste, ne sastoji se od jedne vrste elemenata, međusobno su povezani, prije svega, metale i nemetale. Metali Odaberite elektrone u nemetalu i vežite ih. A u jednom elementu nemetalnog, elektroni 2 se mogu odabrati istovremeno ili veći broj elemenata s izraženim metalnim svojstvima. Tako se pojavljuje kompleks, složeni molekul. Ali to ne znači da će u takvoj molekuli metalni elementi doći u čvrstom vezu i jedni s drugima. Možda će se naći na suprotnim stranama jedan od drugog. Ako u blizini - oni će privući. Ali čvrsta veza formira se samo ako je jedan element metalniji od drugog. Obavezno napravite jedan element odabir elektrona - uklonjeno. Inače se element neće dogoditi - izuzeće od besplatnih fotona na površini. Polje atrakcije neće se očitovati dobro, a neće biti trajne veze. to složena tema - Obrazovanje hemijske vezeI o tome nećemo detaljno reći u ovom članku.
Vjerujemo da smo visoko zapalili temu posvećenu analizi koncepata "elektronegicity", "oksidacijskog stepena", "oksidacije" i "restauracije" i pružaju vam pažnju puno znatiželjnih informacija.
Iz snova za upravljanje knjigama Autor svijeta ElenaObnova "Kada se rodi jedinstveni znak indie-apeam, suština i život podijeljeni su na dva. Od ove točke, ako završni svijet ne dosegne, suština i život se više nikada neće videti. " William, "misterija zlatnog cvijeta" nakon Instituta
Iz knjige Knjiga tajna. Nevjerojatno očito na zemlji i inostranstvu Autor Vyatkin Arkady DmitrievichMazohizam kao ekstremni stupanj dobrovoljnog vampirizma u tom smislu mazohizam je sličan telekomunikacijama. Mazohisti su ljudi koji primaju ugodne senzacije iz vlastite fizičke i mentalne patnje. Drugim riječima, sviđa im se kad su pobijedili, rugaju, rugaju se
Iz knjige vampiri u Rusiji. Sve što trebate znati o njima! Autor Bauer AlexanderKako odrediti stupanj gubitka krvi kada vampir pije krv, a zatim piti odjednom iz polu-litre do jednog i pol litara krvi. Ljudsko tijelo sadrži samo pet ili šest litara krvi, tako da takav gubitak krvi nije nužno opasan za život. Međutim, vampir može
Iz modeliranja knjige budućnosti u snu Autor svijeta ElenaObnova nakon distribucije instituta, radila kao inženjer u zatvorenoj kompaniji, shvatio sam da nisam na svom mjestu, pa sam odlučio da promenim profesiju i uđe u jazz školu improvizacije, a kasnije u muzičkoj školi za klasičnu kancelariju .
Iz knjige Zlatna pravila Fengshui. 10 jednostavnih koraka do uspjeha, blagostanja i dugovječnosti Autor Rudin Valentin LeonidovičStupanj negativnog utjecaja vanjskih objekata najveći negativan utjecaj na vanjske predmete su, odmah prije ulaska u kuću. Ali što se više nalaze pod uglom do ulaza, slabiji postaje njihov utjecaj. Objekt je direktno
autor Eduard CurePrva stepena: Kuhanje. Nagorny Sermon i Kristov Kraljevstvo Božji Krist započinje Galilejnim idilicom i najavom "Božjeg Kraljevstva". Ovo predviđanje ukazuje na njegove popularne upute. Istovremeno, to je priprema za više povišenih
Iz knjige Božanske evolucije. Od sfinga do Krista autor Eduard CureDrugi stepen inicijacije (čišćenje). Divno zacjeljivanje. Kršćanska terapija u svim drevnim misterijama za moralno i intelektualna priprema trebala je čistiti dušu, koja bi trebala oživjeti nove organe u njemu i dati je naknadno sposobnost
Iz knjige Velika zagonetka sfingom Autor Barbaren GeorgesObnova statue Stvarna starost velikog sfinga se vraća na početak Adam Ere. Barem je savremena piramida, a koji je on, kao što ćemo ga vidjeti, dovršili. Slika velikog sphynxa izložena je istekle stoljećima
Iz knjige zacjeljivanje duše. 100 meditativnih tehnika, ljekovita vježbe i opuštanje Autor Rajnski Bhagwan SriObnova ritma ... Instalirajte isto vrijeme za odlazak u krevet - ako je svake večeri jedanaest, to znači da je jedanaest. Ovo je prvo: Uskoro će tijelo moći ući u ovaj ritam. Ne mijenjajte ovaj put, u protivnom ćete izabrati telo. Telo
Autor Kuzmishin E. L.Stupanj studentskog prijema do studentove diplome. Dekoracija lože i domena i plafon lože trebaju biti pečena plava i bijela materija bez pozlata. Preko glave stručnog master-a nalazi se okružen sjajem trokuta s imenom u svom centru
Iz knjige Caliosostro i egipatskog freemasonry Autor Kuzmishin E. L.Prijem u studentu. Dekoracija loža i domena i strop lože trebali bi biti obješen plavom i bijelom materijom bez pozlaćenja. Preko glave stručnog master-a nalazi se okružen sjajem trokuta s imenom "Jehova", vezeno u njegovom centru
Iz knjige Autobiografija joga Autor Yogananda ParamyansaPoglavlje 23 Dobivam univerzitetsku diplomu - zanemarite filozofske definicije iz udžbenika nesumnjivo računajući na to da će vas neko zaokružujuće "intuicija" držati kroz sve ispite. Ali ako se hitno ne savjetujete sa više naučnika, onda ću morati
Iz knjige Kabale. Najviši svijet. Početak puta Autor Lightman Michael.7.5. Stupanj svesti o zlu kako je pojašnjeno u članku "Torusting", zadovoljstvo i blaženstvo, određuju se stepenom sličnosti Stvoritelja prema nekretninama i nestrpljenjem i nestrpljenjem - stepen razlika od Stvoritelja. U skladu s tim, egoizam je odvratan za nas i nepodnošljivo boja,
Opcija 1
1. Odredite stupanj oksidacije atoma hemijskih elemenata u sljedećim vezama: HNO₃, NO₂, H₃n, So₂, n₂o.
2. Iskoristite periodičnu tablicu, postavite sljedeće elemente kako biste smanjili elektronegativnost: O, N, BE, B, LI, C. U ovom retku trebaju biti smještene fluor i natrijum. Objasnite odgovor. 
3. Kako se mjeri stupanj oksidacije sumpornog atoma kada je tako "? Odgovor Objasnite odgovor.
Opcija 2.
1. Odredite stupanj oksidacije atoma hemijskih elemenata u sljedećim vezama: Co₂, H₃po₄, sih₄, p₂o₅, mg₂si.
2. U smjeru atoma od kojih se hemijski element prebacuje generalno elektronski parovi, Molekuli sljedećih veza: BF₃, PCL₃, CS₂, CCL₄, HBR? Dati razuman odgovor.
3. Da li se stepen promene ugljičnog oksidacije tokom formiranja koalična kiselina H₂co₃ ugljični dioksid i voda? Odgovor Objasnite odgovor.
Opcija 3.
1. Odredite stupanj oksidacije atoma hemijskih elemenata u sljedećim vezama: Cl₂, Naclo, CACL₂, HF, So₃, cl₂o₇.
2. Korištenje periodični sistem Hemijski elementi, postavite sljedeće elemente u redoslijedu povećanja njihove elektronegije: P, al, CL, NA, S, mg. Pronađite kalijum i fluorin u ovom nizu. Odgovor Objasnite odgovor. 
3. Kako se stepen promjene ugljičnog oksidacije prilikom izgaranja metana Ch₄ sa formiranjem ugljičnog oksida (IV) i vode? Odgovor Objasnite odgovor.
Opcija 4.
1. Odredite stupanj oksidacije atoma hemijskih elemenata u sljedećim vezama: H₂so₄, So₂, NO₂, BF₃, H₂s.
2. Prema atomima od kojih hemijski elementi Prikazuje opće elektroničke parove, u molekulama sljedećih veza: H₂o, PCL₃, H₃n, H₂s, Co₂? Dati razuman odgovor.
3. Da li se stepeni oksidacije atoma mijenjaju kada se voda promijeni iz jednostavne tvari - Vodonik i kisik? Odgovor Objasnite odgovor.


