الكهربية هي خاصية لعنصر كيميائي لجذب الإلكترونات إلى ذراته من ذرات العناصر الأخرى التي يشكل بها هذا العنصر رابطة كيميائية في المركبات.
عندما تتشكل رابطة كيميائية بين ذرات من عناصر مختلفة ، تتحول سحابة الإلكترون الشائعة إلى ذرة أكثر كهرسلبية ، ونتيجة لذلك تصبح الرابطة قطبية تساهميًا ، ومع اختلاف كبير في الكهربية ، أيونية.
تؤخذ الكهربية في الاعتبار عند كتابة الصيغ الكيميائية: في المركبات الثنائية ، يتم كتابة رمز العنصر الأكثر كهرسلبية خلفه.
تزداد الكهربية من اليسار إلى اليمين لعناصر كل فترة وتنخفض من أعلى إلى أسفل لعناصر نفس مجموعة PS.
التكافؤ العنصر هو خاصية ذراته لتتحد مع عدد معين من الذرات الأخرى.
يميز بين التكافؤ المتكافئ والإلكتروني ورقم التنسيق. سننظر فقط في التكافؤ المتكافئ.
متكافئ يُظهر التكافؤ عدد ذرات عنصر آخر مرتبطة بذرة هذا العنصر. يتم اعتبار وحدة التكافؤ بمثابة تكافؤ الهيدروجين ، منذ ذلك الحين الهيدروجين أحادي التكافؤ دائمًا. على سبيل المثال ، في المركبات HCl و H 2 O و NH 3 (يتم استخدام التهجئة الصحيحة للأمونيا H 3 N بالفعل في الكتيبات الحديثة) ، يكون CH 4 الكلور أحادي التكافؤ ، والأكسجين ثنائي التكافؤ ، والنيتروجين ثلاثي التكافؤ والكربون رباعي التكافؤ.
عادةً ما يكون التكافؤ المتكافئ للأكسجين هو 2. نظرًا لأن جميع العناصر تقريبًا تشكل مركبات بالأكسجين ، فمن الملائم استخدامه كمعيار لتحديد تكافؤ عنصر آخر. على سبيل المثال ، في المركبات Na 2 O ، CoO ، Fe 2 O 3 ، SO 3 ، الصوديوم أحادي التكافؤ ، الكوبالت ثنائي التكافؤ ، الحديد ثلاثي التكافؤ ، الكبريت سداسي التكافؤ.
في تفاعلات الأكسدة والاختزال ، سيكون من المهم بالنسبة لنا تحديد حالات أكسدة العناصر.
حالة الأكسدة يسمى عنصر ما في مادة التكافؤ المتكافئ ، ويؤخذ بعلامة زائد أو ناقص.
تنقسم العناصر الكيميائية إلى عناصر التكافؤ المستمر عناصر التكافؤ المتغير.
1.3.3. مواد التركيب الجزيئي وغير الجزيئي. نوع شعرية كريستال. اعتماد خصائص المواد على تكوينها وبنيتها.
اعتمادًا على حالة المركبات في الطبيعة ، يتم تقسيمها إلى جزيئية وغير جزيئية. في المواد الجزيئية أصغر الجزيئات الهيكلية هي الجزيئات. هذه المواد لها شبكة بلورية جزيئية. في المواد غير الجزيئية ، أصغر الجسيمات الهيكلية هي الذرات أو الأيونات. شبكتها البلورية ذرية أو أيونية أو معدنية.
يحدد نوع الشبكة البلورية إلى حد كبير خصائص المواد. على سبيل المثال ، المعادن ذات نوع معدني من الكريستال شعرية، تختلف عن جميع العناصر الأخرى اللدونة العالية والتوصيل الكهربائي والحراري... هذه الخصائص ، بالإضافة إلى العديد من الخصائص الأخرى - المرونة ، اللمعان المعدني ، إلخ. بسبب نوع خاص من الرابطة بين ذرات المعدن - اتصال معدني. وتجدر الإشارة إلى أن الخصائص الكامنة في المعادن تظهر فقط في الحالة المكثفة. على سبيل المثال ، لا تحتوي الفضة في الحالة الغازية على الخصائص الفيزيائية للمعادن.
نوع خاص من الروابط في المعادن - معدني - يرجع إلى نقص إلكترونات التكافؤ ، وبالتالي فهي شائعة في هيكل المعدن بأكمله. افترض أبسط نموذج لهيكل المعادن أن الشبكة البلورية للمعادن تتكون من أيونات موجبة محاطة بإلكترونات حرة ، وحركة الإلكترونات تحدث بشكل عشوائي ، مثل جزيئات الغاز. ومع ذلك ، فإن مثل هذا النموذج ، بينما يشرح نوعيًا العديد من خصائص المعادن ، تبين أنه غير كافٍ في التحقق الكمي. أدى التطور الإضافي لنظرية الحالة المعدنية إلى الخلق نظرية المنطقة للمعادنوالتي تقوم على مفاهيم ميكانيكا الكم.
توجد في عقد الشبكة البلورية كاتيونات وذرات معدنية ، وتتحرك الإلكترونات بحرية على طول الشبكة البلورية.
الخاصية الميكانيكية المميزة للمعادن بلاستيك، بسبب خصائص التركيب الداخلي لبلوراتهم. تُفهم اللدونة على أنها قدرة الأجسام الواقعة تحت تأثير القوى الخارجية على الخضوع للتشوه ، والذي يظل حتى بعد إنهاء التأثير الخارجي. تسمح خاصية المعادن هذه بتشكيلها في أشكال مختلفة أثناء التشكيل أو لفها في صفائح أو سحبها في سلك.
ترجع مرونة المعادن إلى حقيقة أنه ، تحت تأثير خارجي ، فإن طبقات الأيونات التي تشكل الشبكة البلورية تتحول بالنسبة إلى بعضها البعض دون تمزق. يحدث هذا نتيجة لحقيقة أن الإلكترونات النازحة ، بسبب إعادة التوزيع الحر ، تستمر في التواصل بين الطبقات الأيونية. تحت تأثير ميكانيكي على مادة صلبة ذات شبكة ذرية ، يتم إزاحة الطبقات الفردية وينكسر الالتصاق بينها بسبب التمزق روابط تساهمية.
الأيونات، ثم تتشكل هذه المواد النوع الأيوني للشبكة البلورية.

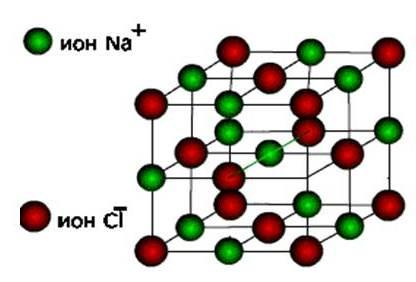
هذه هي الأملاح ، وكذلك أكاسيد وهيدروكسيدات المعادن النموذجية. هذه مواد صلبة وهشة ، لكن نوعيتها الرئيسية : محاليل وانصهار هذه المركبات توصل التيار الكهربائي.
إذا كانت مواقع الشبكة البلورية هي ذرات، ثم تتشكل هذه المواد النوع الذري لشبكة الكريستال(الماس ، البورون ، أكاسيد السيليكون من الألمنيوم والسيليكون). شديد الصلابة وصهر في الخصائص ، غير قابل للذوبان في الماء.
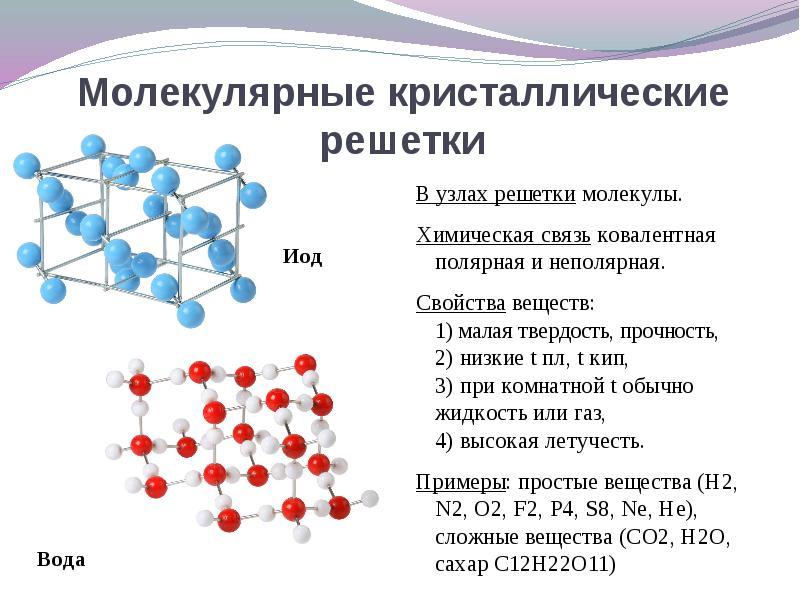
إذا كانت مواقع الشبكة البلورية هي الجزيئات، ثم تتشكل هذه المواد (في ظل الظروف العادية الغازات والسوائل: О 2 ، حمض الهيدروكلوريك ؛ أنا 2 المواد العضوية).
من المثير للاهتمام أن نلاحظ معدن الغاليوم ، الذي يذوب عند درجة حرارة 30 درجة مئوية ، يفسر هذا الشذوذ من خلال حقيقة أن جزيئات Ga 2 تقع في عقد الشبكة البلورية ، وخصائصها التي تتشابه مع المواد ذات شبكة بلورية جزيئية.
مثال.جميع العناصر غير المعدنية للمجموعة لها بنية غير جزيئية:
1) الكربون والبورون والسيليكون. 2) الفلور والبروم واليود.
3) الأكسجين والكبريت والنيتروجين. 4) الكلور والفوسفور والسيلينيوم.
في المواد غير الجزيئية أصغر الجسيمات الهيكلية هي الذرات أو الأيونات. شبكتها البلورية ذرية أو أيونية أو معدنية
متي قرار هذا السؤال أسهل للانتقال من العكس. إذا كانت مواقع الشبكة البلورية هي الجزيئات، ثم تتشكل هذه المواد النوع الجزيئي للشبكة البلورية(في ظل الظروف العادية الغازات والسوائل: О 2 ، حمض الهيدروكلوريك ؛ أيضًا I 2 ، الكبريت المعيني S 8 ، الفوسفور الأبيض Р 4 ، المواد العضوية). وفقًا لخصائصها ، فهي مركبات هشة منخفضة الذوبان.
في الإجابة الثانية ، يوجد غاز الفلور ، في الإجابة الثالثة - الأكسجين وغازات النيتروجين ، في الإجابة الرابعة - غاز الكلور. هذا يعني أن هذه المواد لها شبكة بلورية جزيئية وبنية جزيئية.
في أول الإجابة هي أن جميع المواد عبارة عن مركبات صلبة في ظل الظروف العادية وتشكل شبكة ذرية ، مما يعني أن لها بنية غير جزيئية.
اجابة صحيحة:1) الكربون والبورون والسيليكون
- أقل عنصر كيميائي كهربي هو
- حديد
- المغنيسيوم
- الكالسيوم
يجب الانتباه إلى عبارة "الأقل كهرسلبية" ، أي العنصر الذي يتمتع بأكبر الخصائص المعدنية. ستسمح لنا هذه الحجة باستبعاد النيتروجين من الإجابات المحتملة ، باعتباره مادة غير معدنية ، والتركيز على الكالسيوم ، باعتباره أكثر المعادن نشاطا المقترحة في المهمة. الجواب: 4.
- أكثر الروابط الكيميائية القطبية في أحد الجزيئات
- CCl 4
- سي بي آر 4
تتيح معرفة انتظام التغييرات في الكهربية في فترات ومجموعات الجدول الدوري لـ DI Mendeleev استبعاد الميثان CH 4 من قائمة مركبات الكربون الرباعية التكافؤ ، ومن الهاليدات المتبقية للتوقف عند CF 4 ، كمركب من الكربون مع أكثر العناصر الكيميائية كهربيًا - الفلور. الجواب: 2.
- في جزيئات كلوريد الهيدروجين والكلور ، الرابطة الكيميائية ، على التوالي
- الأيونية والتساهمية القطبية
- الأيونية والتساهمية غير القطبية
- التساهمية القطبية والتساهمية غير القطبية
- الهيدروجين والتساهمية غير القطبية
الكلمة الأساسية لإكمال هذه المهمة بسرعة وبشكل صحيح هي "وفقًا لذلك". في المتغيرات المقترحة ، يبدأ أحد الإجابات بالكلمات "قطبي تساهمي" ، أي خاصية الرابطة لكلوريد الهيدروجين. الجواب: 3.
- حالة أكسدة المنغنيز في مركب صيغته K 2 MnO 4 هي
ستسمح لك معرفة قواعد حساب حالات أكسدة العناصر بالصيغة باختيار الإجابة الصحيحة. الجواب: 3.
- يحتوي الكبريت في الملح على أقل حالة أكسدة
- كبريتات البوتاسيوم
- كبريتيت البوتاسيوم
- كبريتيد البوتاسيوم
- كبريتات هيدروجين البوتاسيوم
من الواضح أن الإنجاز السريع لهذه المهمة سيتم تسهيله من خلال ترجمة أسماء الأملاح إلى صيغ. بما أن الكبريت هو عنصر من عناصر المجموعة VIA ، فإن أدنى حالة أكسدة لها هي -2. تتوافق هذه القيمة مع مركب بالصيغة K 2 S - كبريتيد البوتاسيوم. الجواب: 3.
- حالة الأكسدة +5 ذرة الكلور في الأيون
- C1O - 4
- C1O -
- C1O - 3
- C1O - 2
عند تنفيذ هذه المهمة ، يجب الانتباه إلى حقيقة أنه في الحالة لا يتم إعطاء مركبات محايدة كهربائيًا ، ولكن يتم إعطاء أيونات الكلور بشحنة سالبة واحدة ("-"). نظرًا لأن مجموع حالات الأكسدة للذرات في أيون يساوي شحنة الأيون ، فإن إجمالي الشحنة السالبة لذرات الأكسجين في الأيون المطلوب يجب أن يكون بقيمة -6 (+5 - 6 \u003d -1). الجواب: 3.
- حالة الأكسدة -3 نيتروجين في كل من المركبين
- NF 3 و NH 3
- NH 4 Cl و N 2 O 3
- NH 4 Cl و NH 3
- HNO 2 و NF 3
لتحديد الإجابة الصحيحة ، تحتاج إلى تقسيم خيارات الإجابة عقليًا إلى أعمدة فرعية يسار ويمين. ثم اختر المركب الذي تكون فيه المركبات أبسط - في حالتنا ، هذا هو العمود الفرعي الأيمن للمركبات الثنائية. سيسمح لنا التحليل باستبعاد الإجابات 2 و 4 ، لأن النيتروجين في أكسيد وفلوريد له حالة أكسدة إيجابية ، مثل عنصر أقل كهرسلبية. تسمح لنا هذه الحجة باستبعاد الإجابة 1 ، لأن المادة الأولى فيها هي نفس فلوريد النيتروجين. الجواب: 3.
- المواد الجزيئية لا تشمل
- نشبع
- الميثان
- كلوريد الهيدروجين
- كربونات الكالسيوم
يجب الانتباه إلى الحكم السلبي المتأصل في حالة التنازل. نظرًا لأن المواد الغازية في الظروف العادية لها شبكة بلورية جزيئية في الحالة الصلبة ، فإن الخيارات 1-3 لا تفي بشرط المهمة. إن تخصيص كربونات الكالسيوم للأملاح سيؤكد مرة أخرى الإجابة الصحيحة. الجواب: 4.
- هل الأحكام التالية حول خواص المواد وبنيتها صحيحة؟
ج: الغسيل الرطب يجف في الصقيع لأن المواد ذات التركيب الجزيئي قادرة على التسامي (التسامي).
الغسيل الرطب يجف في البرد لأن جزيئات الماء لها وزن جزيئي منخفض.
- فقط A هو الصحيح
- فقط ب هو الصحيح
- كلا الحكمين صحيحان
- كلا الحكمين غير صحيحين
معرفة الخصائص الفيزيائية تسمح لنا مواد التركيب الجزيئي بأن نقرر أن سبب تجفيف الملابس المبللة في البرد هو قدرة الجليد على التسامي ، وليس التركيب ثنائي القطب لجزيئات الماء. الجواب: 1.
- كل مادة لها بنية جزيئية ، وترد الصيغ في السلسلة
- ثاني أكسيد الكربون ، HNO 3 ، CaO
- Na 2 S ، Br 2 ، NO 2
- H 2 SO 4 ، Cu ، O 3
- SO 2، I 2، HCl
نظرًا لأن الخيارات المقترحة تحتوي على ثلاث مواد لكل منها ، فمن المنطقي تقسيم هذه الخيارات عقليًا إلى ثلاث ركائز رأسية. سيسمح لنا تحليل كل منها ، بدءًا من مواد ذات تركيبة أبسط (العمود الأوسط) ، باستبعاد الإجابة 3 ، لأنها تحتوي على معدن نحاسي ، به شبكة بلورية معدنية. سيسمح لنا تحليل مماثل للعمود الفرعي الأيمن باستبعاد الإجابة 1 ، لأنها تحتوي على أكسيد فلز قلوي أرضي (شعرية أيونية). من الخيارين المتبقيين ، يجب استبعاد الخيار 2 ، لأنه يحتوي على ملح فلز قلوي - كبريتيد الصوديوم (شعرية أيونية). الجواب: 4.
مهام الدراسة الذاتية
- تظهر حالة الأكسدة +5 النيتروجين في المركب ، صيغته
- N 2 O 5
- N 2 O 4
- N 2 O
- حالة أكسدة الكروم في مركب تكون صيغته (NH 4) 2 Cr 2 O 7 هي
- تنخفض حالة أكسدة النيتروجين في عدد من المواد ، صيغ منها
- NH 3 ، NO 2 ، KNO 3
- N 2 O 4 ، KNO 2 ، NH 4 Cl
- N 2، N 2 O، NH 3
- HNO 3 ، HNO 2 ، NO 2
- تزداد حالة أكسدة الكلور في عدد من المواد ، والصيغ منها
- НСlO ، НСlO 4 ، СlO 3
- Сl 2 ، С1 2 O 7 ، СlO 3
- Ca (C1O) 2 ، KClO 3 ، HClO 4
- КСl ، КСlO 3 ، КСlO
- أكثر الروابط الكيميائية القطبية في الجزيء
- الأمونيا
- كبريتيد الهيدروجين
- بروميد الهيدروجين
- فلوريد الهيدروجين
- مادة ذات رابطة تساهمية غير قطبية
- الفوسفور الأبيض
- فوسفيد الألومنيوم
- كلوريد الفوسفور (V)
- فوسفات الكالسيوم
- تتم كتابة صيغ المواد ذات الروابط الأيونية فقط في الصف
- كلوريد الصوديوم ، كلوريد الفوسفور (V) ، فوسفات الصوديوم
- أكسيد الصوديوم ، هيدروكسيد الصوديوم ، بيروكسيد الصوديوم
- ثاني كبريتيد الكربون ، كربيد الكالسيوم ، أكسيد الكالسيوم
- فلوريد الكالسيوم ، أكسيد الكالسيوم ، كلوريد الكالسيوم
- تحتوي الشبكة البلورية الذرية
- أكسيد الصوديوم
- أكسيد الكالسيوم
- أكسيد الكبريت (IV)
- أكسيد الألمونيوم
- اتصال أيوني شعرية الكريستال يتكون من تفاعل الكلور مع
- الفوسفور
- الباريوم
- هيدروجين
- اللون الرمادي
- هل الأحكام التالية حول كلوريد الأمونيوم صحيحة؟
أ- كلوريد الأمونيوم - مادة ذات بنية أيونية ، تتكون بسبب الروابط التساهمية القطبية والأيونية.
ب. كلوريد الأمونيوم مادة ذات بنية أيونية ، وبالتالي فهي صلبة ، مقاومة للحرارة وغير متطايرة.
- فقط A هو الصحيح
- فقط ب هو الصحيح
- كلا الحكمين صحيحان
- كلا الحكمين خاطئين
08. الكهربية ، حالة الأكسدة ، الأكسدة والاختزال
دعونا نناقش معنى المفاهيم الشيقة للغاية الموجودة في الكيمياء ، وكما هو الحال في كثير من الأحيان في العلم ، فهي مربكة ومُستخدمة رأساً على عقب. سنتحدث عن "الكهربية" و "حالة الأكسدة" و "تفاعلات الأكسدة والاختزال".
ماذا يعني هذا - المفهوم مقلوب؟
سنحاول إخبارك عن ذلك تدريجياً.
كهرسلبية يوضح لنا خصائص الأكسدة والاختزال لعنصر كيميائي. أي قدرتها على أخذ أو إعطاء فوتونات مجانية. وأيضًا ما إذا كان هذا العنصر مصدرًا أو ماصًا للطاقة (الأثير). يانغ أو يين.
حالة الأكسدة هو مفهوم مشابه للكهرباء. كما أنه يميز خصائص الأكسدة والاختزال للعنصر. لكن هناك الاختلاف التالي بينهما.
تميز الكهربية عنصرًا واحدًا. في حد ذاته ، خارج العثور عليه في تكوين أي مركب كيميائي. بينما تميز حالة الأكسدة قدرتها على الأكسدة تمامًا عندما يتم تضمين العنصر في تكوين أي جزيء.
دعونا نتحدث قليلاً عن ماهية القدرة على الأكسدة وما هي القدرة على الاستعادة.
أكسدة هي عملية نقل الفوتونات الحرة (الإلكترونات) إلى عنصر آخر. الأكسدة ليست إزالة الإلكترونات على الإطلاق ، كما هو معتقد الآن في العلم ... عندما يؤكسد عنصر ما عنصرًا آخر ، فإنه يعمل مثل الحمض أو الأكسجين (ومن هنا جاء الاسم "الأكسدة"). الأكسدة تعني المساهمة في تدمير العناصر وانحلالها واحتراقها ... القدرة على التأكسد هي القدرة على التسبب في تدمير الجزيئات بواسطة الطاقة المنقولة إليها (الفوتونات الحرة). تذكر أن الطاقة دائمًا ما تدمر المادة.
إنه لأمر مدهش كم من الوقت كانت هناك تناقضات في المنطق في العلم لم يلاحظها أحد.
على سبيل المثال: "نحن نعلم الآن أن العامل المؤكسد هو مادة تكتسب الإلكترونات ، والعامل المختزل هو مادة تفرزها" (موسوعة كيميائي شاب ، مقال "تفاعلات الأكسدة والاختزال)".
وهناك فقرتان أدناه: "أقوى عامل مؤكسد هو التيار الكهربائي (تدفق الإلكترونات سالبة الشحنة)" (المرجع نفسه).
أولئك. يقول الاقتباس الأول أن المؤكسد هو الذي يقبل الإلكترونات ، والثاني هو المؤكسد الذي يستسلم.
وهذه الاستنتاجات الخاطئة المتناقضة تجعلك تحفظ في المدارس والمعاهد!
من المعروف أن أفضل العوامل المؤكسدة هي اللافلزات. علاوة على ذلك ، كلما كان رقم الفترة أصغر وكلما زاد عدد المجموعة ، زادت وضوح خصائص العامل المؤكسد. هذا ليس مستغربا. ناقشنا أسباب ذلك في مقال مخصص لتحليل الجدول الدوري ، في الجزء الثاني ، حيث تحدثنا عن لون النيوكليونات. من المجموعة 1 إلى 8 ، يتغير لون النيوكليونات في العناصر تدريجيًا من البنفسجي إلى الأحمر (إذا أخذنا في الاعتبار أيضًا اللون الأزرق للعناصر d و f). إن الجمع بين الجسيمات الصفراء والحمراء يسهل إطلاق الفوتونات الحرة المتراكمة. يتراكم الأصفر ، لكنه يحتفظ بشكل ضعيف. والأخرى الحمراء تساهم في التأثير. إعطاء الفوتونات هو عملية الأكسدة. ولكن عندما يكون بعضها أحمر ، فلا توجد جسيمات قادرة على تجميع الفوتونات. هذا هو السبب في أن عناصر المجموعة 8 ، الغازات النبيلة ، ليست عوامل مؤكسدة ، على عكس جيرانها ، الهالوجينات.
استعادة هي العملية المعاكسة للأكسدة. في الوقت الحاضر ، في العلم ، يُعتقد أنه عندما يتلقى عنصر كيميائي الإلكترونات ، يتم تقليله. وجهة النظر هذه مفهومة تمامًا (لكنها غير مقبولة). عند دراسة تركيبة العناصر الكيميائية ، وجد أنها تصدر إلكترونات. وخلصوا إلى أن الإلكترونات جزء من العناصر. هذا يعني أن نقل الإلكترونات إلى عنصر ما هو نوع من استعادة بنيته المفقودة.
ومع ذلك ، في الواقع ، هذا ليس هو الحال.
الإلكترونات فوتونات حرة. هم ليسوا نيوكليونات. إنهم ليسوا جزءًا من جسم العنصر. تنجذب ، قادمة من الخارج ، وتتراكم على سطح النوكليونات وفيما بينها. لكن تراكمها لا يؤدي على الإطلاق إلى استعادة بنية عنصر أو جزيء. على العكس من ذلك ، فإن هذه الفوتونات المنبعثة من الأثير (الطاقة) تضعف وتدمر الروابط بين العناصر. وهذه عملية أكسدة ، لكنها ليست اختزالًا.
إن استعادة الجزيء ، في الواقع ، هو أخذ الطاقة منه (في هذه الحالة ، الفوتونات الحرة) ، وليس التواصل. بأخذ الفوتونات ، يكثف عنصر الاختزال المادة - يعيدها.
أفضل عوامل الاختزال هي المعادن. تنبع هذه الخاصية بشكل طبيعي من تركيبها النوعي والكمي - مجالات جاذبيتها هي الأكبر وهناك دائمًا العديد من الجسيمات أو كافية على السطح من اللون الأزرق.
يمكنك حتى استنتاج التعريف التالي للمعادن.
معدن هو عنصر كيميائي ، يجب أن تحتوي طبقات سطحه على جزيئات زرقاء.
و اللافلزية - هذا عنصر في تكوين الطبقات السطحية التي لا توجد فيها فوتونات زرقاء أو تكاد لا توجد فوتونات زرقاء ، وهناك دائمًا فوتونات حمراء.
المعادن بجاذبيتها القوية تزيل الإلكترونات تمامًا. ولذا فهم مرممون.
دعونا نعطي تعريفًا لمفاهيم "الكهربية" ، "حالة الأكسدة" ، "تفاعلات الأكسدة والاختزال" ، والتي يمكن العثور عليها في الكتب المدرسية عن الكيمياء.
« حالة الأكسدة - الشحنة الشرطية للذرة في المركب ، محسوبة على افتراض أنها تتكون فقط من أيونات. عند تحديد هذا المفهوم ، يُفترض تقليديًا أن إلكترونات الترابط (التكافؤ) يتم نقلها إلى ذرات كهرسلبية أكثر ، وبالتالي تتكون المركبات ، كما كانت ، من أيونات موجبة وسالبة الشحنة. يمكن أن تكون حالة الأكسدة صفرية وسالبة وإيجابية ، والتي توضع عادةً فوق رمز العنصر في الأعلى.
تُعزى القيمة الصفرية لحالة الأكسدة إلى ذرات العناصر التي تكون في حالة حرة ... تحتوي القيمة السالبة لحالة الأكسدة على تلك الذرات التي تتجه نحوها سحابة الإلكترون المترابطة (زوج الإلكترون). بالنسبة للفلور بجميع مركباته ، فهو -1. الذرات التي تمنح إلكترونات التكافؤ لذرات أخرى لديها حالة أكسدة موجبة. على سبيل المثال ، في معادن الأرض القلوية والقلوية ، على التوالي ، +1 و +2. في الأيونات البسيطة ، تساوي شحنة الأيون. في معظم المركبات ، تكون حالة أكسدة ذرات الهيدروجين + 1 ، ولكن في هيدرات المعادن (مركباتها مع الهيدروجين) وغيرها ، تكون -1. بالنسبة للأكسجين ، تكون حالة الأكسدة -2 ، ولكن ، على سبيل المثال ، بالاقتران مع الفلور ستكون +2 ، وفي مركبات البيروكسيد -1. ...
المجموع الجبري لحالات أكسدة الذرات في المركب هو صفر ، وفي أيون معقد ، شحنة الأيون. ...
أعلى حالة أكسدة هي أعلى قيمة موجبة. بالنسبة لمعظم العناصر ، فهي تساوي رقم المجموعة في النظام الدوري وهي خاصية كمية مهمة لعنصر في مركباته. عادةً ما تسمى أصغر قيمة لحالة أكسدة عنصر ما والتي تحدث في مركباته بأقل حالة أكسدة ؛ كل ما تبقى هو متوسط \u200b\u200b"(المعجم الموسوعي للكيميائي الشاب ، مقال" حالة الأكسدة ").
هذه هي المعلومات الأساسية المتعلقة بهذا المفهوم. يرتبط ارتباطًا وثيقًا بمصطلح آخر ، الكهربية.
« كهرسلبية - هذه هي قدرة الذرة في الجزيء على جذب الإلكترونات المشاركة في تكوين رابطة كيميائية "(القاموس الموسوعي للكيميائي الشاب ، مقال" الكهربية ").
"تفاعلات الأكسدة والاختزال مصحوبة بتغيير في حالة أكسدة الذرات التي تتكون منها المواد المتفاعلة ، نتيجة انتقال الإلكترونات من ذرة أحد الكواشف (عامل الاختزال) إلى ذرة الآخر. تحدث تفاعلات الأكسدة والاختزال في وقت واحد الأكسدة (إطلاق الإلكترونات) والاختزال (إضافة الإلكترونات) "(المعجم الموسوعي الكيميائي ، محرر بواسطة IL Knunyants ، مقالة" تفاعلات الأكسدة والاختزال ").
في رأينا ، هناك العديد من الأخطاء المخفية في هذه المفاهيم الثلاثة.
في البدايه ، نعتقد أن تكوين رابطة كيميائية بين عنصرين ليس على الإطلاق عملية تنشئة اجتماعية إلكتروناتهم. الرابطة الكيميائية هي رابطة جاذبية. الإلكترونات ، التي يُفترض أنها تطير حول النواة ، هي فوتونات حرة تتراكم على سطح النوكليونات داخل جسم عنصر وبينها. من أجل حدوث اتصال بين عنصرين ، لا تحتاج فوتوناتهما الحرة إلى الالتفاف بين العناصر. هذا لا يحدث. في الواقع ، يزيل العنصر الأثقل (يجذب) الفوتونات الحرة من العنصر الأخف ، ويبقيها (بشكل أكثر دقة ، على نفسه). وتصبح منطقة العنصر الأخف ، التي أزيلت منها هذه الفوتونات ، عارية إلى حد ما. بسبب ما يتجلى الجاذبية في هذه المنطقة إلى حد كبير. وينجذب العنصر الأخف إلى العنصر الأثقل. هذه هي الطريقة التي تنشأ بها الرابطة الكيميائية.
ثانيا ، ترى الكيمياء الحديثة أن قدرة العناصر على جذب الإلكترونات إلى نفسها مشوهة - رأسًا على عقب. يُعتقد أنه كلما زادت القدرة الكهربية لعنصر ما ، زادت قدرته على جذب الإلكترونات إليه. ويفترض أن الفلور والأكسجين يفعلون ذلك بشكل أفضل - فهم يجذبون إلكترونات الآخرين. بالإضافة إلى عناصر أخرى من 6 و 7 مجموعات.
في الحقيقة ، هذا الرأي ليس أكثر من وهم. ويستند إلى الاعتقاد الخاطئ بأنه كلما زاد عدد المجموعة ، زادت العناصر. وأيضًا ، كلما زادت الشحنة الموجبة للنواة. هذا هراء. لا يزال العلماء لا يكلفون أنفسهم عناء شرح ما يشكل ، من وجهة نظرهم ، "شحنة". ببساطة ، كما هو الحال في علم الأعداد ، قاموا بحساب جميع العناصر بالترتيب ، ووضع مقدار الشحنة وفقًا للرقم. ارتفاع كبير!
كما يتضح للطفل أن الغاز أخف من المعدن الكثيف. كيف يُعتقد في الكيمياء أن الغازات هي الأفضل في جذب الإلكترونات إلى نفسها؟
المعادن الكثيفة ، بالطبع ، أفضل في جذب الإلكترونات.
يمكن لعلماء الكيمياء ، بالطبع ، ترك مفهوم "الكهربية" قيد الاستخدام ، لأنه شائع جدًا. ومع ذلك ، سيتعين عليهم تغيير معناه إلى العكس تمامًا.
كهرسلبية هي قدرة عنصر كيميائي في جزيء ما على جذب الإلكترونات لنفسه. وبطبيعة الحال ، يتم التعبير عن هذه القدرة بشكل أفضل في المعادن أكثر من غير المعادن.
أما بالنسبة للأقطاب الكهربائية في الجزيء ، إذن ، في الواقع ، قطب سالب - هذه العناصر غير المعدنية التي تتبرع بالإلكترونات ، مع مجالات جذب أقل. و إيجابي - هذه دائمًا عناصر ذات خصائص معدنية أكثر وضوحًا ، مع مجالات جذب كبيرة.
دعونا نبتسم معا.
كهرسلبية - هذه محاولة أخرى لوصف جودة عنصر كيميائي ، جنبًا إلى جنب مع الكتلة والشحنة الموجودة بالفعل. كما هو الحال غالبًا ، علماء من مجال علمي آخر ، في هذه الحالة ، الكيمياء ، كما لو أنهم لا يثقون بزملائهم الفيزيائيين ، بل لأن أي شخص يقوم باكتشافات يسير في طريقه الخاص ، وليس مجرد استكشاف التجربة من الآخرين.
لذلك حدث ذلك هذه المرة.
لم تفعل الكتلة والشحنة شيئًا لمساعدة الكيميائيين على فهم ما يحدث في الذرات عندما تتفاعل مع بعضها البعض - وتم تقديم الكهربية الكهربية - وهي قدرة عنصر ما على جذب الإلكترونات المشاركة في تكوين رابطة كيميائية. يجب الاعتراف بأن فكرة هذا المفهوم وضعت بشكل صحيح تمامًا. مع التعديل الوحيد الذي يعكس الواقع رأساً على عقب. كما قلنا سابقًا ، من الأفضل جذب الإلكترونات إلى المعادن ، وليس المعادن - نظرًا لخصائص لون النيوكليونات السطحية. المعادن هي أفضل عوامل الاختزال. اللافلزات عوامل مؤكسدة. يتم أخذ المعادن بعيدًا ، ويتم التخلص من المواد غير المعدنية. المعادن - ين ، غير المعادن - يانغ.
تأتي الإيزوتيريكية لمساعدة العلم في مسائل فهم أسرار الطبيعة.
بخصوص حالة الأكسدة ، فهذه محاولة جيدة لفهم كيفية حدوث توزيع الإلكترونات الحرة داخل مركب كيميائي - جزيء.
إذا كان المركب الكيميائي متجانسًا - أي أنه بسيط ، يتكون هيكله من عناصر من نفس النوع - فكل شيء صحيح ، في الواقع حالة أكسدة أي عنصر في المركب هي صفر. بما أن هذا المركب لا يحتوي على عوامل مؤكسدة ولا عوامل اختزال. وجميع العناصر متساوية في الجودة. لا أحد يأخذ الإلكترونات ، ولا أحد يتخلى عنها. سواء كانت مادة كثيفة أو سائلة أو غازية ، فلا يهم.
توضح حالة الأكسدة ، مثل الكهربية ، جودة عنصر كيميائي - فقط في إطار عنصر كيميائي. تم تصميم حالة الأكسدة لمقارنة جودة العناصر الكيميائية في المركب. في رأينا الفكرة جيدة ، لكن تنفيذها ليس مرضيًا تمامًا.
نحن نعارض بشكل قاطع النظرية الكاملة ومفهوم بنية العناصر الكيميائية والروابط بينها. حسنًا ، فقط لأن عدد المجموعات ، وفقًا لأفكارنا ، يجب أن يزيد عن 8. هذا يعني أن النظام بأكمله ينهار. وليس هذا فقط. بشكل عام ، يعد حساب عدد الإلكترونات في الذرات "من جهة" غير خطير إلى حد ما.
وفقًا للمفهوم الحالي ، اتضح أن أصغر الشحنات التقليدية مخصصة لأقوى المؤكسدات - يحتوي الفلور على شحنة -1 في جميع المركبات ، والأكسجين -2 في كل مكان تقريبًا. وبالنسبة للمعادن النشطة للغاية - القلوية والأرض القلوية - فهذه الشحنات ، على التوالي ، +1 و +2. إنه غير منطقي على الإطلاق. على الرغم من أننا نكرر ، فإننا نفهم جيدًا المخطط العام الذي تم بموجبه ذلك - كل ذلك من أجل 8 مجموعات في الجدول و 8 إلكترونات على مستوى الطاقة الخارجية.
كحد أدنى ، يجب أن تكون قيمة هذه الشحنات للهالوجينات والأكسجين هي الأكبر بعلامة ناقص. وفي معادن الأرض القلوية والقلوية ، فهي كبيرة أيضًا ، فقط بعلامة زائد.
في أي مركب كيميائي هناك عناصر تتبرع بالإلكترونات - مؤكسدات ، غير فلزية ، شحنة سالبة ، وعناصر تتبرع بالإلكترونات - عوامل مختزلة ، معادن ، شحنة موجبة. وبهذه الطريقة يتم مقارنة العناصر وربطها ببعضها البعض ومحاولة تحديد حالة الأكسدة الخاصة بها.
ومع ذلك ، فإن معرفة حالة الأكسدة بهذه الطريقة ، في رأينا ، لا تعكس الواقع بدقة. سيكون من الأصح مقارنة الكهربية للعناصر في الجزيء. بعد كل شيء ، تكاد تكون الكهربية هي نفسها حالة الأكسدة (إنها تميز الجودة ، فقط لعنصر واحد).
يمكنك أخذ مقياس الكهربية ووضع قيمها في صيغة كل عنصر. وبعد ذلك سيكون مرئيًا على الفور العناصر التي تتخلى عن الإلكترونات وأي العناصر تتخلص منها. العنصر الذي يكون كهرسلبيته أكبر في المركب - القطب السالب - يتبرع بالإلكترونات. والشخص الذي تكون سلبيته الكهربية هي الأصغر - القطب الموجب ، يأخذ الإلكترونات.
إذا كان هناك ، على سبيل المثال ، 3 أو 4 عناصر في الجزيء ، فلن يتغير شيء. نضع أيضًا قيم الكهربية ونقارن.
ومع ذلك ، يجب ألا تنسى رسم نموذج لبنية الجزيء. في الواقع ، في أي مركب ، إذا لم يكن بسيطًا ، أي لا يتكون من نوع واحد من العناصر ، ترتبط المعادن واللافلزات ببعضها البعض ، أولاً وقبل كل شيء. تأخذ المعادن الإلكترونات من اللافلزات وترتبط بها. ويمكن لعنصرين أو أكثر بخصائص معدنية أكثر وضوحًا أن يأخذوا إلكترونات من عنصر غير فلزي في نفس الوقت. هذه هي الطريقة التي ينشأ بها جزيء معقد ومعقد. لكن هذا لا يعني أنه في مثل هذا الجزيء ستدخل العناصر المعدنية في رابطة قوية مع بعضها البعض. ربما سيكونون موجودين على جانبي بعضهما البعض. إذا بعد ذلك ، سوف ينجذبون. لكن الرابطة القوية تتشكل فقط إذا كان أحد العناصر معدنيًا أكثر من الآخر. من الضروري أن يختار عنصر واحد الإلكترونات - يزيلها. خلاف ذلك ، لن يتعرض العنصر - التحرر من الفوتونات الحرة على السطح. لن يظهر مجال الجذب نفسه بشكل كامل ولن يكون هناك اتصال قوي. هو - هي موضوع معقد - التعليم روابط كيميائية، ولن نخوض في التفاصيل حول هذا في هذه المقالة.
نعتقد أننا غطينا بالتفصيل الكافي الموضوع المكرس لتحليل مفاهيم "الكهربية" و "حالة الأكسدة" و "الأكسدة" و "الاختزال" ، وقدمنا \u200b\u200bلك الكثير من المعلومات الشيقة.
من كتاب الأحلام الموجهة المؤلف مير ايليناالاستعادة "عندما تولد سمة فردية من السمات الفردية ، ينقسم الجوهر والحياة إلى قسمين. من الآن فصاعدا ، ما لم يتم التوصل إلى سلام نهائي ، فلن يرى الجوهر والحياة بعضهما البعض مرة أخرى ". ويليام ، "سر الزهرة الذهبية" بعد الكلية
من كتاب الأسرار. ما لا يصدق واضح على الأرض وما بعدها مؤلف فياتكين أركادي دميترييفيتشالماسوشية كدرجة قصوى من مصاص الدماء الطوعي بهذا المعنى ، فإن الماسوشية تشبه الاعتمادية. الماسوشيون هم أناس يتلقون أحاسيس ممتعة من معاناتهم الجسدية والعقلية. بعبارة أخرى ، يحبون أن يتعرضوا للضرب والتوبيخ والتخويف
من كتاب مصاصي الدماء في روسيا. كل ما تريد معرفته عنهم! مؤلف باور الكسندركيفية تحديد مستوى فقدان الدم عندما يشرب مصاص دماء الدم ، يشرب من نصف لتر إلى لتر ونصف من الدم في المرة الواحدة. يحتوي جسم الإنسان على خمسة إلى ستة لترات فقط من الدم ، لذا فإن فقدان الدم هذا لا يشكل بالضرورة تهديدًا على الحياة. ومع ذلك ، يمكن لمصاص الدماء
من كتاب نمذجة المستقبل في حلم المؤلف مير ايليناالتعافي بعد التخرج ، عملت كمهندس في مؤسسة مغلقة ، أدركت أنني لست في مكاني ، لذلك قررت تغيير مهنتي ودخلت مدرسة موسيقى الجاز للارتجال ، وبعد ذلك القسم الكلاسيكي في مدرسة الموسيقى.
من كتاب القواعد الذهبية لفنغ شوي. 10 خطوات سهلة للنجاح والرفاهية وطول العمر مؤلف اوجودين فالنتين ليونيدوفيتشدرجة التأثير السلبي للأشياء الخارجية تمارس الأجسام الخارجية أكبر تأثير سلبي ، حيث تكون مباشرة أمام مدخل المنزل. ولكن كلما زاد وجودهم في زاوية المدخل ، كلما أصبح تأثيرهم أضعف.
المؤلف شور ادواردالدرجة الأولى: الطبخ. العظة على الجبل وملكوت الله يبدأ عمل المسيح بجمال جليلي وإعلان "ملكوت الله". يوجهنا هذا التنبؤ إلى تعاليمه الشعبية. في الوقت نفسه ، إنه تحضير لمزيد من الروعة
من كتاب التطور الإلهي. من أبو الهول إلى المسيح المؤلف شور ادواردالدرجة الثانية من الابتداء (التنقية). معجزات الشفاء. العلاج المسيحي في جميع الأسرار القديمة ، تبع الإعداد الأخلاقي والفكري تنقية الروح ، والتي ينبغي أن تحيي أعضاء جديدة فيها ومن ثم تمنحها القدرة.
من كتاب لغز أبو الهول العظيم المؤلف باربارين جورجترميم التمثال يعود العمر الفعلي لأبو الهول العظيم إلى بداية العصر الآدمي. إنه على الأقل معاصر للأهرامات ، وقد أكمل مجموعته ، كما سنرى ، مع نفسه. تم الكشف عن صورة أبو الهول على مدى القرون الماضية
من كتاب شفاء الروح. 100 تقنية تأمل وتمارين علاجية واسترخاء مؤلف راجنيش بهاجوان شرياستعادة الإيقاع ... اضبط نفس الوقت للذهاب إلى الفراش - إذا كان الساعة 11 مساءً كل يوم ، فهذه هي الأولى: ابدأ وقتًا معينًا ، وسرعان ما سيتمكن الجسم من دخول هذا الإيقاع. لا تغير هذه المرة ، وإلا فسوف تربك الجسد. جسم
المؤلف Kuzmishin E.L.درجة المتدرب القبول لدرجة المتدرب. زخرفة الصندوق والأثواب. يجب تعليق جدران الصندوق وسقفه بقطعة قماش بيضاء وزرقاء بدون طلاء بالذهب. يوجد فوق رأس السيد العبد مثلث محاط بإشراق مع كتابة الاسم في وسطه
من كتاب كاليوسترو والماسونية المصرية المؤلف Kuzmishin E.L.القبول في درجة الديكور المبتدئ للنزل والأثواب يجب تعليق جدران وسقف النزل بقطعة قماش زرقاء وبيضاء بدون طلاء بالذهب. فوق رأس السيد العبد مثلث محاط بإشراق مكتوب في وسطه اسم "يهوه" مطرز
من كتاب السيرة الذاتية يوغي مؤلف يوغاناندا باراماهانزاالفصل 23 أحصل على شهادة جامعية - أنت تتجاهل التعريفات الفلسفية لكتابك المدرسي ، ولا شك أنك تعتمد على بعض "الحدس" غير المزعج لإرشادك خلال امتحاناتك. لكن إذا لم تلجأ بشكل عاجل إلى طريقة أكثر علمية ، فعندئذ يجب عليّ ذلك
من كتاب الكابالا. العالم العلوي. بداية الطريق مؤلف ليتمان مايكل7.5 درجة وعي الشر كما هو موضح في مقال "إعطاء التوراة" ، تتحدد اللذة والنعيم بدرجة التشابه مع الخالق في الخصائص ، وتتحدد المعاناة ونفاد الصبر بدرجة الاختلاف عن الخالق. وعليه فإن الأنانية مقززة لنا ومؤلمة لا تحتمل ،
الخيار 1
1. تحديد حالة أكسدة ذرات العناصر الكيميائية في المركبات التالية: HNO₃ و NO₂ و H₃N و SO₂ و N₂O.
2. باستخدام الجدول الدوري ، رتب العناصر التالية بالترتيب لتقليل السالبية الكهربية: O ، N ، Be ، B ، Li ، C. حدد مكان وجود الفلور والصوديوم في هذا الصف. اشرح الجواب. 
3. كيف تتغير حالة أكسدة ذرة الكبريت أثناء أكسدة SO₂ إلى SO₃؟ اشرح الجواب.
الخيار 2
1. تحديد حالة أكسدة ذرات العناصر الكيميائية في المركبات التالية: CO₂ ، H₃PO₄ ، SiH₄ ، P₂O₅ ، Mg₂Si.
2. في اتجاه ذرات عنصر كيميائي مشترك أزواج إلكترونية، في جزيئات المركبات التالية: BF₃ ، PCl₃ ، CS₂ ، CCl₄ ، HBr؟ أعط إجابة منطقية.
3. هل تتغير حالة أكسدة الكربون أثناء التكوين حمض الكربونيك H₂CO₃ مصنوعة من ثاني أكسيد الكربون والماء؟ اشرح الجواب.
الخيار 3
1. تحديد حالة أكسدة ذرات العناصر الكيميائية في المركبات التالية: Cl₂ ، NaClO ، CaCl₂ ، HF ، SO₃ ، Cl₂O.
2. باستخدام النظام الدوري العناصر الكيميائية ، رتب العناصر التالية بترتيب تصاعدي لسلبيتها الكهربية: P ، Al ، Cl ، Na ، S ، Mg. ابحث عن بقعة في هذا الصف للبوتاسيوم والفلورايد. اشرح الجواب. 
3. كيف تتغير حالة أكسدة الكربون عند احتراق الميثان CH مع تكوين أول أكسيد الكربون (IV) والماء؟ اشرح الجواب.
الخيار 4
1. تحديد حالة أكسدة ذرات العناصر الكيميائية في المركبات التالية: H₂SO₄ و SO₂ و NO₂ و BF₃ و H₂S.
2. نحو ذرات ما العناصر الكيميائية يتم إزاحة أزواج الإلكترون الشائعة ، في جزيئات المركبات التالية: H₂O ، PCl₃ ، H₃N ، H₂S ، CO₂؟ أعط إجابة منطقية.
3. هل تتغير حالات أكسدة الذرات عندما يتكون الماء منها مواد بسيطة - الهيدروجين والأكسجين؟ اشرح الجواب.


