Електронегативні називається властивість хімічного елемента притягувати до свого атому електрони від атомів інших елементів, з якими даний елемент утворює хімічний зв'язок в з'єднаннях.
При утворенні хімічного зв'язку між атомами різних елементів загальне електронне хмара зміщується до більш електронегативного атома, через що зв'язок стає ковалентно-полярної, а при великій різниці електронегативності - іонної.
Електронегативність враховується при написанні хімічних формул: в бінарних сполуках ззаду записується символ найбільш електронегативного елемента.
Електронегативність зростає в напрямку зліва направо для елементів кожного періоду і зменшується в напрямку зверху вниз для елементів однієї і тієї ж групи ПС.
валентністю елемента називається властивість його атомів з'єднуватися з певним числом інших атомів.
Розрізняють Стехіометрична, електронну валентність і координаційне число. Ми розглянемо тільки Стехіометрична валентність.
Стехіометрична валентність показує, скільки атомів іншого елемента приєднує атом даного елемента. За одиницю валентності прийнята валентність водню, тому що водень завжди одновалентен. Наприклад, в з'єднаннях HCl, H 2 O, NH 3 (правильне написання аміаку Н 3 N вже використовується в сучасних посібниках), СН 4 хлор одновалентен, кисень двухвалентен, азот трехвалентен і вуглець чотиривалентний.
Стехіометрична валентність кисню зазвичай дорівнює 2. Так як майже всі елементи утворюють сполуки з киснем, то зручно його використовувати як еталон для визначення валентності іншого елемента. Наприклад, в з'єднаннях Na 2 O, CoO, Fe 2 O 3, SO 3 натрій одновалентен, кобальт двухвалентен, залізо тривалентне, сірка шестивалентного.
В окисно-відновних реакціях нам важливо буде визначати ступеня окислення елементів.
ступенем окислення елемента в речовині називається його стехіометрична валентність, взята зі знаком плюс або мінус.
Хімічні елементи поділяються на елементи постійної валентності елементи змінної валентності.
1.3.3. Речовини молекулярного і немолекулярного будови. Тип кристалічної решітки. Залежність властивостей речовин від їх складу і будови.
Залежно від того, в якому стані з'єднання знаходяться в природі, вони діляться на молекулярні і немолекулярное. В молекулярних речовинах найдрібнішими структурними частинками є молекули. Ці речовини мають молекулярну кристалічну решітку. У немолекулярное речовинах найдрібнішими структурними частинками є атоми або іони. Кристалічна решітка у них атомна, іонна або металева.
Тип кристалічної решітки багато в чому визначає властивості речовин. Наприклад, метали, що мають металевий тип кристалічної решітки, Відрізняються від всіх інших елементів високою пластичністю, електро- і теплопровідністю. Ці властивості, а також і багато інших - гнучкість, металевий блиск і т.п. обумовлені особливим видом зв'язку між атомами металу - металевим зв'язком. Необхідно відзначити, що властивості, притаманні металам, проявляються тільки в конденсованому стані. Наприклад, срібло в газоподібному стані не володіє фізичними властивостями металів.
Особливий тип зв'язку в металах - металева - обумовлений дефіцитом валентних електронів, тому вони загальні для всієї структури металу. Найбільш проста модель будови металів передбачала, що кристалічна решітка металів складається з позитивних іонів, оточених вільними електронами, рух електронів відбувається хаотично, подібно до молекул газу. Однак така модель, якісно пояснюючи багато властивостей металів, при кількісної перевірки виявляється недостатньою. Подальша розробка теорії металевого стану призвела до створення зонної теорії металів, Яка ґрунтується на уявленнях квантової механіки.
У вузлах кристалічної решітки знаходяться катіони і атоми металу, а електрони вільно переміщаються по кристалічній решітці.
Характерним механічною властивістю металів є пластичність, Обумовлена \u200b\u200bособливостями внутрішньої будови їх кристалів. Під пластичністю розуміють здатність тіл під дією зовнішніх сил піддаватися деформації, яка залишається і після припинення зовнішнього впливу. Це властивість металів дозволяє надавати їм різну форму при куванні, прокатувати метал в листи або витягати в дріт.
Пластичність металів обумовлена \u200b\u200bтим, що при зовнішньому впливі шари іонів, що утворюють кристалічну решітку, зсуваються відносно один одного без розриву. Це відбувається в результаті того, що перемістилися електрони завдяки вільному перерозподілу продовжують здійснювати зв'язок межу іонними шарами. При механічній дії на тверду речовину з атомної гратами зміщуються окремі її шари і зчеплення між ними порушується через розрив ковалентних зв'язків.
іони, То ці речовини утворюють іонний тип кристалічної решітки.

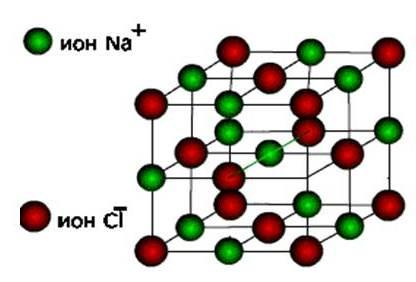
Це солі, а також оксиди і гідроксиди типових металів. Це тверді, крихкі речовини, але основне їх якість : Розчини і розплави цих з'єднань проводять електричний струм.
Якщо в вузлах кристалічної решітки знаходяться атоми, То ці речовини утворюють атомний тип кристалічної решітки(Алмаз, бор, кремній оксиди алюмінію і кремнію). За властивостями дуже тверді і тугоплавкі, нерозчинні у воді.
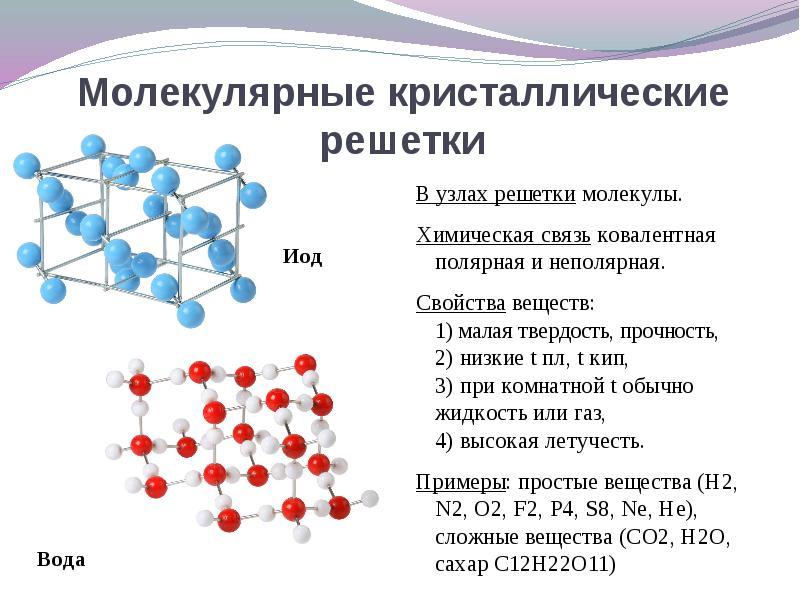
Якщо в вузлах кристалічної решітки знаходяться молекули, То ці речовини утворюють (при звичайних умовах гази і рідини: О 2, HCl; I 2 органічні речовини).
Цікаво відзначити метал галій, який плавиться при температурі 30 о С. Ця його аномалія пояснюється тим, що в вузлах кристалічної решітки знаходяться молекули Ga 2 і його властивості в чому стають схожі з речовинами, що мають молекулярну кристалічну решітку.
Приклад.Немолекулярное будова мають всі неметали групи:
1) вуглець, бор, кремній; 2) фтор, бром, йод;
3) кисень, сірка, азот; 4) хлор, фосфор, селен.
У немолекулярное речовинах найдрібнішими структурними частинками є атоми або іони. Кристалічна решітка у них атомна, іонна або металева
при рішенні цього питання простіше йти від протилежного. Якщо в вузлах кристалічної решітки знаходяться молекули, То ці речовини утворюють молекулярний тип кристалічної решітки(При звичайних умовах гази і рідини: О 2, HCl; також I 2, ромбічна сірка S 8, білий фосфор Р 4, органічні речовини). За властивостями це неміцні легкоплавкі з'єднання.
У другій відповіді є газ фтор, в третьому - гази кисень, азот, в четвертому - газ хлор. Значить, ці речовини мають молекулярну кристалічну решітку і молекулярну будову.
В першому відповіді все речовини - тверді з'єднання при звичайних умовах і утворюють атомну решітку, значить, мають немолекулярное будова.
Правильну відповідь:1) вуглець, бор, кремній
- Найменш електронегативним є хімічний елемент
- залізо
- магній
- кальцій
Слід звернути увагу на словосполучення «найменш електронегативний», т. Е. Елемент з найбільшими металевими властивостями. Цей аргумент дозволить виключити з можливих відповідей азот, як неметалл, і зупинитися на кальції, як найбільш активному із запропонованих в завданні металів. Відповідь: 4.
- Найбільш полярна хімічний зв'язок в одній з молекул
- ССl 4
- СВR 4
Знання закономірностей зміни електронегативності в періодах і групах періодичної системи Д. І. Менделєєва дозволяє виключити зі списку четирехвалентних з'єднань вуглецю метан СН 4, а з решти галогенідів зупинитися на CF 4, як на з'єднанні вуглецю з найбільш електронегативний з усіх хімічних елементів - фтором. Відповідь: 2.
- У молекулах хлороводню і хлору хімічний зв'язок відповідно
- іонна і ковалентний полярна
- іонна і ковалентний неполярний
- ковалентная полярна і ковалентний неполярний
- воднева і ковалентний неполярний
Ключовим словом для швидкого і вірного виконання цього завдання є слово «відповідно». У запропонованих варіантах тільки один з відповідей починається зі слів «ковалентная полярна», т. Е. Зв'язку, характерною для хлороводню. Відповідь: 3.
- Ступінь окислення марганцю в з'єднанні, формула якого К2 МnO 4, дорівнює
Знання правил розрахунку ступенів окислення елементів за формулою дозволить вибрати правильну відповідь. Відповідь: 3.
- Найменший ступінь окислення має сірка в солі
- сульфат калію
- сульфит калію
- сульфід калію
- гидросульфат калію
Очевидно, швидкому виконанню цього завдання сприятиме переклад назв солей в формули. Так як сірка - елемент VIA групи, то її найменший ступінь окислення дорівнює -2. Цьому значенню відповідає сполука з формулою K 2 S - сульфід калію. Відповідь: 3.
- Ступінь окислювання +5 атом хлору має в іоні
- С1O - 4
- С1O -
- С1O - 3
- С1O - 2
При виконанні цього завдання слід звернути увагу на те, що в умови подані не електронейтральні з'єднання, а іони хлору з одиничним негативним зарядом ( «-»). Оскільки сума ступенів окислення атомів в іоні дорівнює заряду іона, сумарний негативний заряд атомів кисню в шуканому йоні повинен мати значення -6 (+5 - 6 \u003d -1). Відповідь: 3.
- Ступінь окислення -3 азот має в кожному з двох з'єднань
- NF 3 І NH 3
- NH 4 Cl і N 2 O 3
- NH 4 Cl і NH 3
- HNO 2 і NF 3
Для визначення вірної відповіді необхідно подумки розділити варіанти відповідей на лівий і правий подстолбікі. Потім вибрати той, в якому з'єднання мають більш простий склад, - в нашому випадку це правий подстолбік бінарних сполук. Аналіз дозволить виключити відповіді 2 і 4, так як в оксиді і фториді у азоту позитивна ступінь окислення, як у менш електронегативного елемента. Цей аргумент дозволяє виключити і відповідь 1, так як в ньому перша речовина - все той же фторид азоту. Відповідь: 3.
- До речовин молекулярногобудови не належать
- вуглекислий газ
- метан
- хлороводород
- карбонат кальцію
Слід звернути увагу на негативне судження, закладене в умові завдання. Так як газоподібні при звичайних умовах речовини мають в твердому стані молекулярну кристалічну решітку, то умові завдання не відповідають варіанти 1-3. Віднесення карбонату кальцію до солей ще раз підтвердить вірну відповідь. Відповідь: 4.
- Чи вірні наступні судження про властивості речовин і їх будову?
А. Мокре білизна висихає на морозі тому, що речовини молекулярної будови здатні до сублімації (сублімації).
Б. Мокре білизна висихає на морозі тому, що молекули води мають низьку молекулярну масу.
- вірно тільки А
- вірно тільки Б
- вірні обидва судження
- обидва судження не вірні
знання фізичних властивостей речовин молекулярної будови дозволяє вирішити, що причиною висихання мокрого білизни на морозі є здатність льоду до сублімації, а не дипольне будова молекул води. Відповідь: 1.
- Молекулярну будову має кожне з речовин, формули яких наведені в ряду
- СО2, HNO 3, СаО
- Na 2 S, Br 2, NO 2
- H 2 SO 4, Сu, O 3
- SO 2, I 2, НСl
Так як запропоновані варіанти містять по три речовини, логічно подумки розділити ці варіанти на три вертикальних подстолбіка. Аналіз кожного з них, починаючи з речовин більш простого складу (середній подстолбік), дозволить виключити відповідь 3, так як в ньому міститься метал мідь, що має металеву кристалічну решітку. Аналогічний аналіз правого подстолбіка дозволить виключити відповідь 1, так як він містить оксид лужноземельні метали (іонна решітка). З двох варіантів, що залишилися необхідно виключити варіант 2, так як він містить сіль лужного металу - сульфід натрію (іонна решітка). Відповідь: 4.
Завдання для самостійної роботи
- Ступінь окислювання +5 азот проявляє в з'єднанні, формула якого
- N 2 O 5
- N 2 O 4
- N 2 O
- Ступінь окислення хрому в з'єднанні, формула якого (NH 4) 2 Cr 2 O 7, дорівнює
- Ступінь окислення азоту зменшується в ряду речовин, формули яких
- NH 3, NO 2, KNO 3
- N 2 O 4, KNO 2, NH 4 Cl
- N 2, N 2 O, NH 3
- HNO 3, HNO 2, NO 2
- Ступінь окислення хлору збільшується в ряду речовин, формули яких
- НСlO, НСlO 4, КСlO 3
- Сl 2, С1 2 O 7, КСlO 3
- Са (С1O) 2, КСlO 3, НСlO 4
- КСl, КСlO 3, КСlO
- Найбільш полярна хімічний зв'язок в молекулі
- аміаку
- сірководню
- бромоводорода
- фтороводорода
- Речовина з ковалентним неполярной зв'язком
- білий фосфор
- фосфід алюмінію
- хлорид фосфору (V)
- фосфат кальцію
- Формули речовин тільки з іонним зв'язком записані в ряду
- хлорид натрію, хлорид фосфору (V), фосфат натрію
- оксид натрію, гідроксид натрію, пероксид натрію
- сірковуглець, карбід кальцію, оксид кальцію
- фторид кальцію, оксид кальцію, хлорид кальцію
- Атомну кристалічну решітку має
- оксид натрію
- оксид кальцію
- оксид сірки (IV)
- оксид алюмінію
- З'єднання з іонної кристалічною решіткою утворюється при взаємодії хлору з
- фосфором
- барієм
- воднем
- сірої
- Чи вірні наступні судження про хлориде амонію?
А. Хлорид амонію - речовина іонного будови, утворене за рахунок ковалентного полярної і іонної зв'язків.
Б. Хлорид амонію - речовина іонного будови, а тому тверде, тугоплавкое і нелетку.
- вірно тільки А
- вірно тільки Б
- вірні обидва судження
- обидва судження невірні
08. Електронегативність, ступінь окислення, окислення і відновлення
Давайте обговоримо сенс вкрай цікавих понять, існуючих в хімії, і як часто буває в науці, досить заплутаних, і використовуваних в перевернутому вигляді. Йтиметься про «електронегативності», «ступеня окислення» і «окислювально-відновні реакції».
Що це означає - поняття використовується в перевернутому вигляді?
Постараємося поступово розповісти про це.
електронегативність демонструє нам окислювально-відновні властивості хімічного елемента. Т. е. Його здатність забирати або віддавати вільні фотони. А також чи є даний елемент джерелом або поглиначем енергії (ефіру). Ян або Інь.
Ступінь окислення - це поняття, аналогічне поняттю «електронний торгівельний». Воно теж характеризує окислювально-відновні властивості елемента. Але між ними є наступна різниця.
Електронегативність дає характеристику окремо взятому елементу. Самому по собі, поза знаходження його в складі будь-якої хімічної сполуки. У той час як ступінь окислення характеризує його окислювально-відновні здатності саме тоді, коли елемент входить до складу будь-якої молекули.
Давайте трохи поговоримо про те, що таке здатність окисляти, і що таке здатність відновлювати.
окислення - це процес передачі іншому елементу вільних фотонів (електронів). Окислення - це зовсім не відібрання електронів, як це нині вважається в науці . Коли елемент окисляє інший елемент, він діє подібно кислоті або кисню (звідси і назва «окислення»). Окисляти - значить сприяти руйнуванню, розпаду, горіння елементів . Здатність окислювати - це здатність викликати руйнування молекул переданої їм енергією (вільними фотонами). Пам'ятайте про те, що енергія завжди руйнує речовина.
Дивно, як довго в науці існують протиріччя в логіці, ніким не помічені.
Ось, наприклад: «Тепер ми знаємо, що окислювач - речовина, яка набуває електронів, а відновник - речовина, яка їх віддає» (Енциклопедія юного хіміка, стаття «Редокс)».
І тут же, двома абзацами нижче: «Найбільш сильний окислювач - електричний струм (потік негативно заряджених електронів)» (там же).
Тобто в першій цитаті йдеться, що окислювач - це те, що приймає електрони, а в другій окислювачем називають те, що віддає.
І подібні помилкові, що суперечать один одному висновки змушують заучувати в школах і інститутах!
Відомо, що найкращі окислювачі - це неметали. Причому, чим менше номер періоду і більше номер групи, тим сильніше виражені властивості окислювача. Це й не дивно. Ми розбирали причини цього в статті, присвяченій аналізу періодичної системи, в другій частині, де говорили про колір нуклонів. Від 1 групи до 8 колір нуклонів в елементах поступово змінюється від фіолетового до червоного (якщо врахувати ще синій колір d- і f-елементів). Поєднання жовтих і червоних частинок полегшує віддачу накопичуються вільних фотонів. Жовті накопичують, але утримують слабо. А червоні сприяють віддачі. Віддавати фотони - це і є процес окислення. Але коли одні червоні, то немає частинок, здатних накопичувати фотони. Саме тому елементи 8 групи, благородні гази, що не окислювачі, на відміну від їхніх сусідів, галогенів.
відновлення - це процес, протилежний окислення. Нині, в науці, вважається, що коли хімічний елемент отримує електрони, він відновлюється. Таку точку зору цілком можна зрозуміти (але не прийняти). При вивченні будови хімічних елементів, було виявлено, що вони випускають електрони. Зробили висновок, що електрони входять до складу елементів. Значить, передача елементу електронів - це, свого роду, відновлення його втраченої структури.
Однак насправді все не так.
Електрони - це вільні фотони. Вони - не нуклони. Вони не входять до складу тіла елемента. Вони притягуються, вступаючи ззовні, і накопичуються на поверхні нуклонів і між ними. Але їх накопичення веде зовсім не до відновлення структури елемента або молекули. Навпаки, ці фотони випускаються ними ефіром (енергією), послаблюють і руйнують зв'язки між елементами. А це процес окислення, але не відновлення.
Відновлювати молекулу, в дійсності, - забирати у неї енергію (в даному випадку, вільні фотони), а не повідомляти. Відбираючи фотони, елемент-відновник ущільнює речовина - відновлює його.
Кращі відновники - метали. Це властивість закономірно випливає з їх якісно-кількісного складу - їх Поля Притяжения найбільші і на поверхні обов'язково присутній багато або достатньо частинок синього кольору.
Можна навіть вивести наступне визначення металів.
метал - це хімічний елемент, в складі поверхневих шарів якого обов'язково є сині частки.
А неметалл - це елемент, в складі поверхневих шарів якого немає або майже немає фотонів синього кольору, і обов'язково є червоні.
Метали своїм сильним тяжінням прекрасно забирають електрони. І тому вони відновники.
Дамо визначення понять «електронний торгівельний», «ступінь окислення», «окислювально-відновні реакції», які можна зустріти в підручниках з хімії.
« Ступінь окислення - умовний заряд атома в з'єднанні, обчислений виходячи з припущення, що воно складається лише з іонів. При визначенні цього поняття умовно вважають, що сполучні (валентні) електрони переходять до більш електронегативний атомів, а тому з'єднання складаються як би з позитивно і негативно заряджених іонів. Ступінь окислювання може мати нульове, негативне і позитивне значення, які зазвичай ставляться над символом елемента зверху.
Нульове значення ступеня окислення приписується атомам елементів, що знаходяться у вільному стані ... Негативне значення ступеня окислення мають ті атоми, в сторону яких зміщується сполучна електронну хмару (електронна пара). У фтору у всіх його з'єднаннях вона дорівнює -1. Позитивну ступінь окислення мають атоми, що віддають валентні електрони інших атомів. Наприклад, у лужних і лужноземельних металів вона відповідно дорівнює +1 і +2. У простих іони вона дорівнює заряду іона. У більшості з'єднань ступінь окислення атомів водню дорівнює + 1, але в гидридах металів (з'єднаннях їх з воднем) і інших - вона дорівнює -1. Для кисню характерна ступінь окислення -2, але, наприклад, в поєднанні з фтором вона буде +2, а в перекисних з'єднаннях -1. ...
Алгебраїчна сума ступенів окислення атомів у сполуці дорівнює нулю, а в складному йоні - заряду іона. ...
Вища ступінь окислення - це найбільший позитивний її значення. Для більшості елементів вона дорівнює номеру групи в періодичній системі і є важливою кількісною характеристикою елемента в його з'єднаннях. Найменше значення ступеня окислення елемента, яке зустрічається в його з'єднаннях, прийнято називати нижчої ступенем окислення; всі інші - проміжними »(Енциклопедичний словник юного хіміка, стаття« Ступінь окислювання »).
Ось основні відомості, що стосуються даного поняття. Воно тісно пов'язане з іншим терміном - «електронний торгівельний».
« електронегативність - це здатність атома в молекулі притягати до себе електрони, які беруть участь в утворенні хімічного зв'язку »(Енциклопедичний словник юного хіміка, стаття« Електронегативність »).
«Редокс супроводжуються зміною ступеня окислення атомів, що входять до складу реагуючих речовин, в результаті переміщення електронів від атома одного з реагентів (відновника) до атому іншого. При окисно-відновних реакціях одночасно відбуваються окислювання (віддача електронів) і відновлення (приєднання електронів) »(Хімічний Енциклопедичний Словник під ред. І.Л. Кнунянц, стаття« Редокс »).
На наш погляд, в цих трьох поняттях приховано чимало помилок.
По перше , Ми вважаємо, що утворення хімічного зв'язку між двома елементами - це зовсім не процес усуспільнення їх електронів. Хімічна зв'язок - це гравітаційна зв'язок. Електрони, нібито літаючі навколо ядра, це вільні фотони, що накопичуються на поверхні нуклонів в складі тіла елемента і між ними. Для того, щоб між двома елементами виникла зв'язок, їх вільним фотонам немає потреби курсувати між елементами. Цього не відбувається. Насправді, більш важкий елемент знімає (притягує) вільні фотони з більш легкого, і залишає їх у себе (точніше, на собі). А зона більш легкого елемента, з якої були зняті ці фотони, в тій чи іншій мірі оголюється. Через що тяжіння в цій зоні проявляється в більшій мірі. І більш легкий елемент притягається до важчого. Так виникає хімічний зв'язок.
По-друге , Сучасна хімія бачить здатність елементів притягувати до себе електрони спотворено - перевернуто. Вважається, що чим більше електронний торгівельний елемента, тим в більшій мірі він здатний притягувати до себе електрони. І фтор з киснем нібито роблять це краще за все - притягують до себе чужі електрони. А також інші елементи 6 і 7 груп.
Насправді, дана думка - це не більше, ніж оману. Воно засноване на помилковому уявленні, ніби чим більше номер групи, тим важче елементи. А також, тим більше позитивний заряд ядра. Це дурниця. Вчені навіть не спромагаються досі пояснити, що з їх точки зору являє собою «заряд». Просто, як в нумерології, перерахували всі елементи по порядку, і проставили відповідно до номером величину заряду. Чудовий похід!
Це ясно і дитині, що газ легше щільного металу. Як так вийшло, що в хімії вважається, що гази краще притягують до себе електрони?
Щільні метали, звичайно, вони, краще притягують електрони.
Вчені-хіміки, звичайно, можуть залишити в ходу поняття «електронний торгівельний», якщо вже воно настільки уживане. Однак їм доведеться поміняти його зміст на прямо протилежний.
електронегативність - це здатність хімічного елемента в молекулі притягувати до себе електрони. І, природно, у металів ця здатність виражена краще, ніж у неметалів.
Що ж стосується електричних полюсів в молекулі, то, дійсно, негативний полюс - це елементи неметали, що віддають електрони, з меншими Полями Притяжения. А позитивний - це завжди елементи з більш вираженими металевими властивостями, з великими Полями Притяжения.
Посміхнемося разом.
електронегативність - це ще одна, чергова спроба описати якість хімічного елемента, поряд з вже існуючими масою і зарядом. Як це часто буває, вчені з іншої області науки, в даному випадку, хімії, ніби не довіряючи своїм колегам фізикам, а, скоріше, просто тому, що будь-яка людина, здійснюючи відкриття, йде своїм власним шляхом, а не просто досліджуючи досвід інших.
Так вийшло і цього разу.
Маса і заряд ніяк не допомагали хімікам зрозуміти, що відбувається в атомах при їх взаємодії один з одним - і була введена електронний торгівельний - здатність елемента притягувати електрони, які беруть участь в утворенні хімічного зв'язку. Слід визнати, що ідея цього поняття закладена дуже вірно. З тією лише поправкою, що вона відображає реальність в перевернутому вигляді. Як ми вже говорили, найкраще притягують до себе електрони метали, а не неметали - в силу особливостей кольору поверхневих нуклонів. Метали - кращі відновники. Неметали - окислювачі. Метали забирають, неметали віддають. Метали - Інь, неметали - Ян.
Езотерика приходить на допомогу науці в питаннях осягнення таємниць Природи.
Що стосується ступеня окислення , То це хороша спроба зрозуміти, як відбувається розподіл вільних електронів в межах хімічної сполуки - молекули.
Якщо хімічна сполука однорідно - т. Е. Воно просте, його структура складається з елементів одного типу - тоді все вірно, дійсно ступінь окислення будь-якого елемента в з'єднанні дорівнює нулю. Так як в даному з'єднанні немає окислювачів і немає восстановителей. І все елементи рівні за якістю. Ніхто не забирає електрони, ніхто не віддає. Будь це щільне речовина, або рідина, або газ - неважливо.
Ступінь окислювання, так само, як електронний торгівельний, демонструє якість хімічного елемента - тільки в рамках хімічного елемента. Ступінь окислювання покликана порівняти якість хімічних елементів в з'єднанні. На наш погляд, ідея хороша, але її здійснення не цілком задовольняє.
Ми категорично проти всієї теорії і концепції будови хімічних елементів і зв'язків між ними. Ну, хоча б тому, що число груп, за нашими уявленнями, має бути більше 8. А значить, вся ця система руйнується. Та й не тільки це. Взагалі, перераховувати число електронів в атомах «на пальцях» - це якось несерйозно.
Відповідно до нинішньої концепцією виходить, що найсильнішим окислювача присвоєні найменші умовні заряди - фтор має в усіх з'єднаннях заряд -1, кисень майже всюди -2. А у дуже активних металів - лужних і лужноземельних - ці заряди відповідно, +1 і +2. Адже це зовсім не логічно. Хоча, повторимо, ми дуже добре розуміємо загальну схему, відповідно до якої це було зроблено - все заради 8 груп в таблиці і 8 електронів на зовнішньому енергетичному рівні.
Уж, як мінімум, величина цих зарядів у галогенів і кисню повинна була бути найбільшою зі знаком мінус. А у лужних і лужноземельних металів теж великий, тільки зі знаком плюс.
В будь-якому хімічній сполуці є елементи, що віддають електрони - окислювачі, неметали, негативний заряд, і елементи, що віднімають електрони - відновники, метали, позитивний заряд. Саме таким шляхом порівняти елементи, співвіднести їх один з одним і намагаються, визначаючи їх ступінь окислення.
Однак з'ясовувати таким способом ступінь окислення, на наш погляд, не зовсім точно відображає реальність. Правильніше було б порівнювати електронний торгівельний елементів в молекулі. Адже електронний торгівельний - це майже те ж, що і ступінь окислення (характеризує якість, тільки окремо взятого елемента).
Можна взяти шкалу електронегативності і проставити її величини у формулі для кожного елемента. І тоді відразу буде видно, які елементи віддають електрони, а які забирають. Той елемент, чия електронний торгівельний в з'єднанні найбільша - негативний полюс, віддає електрони. А той, чия електронний торгівельний найменша - позитивний полюс, забирає електрони.
Якщо елементів, припустимо, 3 або 4 в молекулі, нічого не змінюється. Всі також ставимо величини електронегативності і порівнюємо.
Хоча при цьому варто не забути намалювати модель будови молекули. Адже в будь-якому поєднанні, якщо воно не просте, т. Е. Не перебуває з одного типу елементів, пов'язані один з одним, в першу чергу, метали і неметали. Метали відбирають електрони у неметалів, і зв'язуються з ними. І у одного елемента неметалла одночасно можуть відбирати електрони 2 або більше число елементів з більш вираженими металевими властивостями. Так виникає складна, комплексна молекула. Але це не означає, що в такій молекулі елементи-метали вступлять в міцний зв'язок і один з одним. Можливо, вони будуть розташовуватися на протилежних сторонах один від одного. Якщо ж поруч - вони будуть притягатися. Але міцний зв'язок утворюють тільки в тому випадку, якщо один елемент більш металеві, ніж інший. Обов'язково потрібно, щоб один елемент відбирав електрони - знімав. Інакше не відбудеться оголення елемента - звільнення від вільних фотонів на поверхні. Поле Притяжения не проявиться цілком, і міцного зв'язку не буде. це складна тема - утворення хімічних зв'язків, І ми не будемо докладно розповідати про це в цій статті.
Вважаємо, ми досить детально висвітлили тему, присвячену розбору понять «електронний торгівельний», «ступінь окислення», «окислення» і «відновлення», і надали вашій увазі чимало цікавої інформації.
З книги Керовані сни автора Мир ОленаВідновлення «Коли зароджується Єдиний ознака інді-відуаціі, сутність і життя поділяються надвоє. З цього моменту, якщо не досягнуть остаточний мир, сутність і життя ніколи не побачать один одного знову ». Вільям, «Таємниця золотого квітки» Після університетського
З книги Книга секретів. Неймовірне очевидне на Землі і за її межами автора Вяткін Аркадій ДмитровичМазохізм як крайня ступінь добровільного вампіризму У цьому сенсі мазохізм схожий на співзалежність. Мазохісти - це люди, які отримують приємні відчуття від власних фізичних і психічних страждань. Іншими словами, їм подобається, коли їх б'ють, лають, знущаються над
З книги Вампіри в Росії. Все, що потрібно знати про них! автора Бауер ОлександрЯк визначити ступінь втрати крові Коли вампір п'є кров, то випиває за один раз від півлітра до півтора літрів крові. В організмі людини міститься всього п'ять-шість літрів крові, так що така крововтрата не обов'язково небезпечна для життя. Однак вампір може
З книги Моделювання майбутнього уві сні автора Мир ОленаВідновлення Після університетського розподілу, працюючи інженером на закритому підприємстві, я зрозуміла, що знаходжуся не на своєму місці, тому зважилася змінити професію і вступила в джазову школу імпровізації, а пізніше в музичне училище на класичне відділення.
З книги Золоті правила феншуй. 10 простих кроків до успіху, благополуччя і довголіття автора Огудини Валентин ЛеонідовичСтупінь негативного впливу зовнішніх об'єктів Найбільший негативний вплив зовнішні об'єкти надають, перебуваючи безпосередньо перед входом в будинок. Але чим більше вони розташовані під кутом до входу, тим менше стає їх вліяніе.Об'ект знаходиться безпосередньо
автора Шюре ЕдуардПерша ступінь: Приготування. Нагірна проповідь і Царство Боже Справа Христа починається галілейської ідилією і оголошенням про «царство Боже». Це пророцтво вказує нам на його популярні настанови. У той же час воно є приготуванням до більш піднесеним
З книги Божественна еволюція. Від Сфінкса до Христа автора Шюре ЕдуардДруга ступінь посвяти (очищення). Чудесні зцілення. Християнська терапія У всіх античних містерій за моральним і інтелектуальним приготуванням слід очищення душі, яка повинна відродити в ній нові органи і надати їй згодом здатність
З книги Загадка Великого сфінкса автора Барбарен ЖоржВідновлення статуї Дійсний вік Великого сфінкса сягає початку Адамової ери. Щонайменше, він сучасник пірамід, ансамбль яких він, як ми побачимо, завершив собой.Ізображеніе Великого сфінкса піддавалося протягом минулих століть
З книги Зцілення душі. 100 медитативних технік, цілющих вправ і релаксації автора Раджниш Бхагван ШріВідновлення ритму ... Встановіть один і той же час, щоб лягати спати, - якщо кожен вечір це одинадцять, значить, одіннадцать.Ето перша: заведіть певний час, і незабаром тіло зможе увійти в цей ритм. Не змінюйте цей час, інакше ви зіб'єте тіло з пантелику. тіло
автора Кузьмишин Е. Л.Ступінь Учня Прийом в ступінь Учня Оздоблення ложі і облаченіяСтени і стелю ложі повинні бути завішені блакитною і білою матерією без позолоти. Над головою Високоповажного Майстра розташований оточений сяйвом трикутник з накресленим в його центрі ім'ям
З книги Каліостро і єгипетське масонство автора Кузьмишин Е. Л.Прийом в ступінь Учня Оздоблення ложі і облаченіяСтени і стелю ложі повинні бути завішені блакитною і білою матерією без позолоти. Над головою Високоповажного Майстра розташований оточений сяйвом трикутник з накресленим в його центрі ім'ям «Єгова», вишитий
З книги Автобіографія Йога автора Йогананда ПарамахансаГлава 23 Я отримую університетський ступінь - Ви ігноруєте філософські визначення з підручника, безсумнівно розраховуючи, що якась неутруждающая «інтуїція» проведе вас через всі іспити. Але якщо ви терміново не звернетеся до більш науковому методу, то мені доведеться
З книги Каббала. Вищий світ. Початок шляху автора Лайтман Міхаель7.5. Ступінь усвідомлення зла Як пояснювалося в статті «Дарування Тори», насолоду і блаженство визначаються ступенем подібності Творця за властивостями, а страждання і нетерпіння - ступенем відзнаки від Творця. Згідно з цим, егоїзм нам огидний і нестерпно тяжкий,
Варіант 1
1. Визначте ступінь окислення атомів хімічних елементів в наступних сполуках: HNO₃, NO₂, H₃N, SO₂, N₂O.
2. Користуючись періодичною таблицею, розташуйте в порядку зменшення електронегативності наступні елементи: O, N, Be, B, Li, C. Визначте, де в цьому ряду повинні розташовуватися фтор і натрій. Поясніть відповідь. 
3. Як змінюється ступінь окислення атома сірки при окисленні SO₂ до SO₃? Відповідь поясніть.
Варіант 2
1. Визначте ступінь окислення атомів хімічних елементів в наступних сполуках: CO₂, H₃PO₄, SiH₄, P₂O₅, Mg₂Si.
2. В сторону атомів якого хімічного елемента зміщуються загальні електронні пари, В молекулах наступних сполук: BF₃, PCl₃, CS₂, CCl₄, HBr? Дайте обґрунтовану відповідь.
3. Чи змінюється ступінь окислення вуглецю при утворенні вугільної кислоти H₂CO₃ з вуглекислого газу і води? Відповідь поясніть.
варіант 3
1. Визначте ступінь окислення атомів хімічних елементів в наступних сполуках: Cl₂, NaClO, CaCl₂, HF, SO₃, Cl₂O₇.
2. Користуючись періодичної системою хімічних елементів, розташуйте наступні елементи в порядку зростання їх електронегативності: P, Al, Cl, Na, S, Mg. Знайдіть в цьому ряду місце для калію і фтору. Відповідь поясніть. 
3. Як змінюється ступінь окислення вуглецю при спалюванні метану CH₄ з утворенням оксиду вуглецю (IV) і води? Відповідь поясніть.
варіант 4
1. Визначте ступінь окислення атомів хімічних елементів в наступних сполуках: H₂SO₄, SO₂, NO₂, BF₃, H₂S.
2. В сторону атомів якого хімічного елементів зміщуються загальні електронні пари, в молекулах наступних сполук: H₂O, PCl₃, H₃N, H₂S, CO₂? Дайте обґрунтовану відповідь.
3. Чи змінюються ступені окислення атомів при утворенні води з простих речовин - водню і кисню? Відповідь поясніть.


